菌dna提取方法
- 格式:doc
- 大小:10.77 KB
- 文档页数:2

中国生物电泳网 专业销售维修:各种电泳槽/电泳仪/紫外仪等电泳设备 http:
中国生物电泳网 专业销售维修:各种电泳槽/电泳仪/紫外仪等电泳设备 http: 各种DNA提取方法 一,基因组DNA提取方法 制备基因组DNA是进行基因结构和功能研究的重要步骤,通常要求得到的片段的长度不小于100-200kb。在DNA提取过程中应尽量避免使DNA断裂和降解的各种因素,以保证DNA的完整性,为后续的实验打下基础。主要是CTAB方法,其他的方法还有1物理方式:玻璃珠法超声波法研磨法冻融法。2化学方式:异硫氰酸胍法碱裂解法3生物方式:酶法。根据核酸分离纯化方式的不同有:硅质材料、阴离子交换树脂等 试验步骤: 1、贴壁细胞用胰酶消化,离心收集。 2、细胞重悬于冰冷的PBS漂洗一次,离心收集。试验步骤2再重新作一边。 3、加入5mlDNA提取缓冲液,(10mmol/LTris-cl0.1mol/LEDTAo.5%SDS)混匀。 4、加入25ul蛋白酶K使终浓度达到100ug/ml混匀,50℃水浴3h 5、用等体积的酚抽提一次,2500rpm离心收集水相,用等体积的(酚,氯仿,异戊醇)混合物抽提一次,2500r/min离心收集水相 6、用等体积的氯仿,异戊醇抽提一次。加入等体积的5mol/L的LiCL混匀,冰浴,10min.。 7、2500rpm离心10min.转上清于一离心管中。加入等体积的异丙醇。室温10min。 2500rpm离心10min。弃上清。 8、加入0.1倍体积3mol/L乙酸钠(PH5.2)与2倍体积-20℃预冷无水乙醇。-20℃20min。 9、12000r/min室温离心5min。弃上清。将DNA溶于适量TE中。 二,外周血DNA提取技术 分离外周血白细胞提取方法: 试验步骤: 1、取人肘静脉血5ml,EDTA抗凝,2500rpm离心10min。 2、小心吸取上层血浆,分装到3个0.5ml离心管中。 3、在血细胞中加入3倍体积的溶血液,摇匀,冰浴15min。 4、2500rpm离心10min,弃上清。 中国生物电泳网 专业销售维修:各种电泳槽/电泳仪/紫外仪等电泳设备 http:

DNeasy Blood & Tissue Kit (Qiagen, Hilden, Germany)试剂盒中文操作说明书
作者: Allanflying (站内联系TA) 发布: 2012-09-11
一.利用DNeasy® Blood & Tissue试剂盒提取样本总DNA
1.前处理:
注意:
1) 石蜡包埋组织的DNA一般小于650bp,还要视样本类型与保存年限而定。
2) 固定剂一般为福尔马林或酒精。不推荐用蛾酸固定的样本。
3) 溶解时间随样本类型和溶解状态而定。
4) 产量视样本类型和保存年限而定。推荐用50-100ul的AE缓冲液洗脱纯化的DNA。
5) 开始前要预热孵化器或水浴锅至37℃,用于操作步骤9)。
1.石蜡包埋组织的前处理
操作步骤:
1) 将小片石蜡包埋的组织(小于25mg)放入2ml离心管中(自备)。
2) 加入1200ul的二甲苯,用力涡旋震荡。
3) 最大转速室温(15-25°)离心5分钟。
4) 移液枪吸去上清。小心不要吸去沉淀。
5) 往沉淀中加1200ul的(96-100%)酒精(目的是洗去剩余二甲苯),轻柔地震荡。
6) 最大转速室温(15-25°)离心5分钟。
7) 移液枪吸去上清。小心不要吸去沉淀。
8) 重复一次步骤5-7。
9) 37°孵育10-15分钟,孵育过程打开离心管盖,直到酒精蒸发干净。
10) 加入180ul的ATL缓冲液,继续提取组织总DNA中的步骤2。
2.福尔马林组织的前处理
操作步骤:
1) 用PBS润洗组织样本(小于25mg)两次(目的是去除固定剂)。
2) 去PBS,继续提取组织总DNA中的步骤1.

1、剪碎叶片,放入2ml离心管中,加入2颗钢珠,加入750ul CTAB提取液,放入粉碎机进行粉碎
2、放入65摄氏度烘箱30-60mins,最好45mins
3、加氯仿(500ul)
4、摇匀、离心(12000r 10mins)
5、离心后,吸取上清液(350-500ul) 于1.5ml离心管中
6、加酒精(500ul)
7、放置于-20摄氏度冰箱至少30mins
8、离心 (12000r 6mins)
9、倒掉上部液体
10、放入65摄氏度烘箱2h 或37摄氏度过夜
11、加dd水(300-500ul) 猛摇混匀,放室温2小时
1, shear the blade, in 2 ml centrifuge tube, add 2 steel balls, to join 750 ul
CTAB extraction liquid, put it into the crusher for crushing
2, placed into a 65 degrees oven for 30 to 60 mins, best 45 mins
3, chloroform (500 ul)
4, shake well, centrifugal (12000 r 10 mins)
5After the centrifugal, draw on the fluid (350-500 ul)In 1.5 ml centrifuge tube
6, add alcohol (500 ul)
7, placed in refrigerator for at least 30 mins (- 20 degrees Celsius)
8, centrifugal (12000 r 6 mins)
9, pour out the upper liquid
10, placedin a 65 degrees oven 2 h or 37 degrees Celsius for the night

转基因小鼠筛选——鼠尾提取基因组DNA方法
1. 小鼠分笼后打耳标,剪取小鼠尾尖3mm--5mm左右于1.5mL 离心管中,标记耳标号。
2. 配置消化液,每管加入消化液0.5mL,55℃,3-5h,或放置过夜。(最长可放置3天)。
3. 加1倍体积(0.5mL)PCI(下层液体),上下颠倒10余次。(PCI可分装出一些现用,以免操作不慎污染)。
4. 室温15000rpm离心,10min。
5. 小心取上清约0.4mL入新管,依次标号,加入异丙醇0.4mL,上下倒转10次左右。
6. 4℃,15000rpm离心,5min。
7. 弃上清,滤纸吸干,加入70%乙醇0.5mL,将管底沉淀弹起,上下颠倒几次,洗涤。
8. 4℃,15000rpm离心,5--7min。
9. 弃上清,瞬时离心,用枪吸干剩余液体,后经空气干燥5-10min。
10.加入1*TE 60-170μL一般加100μL,振荡30min溶解,于4℃冰箱保存。
注意事项:
1. 小鼠耳标与管号一一对应,在剪尾或提取DNA过程中如发生混淆,则应重新剪尾。
2. 配置消化液时,最后加蛋白酶K,配置完成后混合均匀再分装;分装后依次检查,确认每管的鼠尾都浸入在消化液中。尽量多配一些消化液,以免不够。
3. 提取DNA之前,先检查鼠尾消化情况,过夜消化后,一般只能观察到少量骨骼及鼠尾毛发,如观察到鼠尾组织,说明消化不完全,可能是时间不够或消化液配置不正确。
4. 由于实验中用到的PCI,异丙醇等对身体有害,因此在提取DNA和配置PCI时,应注意防护,戴好口罩和乳胶手套。
5. 实验过程中,应轻拿轻放,避免液体洒出,沾湿手套,洗去Marker笔字迹等情况的发生。为了防止耳标号被擦掉,最好连号摆放。
6. 吸取上清一步中,应保证上清质量,避免下层杂质的吸入,如不慎吸入,应将样品重新离心。
7. DNA沉淀一般呈白色或半透明胶状,混有杂质时可能带有黑色,提取过程中如观察不到沉淀,应做好标记,重新剪尾。
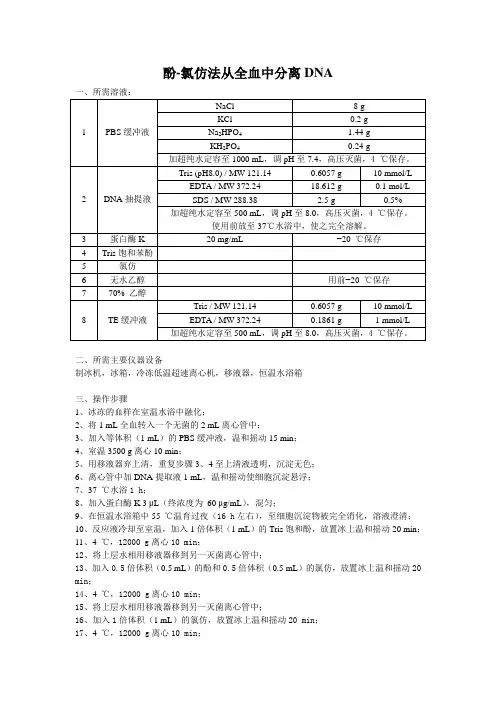
酚-氯仿法从全血中分离DNA
一、所需溶液:
1 PBS缓冲液 NaCl 8 g
KCl 0.2 g
Na2HPO4 1.44 g
KH2PO4 0.24 g
加超纯水定容至1000 mL,调pH至7.4,高压灭菌,4 ℃保存。
2 DNA抽提液 Tris (pH8.0) / MW 121.14 0.6057 g 10 mmol/L
EDTA / MW 372.24 18.612 g 0.1 mol/L
SDS / MW 288.38 2.5 g 0.5%
加超纯水定容至500 mL,调pH至8.0,高压灭菌,4 ℃保存。
使用前放至37℃水浴中,使之完全溶解。
3 蛋白酶K 20 mg/mL −20 ℃保存
4 Tris饱和苯酚
5 氯仿
6 无水乙醇 用前−20 ℃保存
7 70% 乙醇
8 TE缓冲液 Tris / MW 121.14 0.6057 g 10 mmol/L
EDTA / MW 372.24 0.1861 g 1 mmol/L
加超纯水定容至500 mL,调pH至8.0,高压灭菌,4 ℃保存。
二、所需主要仪器设备
制冰机,冰箱,冷冻低温超速离心机,移液器,恒温水浴箱
三、操作步骤
1、冰冻的血样在室温水浴中融化;
2、将1 mL全血转入一个无菌的2 mL离心管中;
3、加入等体积(1 mL)的PBS缓冲液,温和摇动15 min;
4、室温3500 g离心10 min;
5、用移液器弃上清,重复步骤3、4至上清液透明,沉淀无色;
6、离心管中加DNA提取液1 mL,温和摇动使细胞沉淀悬浮;
7、37 ℃水浴1 h;
8、加入蛋白酶K 3 μL(终浓度为 60 μg/mL),混匀;
9、在恒温水浴箱中55 ℃温育过夜(16 h左右),至细胞沉淀物被完全消化,溶液澄清;
10、反应液冷却至室温,加入1倍体积(1 mL)的Tris饱和酚,放置冰上温和摇动20 min;

油菜茎基溃疡病菌基因组DNA提取方法的比较
摘要:比较了油菜茎基溃疡病菌基因组DNA的尿素提取法、SDS-CTAB提取法、CTAB提取法和试剂盒提取法的提取过程、DNA纯度和对PCR扩增的影响,旨在筛选能替代昂贵试剂盒法的方法。结果表明,尿素提取法可以满足DNA的PCR扩增要求,并取得与试剂盒提取法相似的效果。尿素提取法还具有操作简便、成本低廉等优点,在植物检验检疫中具有潜在的应用价值。
关键词:油菜茎基溃疡病菌;PCR;基因组DNA;提取方法
Comparison of Extraction Methods for Leptosphaeria maculans Genomic DNA
Abstract: PCR amplification of genomic DNA is a general detecting method of
Leptosphaeria maculans, and kit method of DNA extraction is mainly applied by the
Inspection and Quarantine system. On the purpose of screening a method to replace
the expensive kit method, the extraction processes, DNA purity and influences on
PCR amplification of four extraction methods(Urea, SDS-CTAB, CTAB and kit)were
analyzed. The results showed that the Urea method could meet the requirements of
DNA PCR, and obtained a similar effect to the kit method. With advantages of simple

DNA提取方法:
(1)组织标本,在低温状态下匀浆/冰冻组织用冰冻切片机切成大约8μm厚的切片数片,放入含500μl DNA裂解液(PBS)的Eppendorf
管中,超声震荡混匀2~3次,3分钟/次。
(1)8000rpm离心5~8分钟;小心吸弃上清,留约100µl。
(2)加入TE(PH8.0)180µl,10%SDS 20µl,蛋白酶K 3µl,37℃消化过夜。
(3)用300µl酚抽提两次,均10000rpm×10min离心;吸上层水相至另一管中,加入酚150µl,氯仿150µl,混匀,10000rpm×5min离心.
(4)吸上层水相至另一管中,加入1/10体积NaAC,2倍体积的无水乙醇,缓慢混匀,10000rpm×5min离心,弃上清,沉淀用75%乙醇200~300µl洗一遍,移去乙醇,加入TE(PH8.0)溶解。
基因组DNA提取以后,按按1:2000稀释,核酸蛋白测定仪测定其OD260,浓度计算公式:浓度=OD260值×稀释倍数×50/1000,-80℃冰箱保存。

1.2实验方法
1.2.1 茶花基因组DNA的提取
采用CTAB法[8]提取DNA,所有试剂(有机溶剂除外)和器皿都经高压灭菌,主要步骤如下:
(1)取两片幼嫩新鲜叶片,置于预冷的研钵中,倒入适量液氮,迅速研磨成粉末状,随后加入3ml预热的2%CTAB抽提缓冲液和50ul抗氧化剂2-巯基乙醇,继续研磨成略有流动性的糊状或粥状,转入1.5ml的离心管中,于65℃水浴锅中保温约60min.
(2)待混合物冷却至室温后加入等600ul的CI(氯仿:异戊醇=24:1)溶液混匀,轻轻颠倒离心管几次使管内混合物成乳浊液,常温下10000rpm离心10min,取上清液转入另一干净的离心管中。
(3)重复步骤(2)一次。
(4)取步骤(3)上清液加入2.5倍体积无水乙醇,仔细混匀,-20冰箱30min以上,沉淀DNA
4℃,12000rpm离心10min.
(5)弃去上层有机溶剂,加500ul75%乙醇洗涤沉淀,4℃下8000rpm离心5min,弃去上清,洗涤沉淀3次。
(6)倒置或者37度培养箱烘干.
(7)加50ulTE缓冲液溶解DNA,于-20℃冷藏备用。
1.2.2 DNA含量和质量的测定
(1)紫外分光光度法:取4ml提取的DNA,将之稀释200倍,测定提取的DNA在260nm和280nm处的吸光度值,得出OD260/280的值以及DNA和蛋白质浓度。如蛋白质浓度过高,需纯化。
(2)琼脂糖凝胶电泳:配制1.0%琼脂糖凝胶,在0.5×TBE缓冲液中,电压5V/cm电泳约60min,溴化乙锭染色20min,在凝胶成像系统上观察并拍照。
1.2.3 PCR扩增
(1)PCR反应在Biometro PCR仪上进行,反应体系为25ul:ddH2O 14ul,10×Buffer
2.5ul,MgCl(25mM) 2.5ul,dNTPs(2.5mM) 2.0ul,primer(2.0uM) 1.0ul,DNA 2.7ul(约40-60ng),Taq酶(5U/ul) 0.3ul.

种子DNA 提取方法
种子DNA的制备
和叶片相比,大多数种子更适用于碱裂解法,然而对于富含多糖和多酚的种子,仍需要使用CTAB来抽提。这些方法对小麦和大豆种子非常有效。
种子的碱性裂解
1. 在摇床上用2%漂白液清洗种子10分钟后,再用水清洗3次,每次5分钟。
2. 用灭菌的刀片将种子剖成两半,并放入2毫 升管中。
3. 根据种子大小(大豆种子400 μl,小麦种子100 μl)加入适量的裂解溶液(100
mM Tris- HCl, pH 9.5, 1 M KCl, 10 mM EDTA)。
4. 95 °C孵浴10分钟。
5. 吸取上清,并取适量用于扩增反应。
种子的CTAB抽提法
1. 在摇床上用2%漂白液清洗种子10分钟后,再用水清洗3次,每次5分钟。
2. 在液氮中用无菌研杵研磨种子。用500- 800μl的CTAB抽提缓冲液(2% CTAB, 100
mM Tris-HCl,1.4 M NaCl, 20 mM EDTA)转移至40ml锥底管中。轻轻混匀后55 °C孵浴20分钟。
3. 1500g 离心5分钟。
4. 转移上清至一个干净管中,加入等体积的氯仿:异戊醇(24:1),轻轻混合2分钟。
5. 15 000 g离心20秒。
6. 将上层液相转移至已预先加入1/10体积7.5M的乙酸铵和2倍体积的冰冷乙醇的管中。
7. 轻轻混匀后-20 °C放置1小时。
8. 15 000 g离心1分钟,弃上清。
9. 用70%的乙醇清洗沉淀两次,每次清洗混匀后15 000 g离心30秒。
10. 晾干沉淀后重悬于50 μl的1x TE缓冲液中 11. 吸取适量用于扩增反应。
试剂盒
FastDNA™-96 Plant/Seed DNA Kit
天根DP320 新型植物基因组DNA 提取试剂盒(可用于提取植物组织的DNA)

刘锦清,陈清霞,江贤章:一种快速提取裂殖壶菌基因组DNA的方法
一种快速提取裂殖壶菌基因组DNA的方法
刘锦清,陈清霞,江贤章
(1.福建师范大学工业微生物教育部工程研究中心,2.福建师范大学生命科学学院,
3.福建省现代发酵技术工程研究中心,福建福州350108)
摘 要:研究建立快速有效提取裂殖壶茵基因 ̄RDNA的方法。以裂殖壶茵Schizochytrium sp.F1U一512为试验材
料,比较了十六烷基三乙基溴化铵(cetyltriethylammnonium bromide,CTAB)法、十二烷基硫酸钠(Sodium
dodecyl sulfate,SDS)法、SDS快速法和裂解法4种DNA提取方法在裂殖壶菌中的提取效果。4种方法均能从裂殖 壶菌中提取到长度大约为23Kb的DNAJ ̄段,不同的提取方法获得的DNA产量存在明显差异。运用真菌18S
rDNA通用引物和p一酮脂一酰基ACP合酶(beta-ketoacyl[ACP】synthase,Ks)引物分 ̄qPCR扩增均能得到目的片
段。结论:CTAB法提取DNA的效率更高、操作步骤快速简单,适用于一次微量提取多个样品的基因组DNA。
关键词:裂殖壶菌; 基因组DNA;B一酮脂一酰基ACP合酶
doi:10.3969 ̄.issn.1007—550X.2011.03.002
中图分类号:Q781 文献标识码:A 文章编号:1007—550X(2011)03—0032—05
二十二碳六烯酸(Docosahexaenoic Acid,简称
DHA)是目前发现的碳链最长、不饱和度最高的60—3长
链高度不饱和脂肪酸(Long—chain polyunsaturated
fatty acids,Lc—PUFAs),具有抗心血管疾病、抗血
脂、降血压、预防各种癌症等重要生理功能 。然而
人体自身难以合成DHA,必须从体外摄入。DHA的传统
资源是深海鱼油,然而鱼油因DHA含量低、具有难闻的

革兰氏阳性菌总DNA提取方法
1.菌株用20mL LB培养基30℃振荡培养至对数生长期(36h)。
2.取4*1mL菌液,10000r/min 离心4min,去上清液,用预冷的TE溶液4*1mL洗涤一次,0.5mLTE重新悬浮菌体。
3.在菌悬液中加入0.2mg的溶菌酶, 轻轻颠倒10次,置于37℃恒温放置30min ,而后加入10uL的Rnase,0.06mL10% SDS,轻轻颠倒10次,置于室温恒温放置10min。
4.等体积Tris-饱和酚抽提,轻轻颠倒2分钟,10000r/min离心3min,取上清,置于以新EP管内。
5.等体积酚/氯仿/异戊醇抽提3次(至水相与有机相中间无蛋白糖类层,即中间澄清)。取离心后的上层水相,置于一新Ep管中。
6.加入0.1倍体积(15uL)NaAc(溶液Ⅲ),两倍体积(300uL)的预冷无水乙醇,-20℃下沉淀10min,10000r/min离心3min收集絮状沉淀。
7.70%的乙醇洗涤离心(10000r/min,3min)两次,弃上清。
8.37℃挥发去除残留乙醇,50µL TE溶液溶解,4℃保存备用。
黑曲霉总DNA提取方法 (对你来说没有用)
将从培养皿上刮取的菌体或抽滤收获的菌体放入研钵中,加液氮后研磨成粉末。向该粉末中以一定比例(2 mL/0.1 g粉末)加入一定量的DNA抽提液[0.2mol·L-1Tris-HCl(pH值7.5),NaCl 0.5 mol·L-1,EDTA 0.01
mol·L-1,SDS 1%]和与抽提液等体积的酚-氯仿-异戊醇混合液(体积比为25∶24∶1),于涡旋器上剧烈涡旋3~6 min,然后8000 r·min-1、
4℃离心5 min。将上清液转移到一新离心管,向该离心管中加入2.5 BV的无水乙醇,-20℃放置30 min。取出离心管,10 000 r·min-1、4℃离心10 min,弃上清液,在空气中放置10 min使乙醇挥发完全。加入适量的TE溶液[10 mmol·L-1Tris-HCl(pH值7.4),1 mmol·L-1EDTA(pH值8.0)]溶解沉淀即得到基因组DNA。
・ 132 ・ 植物保护第32卷第6期(2006)PLANT PROTECTION Vo1.32 No.6(2006)
能够清晰和有效地检测出玉米组织中大孢指疫霉的 菌丝和卵孢子。在目前尚缺乏更为精密准确的基于
病原菌蛋白质学的免疫检测技术和基于DNA信息
的分子检测技术的情况下,大孢指疫霉的特异染色
检测方法的应用将对于监测病害的传播提供一种实
用的技术手段。
参考文献
[1]ULLSTRUP A J.Crazy top of maize[J].Indian Phytopathol— ogy,1970,13:250 261. E2]JONS V L Crazy top of corn in North Dakota[J].Plant Dis— ease,1980,64:103—104. [3]ULLSTRUP A J.Observation On crazy top of COm[J].Phy— topathology,1952,42:675—680. [4]SHURTLEFF M e Compendium of corn diseases[M].Min— nesota;American Phytopathology Soeiety Press,1999. Es]王晓鸣,戴法超,朱振东.中国玉米疯顶病发生现状与病害控 制策略[C]∥中国植物保护学会.面向21世纪的植物保护发展 战略.北京:中国科学技术出版社,2001:239—243. [6]肖明纲,王晓鸣.玉米疯顶病在中国的发生现状与病害研究进 展[J].作物杂志,2004(5):41~44. [7]罗占忠,高玉风,顾海燕,等.玉米疯顶病传播途径的试验及调 查[J].植物保护,1997,23(5):33—34. [8]谢益书,邱燕,罗占忠,等.宁夏玉米霜霉病发生规律的研究 [J].宁夏农学院学报,1996,17(2):1—6. [9]MCGEE D C Maize Disease[M].Minnesota:American Phy— topathology Society Press,1988. [1O]UI23TRUPA J,SUNMH The prevalence of crazytop of com in 1968[J].P1gilt Disease Reporter,1969,53(4):246—250. [11]王圆,吴品珊,徐文忠,等.指疫霉属及所引致的玉米霜霉病 口].植物检疫,1995,9(5):285—288. [12]罗占忠,刘江山,高玉风,等.玉米疯顶病症状类型及病原菌形 态观察[J].植保技术与推广,2000,20(2):9—10. [13]BARTNIcKI-GARcIA SI Cell wall chemistry,morphogene— sis,and taxonomy of fungi[J].Annual Review of Mierobiolo— gY,1968,22:87—108, [14]DEY S K,DHILLON B S,MALHOTRA V V.Crazy top downy mildew of maize—a new record in Punjab『J].Current Science,1986,55(12):577—578. [15]PAY AK M M,RENFRO B L,SANGAM LAI_.Downy rail— dew diseases incited by Scletophthora[J].Indian Phytopathol— ogy,1970,13:183—193. [16]DERNOEDEN P H,JACKSON N.Infection and mycelia eolo— nization of gramineous hosts by Sclerophthora 71kqcrospor ̄ [J].Phytopathology,1980,70(10):1009—1013. [17]方中达.植病研究方法(第3版)[M].北京:中国农业出版 社,1998. [18]NAVI S S,SINGH S n Detection of Sclerospora graminicola mycelium in infected pearl millet leaves口].International Sot ghum and Millets Newsletter,1999,40:58.
3.1.4.1提取基因组DNA所需溶液配制
1. 1mol/L Tris-Cl(pH8.0)储备液:称取121.18g Tris碱溶于800mL去离子水中,用浓盐酸调pH值至8. 0(约4.2ml),定容至1000mL,高压灭菌后室温保存。
2. 0.5mo1/L EDTA:称取EDTA 186.1g,溶于800mL去离子水中,用NaOH调节pH至8. 0,定容至1000mL,高压灭菌后室温避光保存。
3. 10﹪SDS:取50g SDS溶于400mL超纯水中,加热至70℃左右,搅拌待完全溶解后,定容至500mL,调节pH至7.2。高压灭菌后室温保存。
4. 1×SET:取8.766g的氯化钠溶于800ml的去离子水中后加入1mol/L的Tris-Cl(pH8.0)50ml,0.5mo1/L EDTA2ml,最后加去离子水定容至1000ml,室温保存。
5. TE:取1mol/L的Tris-Cl(pH8.0)5ml,0.5mo1/L EDTA1ml,加去离子水定容到500ml,高压灭菌后室温保存。
6. 1%的蛋白酶K:取100mg蛋白酶K溶于10mL超纯水,-20℃分装保存。
7. 75%乙醇:在750mL无水乙醇中加入250mL超纯水,定容至1000mL。
8. 苯酚/氯仿/异戊醇(25: 24: 1):在1000ml的烧杯中加入500mL苯酚,480mL氯仿和20mL异戊醇,混合均匀,待用。
9. 氯仿/异戊醇(24: 1):在500ml的烧杯中加入480mL氯仿和20mL异戊醇,混合均匀,待用。
10. 3M醋酸钠(pH5.2):取408.1g的三水乙酸钠溶解于800ml去离子水中,用冰醋酸调节pH至5.2,定容到1000ml。分装后高压灭菌后室温保存。
提取DNA:
1. 将毛囊置于1.5ml EP管中,加入200ul 细胞裂解液,再加入20μL蛋白酶K,充分混匀5min;
1 一些DNA提取方法
1、溶菌酶法:收集对数生长期的菌液5ml, 置于10 000 rpm离心5min; 弃上清, 用500μl TE重悬于115ml离心管中, 加10μl 10mg/ml溶菌酶, 37℃保温20min, 再加215ul 20mg/ml蛋白酶K混匀, 37℃保温1h; 再加等体积的酚、氯仿、异戊醇(25∶24∶1) , 置于10 000 rpm离心5min; 取上清液加2倍体积的无水乙醇和1 /10体积的NaAc (pH = 416) , 于- 20℃下静置10min后于12 000 rpm离心10min; 所得的DNA 沉淀用70%的乙醇洗2
次, 自然风干后溶于40μl 的TE (含20ug/mlRNase) , 55℃处理15min, 于- 20℃保存备用。
2、 改良的CTAB法:收集对数生长期的菌液5ml, 置于10000 rpm离心5min; 弃上清, 用500μl TE重悬于115ml离心管中, 加100μl 10% SDS溶液, 215μl 20mg/ml蛋白酶K, 37℃保温1h,再加75μlNaCl和75μl 2 ×CTAB混匀, 65℃保温30min, 再加等体积的酚、氯仿、异戊醇( 25∶24∶1) , 置于10000 rpm离心5min; 以下步骤同溶菌酶法。
3、超声破碎提取法:收集对数生长期的菌液5ml, 置于10 000 rpm离心5min; 弃上清, 用3ml裂解缓冲液(110mol/L NaCl, 50mmol/L EDTA, 50mmol/L Tris·Cl) , 加30μl 10mg/ml溶菌酶冰水浴30min后超声处理, 超声条件: 250W每次工作5 s, 间隙5 s, 重复20次, 再加等体积的酚、氯仿、异戊醇(25∶24∶1) , 置于10 000 rpm离心5min; 以下步骤同溶菌酶法。
4、(1)破壁、蛋白质和核酸分离:向装有0.05~0.2g 样品的5 mL EP 管中加500~2000 μL 裂解液,充分混匀,立即放入沸水浴中并开始计时5~20 min(细胞壁薄且壁外没有荚膜或多糖的微生物,沸水浴时间一般5~10 min;对于那些细胞壁厚或有特殊胞外结构的微生物及杂质含量高的样品,沸水浴时间一般15~20 min),每隔2~3 min 颠倒EP 管3 次;随后立即转入60 ℃水浴中水浴1 h 或更长,每隔15 min 颠倒EP 管3 次;接着转入72 ℃水浴中水浴1 h 或更长,每隔15 min 颠倒EP 管3 次。
江苏农业科学2011年第39卷第2期 张 茹,吕淑霞,祝儒刚,等.单增李斯特菌基因组DNA提取方法比较[J].江苏农业科学,2011,39(2):67—69 单增李斯特菌基因组DNA提取方法比较 张 结,吕淑霞,祝儒刚,徐斌,金雪花 (沈阳农业大学生物科学技术学院,辽宁沈阳110866) 摘要:为了选择一种简单、快速、有效的单增李斯特菌基因组DNA的提取方法,采用溶菌酶一蛋白酶K法、氯仿/ 异戊醇法、液氮冻融法提取单增李斯特菌基因组DNA,利用PCR扩增结果判断所得DNA样品的质量。结果为,3种不 同方法均能扩增出234 bp条带,溶菌酶一蛋白酶K法提取的DNA模板检出限最低,为1.25×10 CFU/mL。结论为, 溶菌酶一蛋白酶K法提取的DNA模板进行PCR扩增检出限最低,该方法提取的基因组DNA适用于PCR扩增和其他 分子生物学研究。 关键词:单增李斯特菌;DNA提取;聚合酶链反应(PCR) 中图分类号:Q78 文献标志码:A 文章编号:1002—1302(2011)02—0067—02 单增李斯特菌(Listeria monocytogenes)是一种短小的革兰 氏阳性无芽孢杆菌,属人畜共患病的致病细菌,临床上主要导 致脑膜炎、败血症和孕妇流产等。由于其高致病性,在国内外 食品安全检测中日益受到重视 。随着分子生物学的发展, 应用PCR方法对单增李斯特菌进行检测可以缩短检测时间, 提高检测效率。提取高质量的基因组DNA是进行食品安全 性检测的前提,目前,从菌体中提取单增李斯特菌基因组 DNA的方法众多,但由于提取机理和步骤的差别,获得DNA 的量及纯度各不相同,导致在后续试验中PCR扩增、DNA测 序等应用效果的不同。 本研究采用了3种不同的DNA提取方法,针对单增李斯 特菌的致病性基因片段设计1对引物,对不同的方法提取出 的DNA进行PCR扩增,比较灵敏度,选择出一种简单,快速 且灵敏度高的方法,为进一步进行单增李斯特菌的PCR分子 检测研究提供指导。 1材料与方法 1.1材料 1.1.1 菌种单增李斯特菌标准菌株为ATCC19111,其他 菌株均为笔者所在实验室保存。 1.1.2试剂Taq DNA聚合酶、dNTPs、10 X PCR Buffer(含 1.5 mmol/L Mg“)、Loading Buffer、l 000 bp Marker,TaKaRa 公司;PCR引物选择种特异性hly基因为目的基因,根据文献 设计,由TaKaRa公司合成,引物序列为F:5 一CGGAGGTFC— CGCAAAAGATG一3 ,R:5 一CCTCCAGAGTGATCGATGTF一 3 ,引物长度为2O bp,退火温度58℃,扩增片段长度为 234 bp。其他试剂均为国产分析纯 。 1.1.3仪器PCR仪,TECHNE公司;凝胶成像系统,伯乐 收稿日期:2010—12—11 基金项目:教育部留学回国人员基金(编号:2006—331);沈阳市科技 局基金(编号:090009)。 作者简介:张嚣(1984一),男,硕士研究生,主要研究方向为食品安 全性检测。E—mail:ca—zhangzhe@yahoo.com.cn。 通信作者:吕淑霞,女,博士,教授,博导,研究方向为微生物生物化学 与分子生物学。E—mail:lushuxia@hotmail.COB。 公司。 1.1.4培养基胰酪胨大豆酵母浸膏肉汤培养基(TSB— YE):胰蛋白胨15 g,大豆蛋白胨5 g,氯化钠5 g,酵母膏6 g, 蒸馏水1 000 mL,pH值7.4。 1.2 方法 1.2.1 菌株培养单增李斯特菌接种于胰酪胨大豆酵母浸 膏肉汤培养基中,37℃过夜增菌培养。 1.2.2基因组DNA提取方法 1.2.2.1 溶菌酶一蛋白酶K法 (1)取过夜培养的菌液 500 L加入1.5 mL离心管中,12 000 r/min离心10 min得菌 体,弃上清液;(2)95 L无菌蒸馏水重悬,加入4 溶菌酶 (50 mg/mL),用枪头混匀,37℃温浴15 min;(3)加入1 IxL 蛋白酶K(20 mg/mL),振荡数秒,置于58℃恒温水浴锅内孵 育50 min;(4)95℃加热8 min,使酶失活;(5)12 000 r/min 离心5 min,取上清液备用。 1.2.2.2氯仿/异戊醇法(1)取过夜培养的菌液500 txL 加入1.5 mL离心管中,12 000 r/min离心10 min得菌体,弃 上清液;(2)100 txL无菌蒸馏水重悬DNA,加入100 p,LTris一 酚,轻轻混匀后,12 000 r/min离心5 min,去上清液转移至新 离心管中;(3)加入100 L氯仿/异戊醇,颠倒混匀后, 12 000 r/min离心5 min,转移上清液至新离心管中;(4)加入 预冷的2倍体积的无水乙醇,混匀后, 12 000 r/min离心10 min,弃上清液;(5)加入40 无菌蒸 馏水,一20℃保存备用。 1.2.2.3液氮冻融法(1)取过夜培养的菌液500 加入 1.5 mL离心管中,12 000 r/min离心10 min得菌体,弃上清 液;(2)加入95 L无菌蒸馏水混匀,放入100℃沸水中静置 1 min,立即转移至液氮中冷冻2 min,反复5次;(3) 12 000 r/min离心5 min,取上清液备用。 1.2.3 PCR检测 以提取的基因组DNA为模板,用单增李 斯特菌hty基因的特异引物进行PCR扩增。反应体系为 30 :模板DNA l L;DNATaq聚合酶(5 U/o ̄L)0.3 ixL; 10×PCR Buffer 5 IxL;dNTP(2.5 mmoL/L)l IxL;上、下游引物 (10 pmo ̄L)各1 txL;灭菌去离子水20.7 L。循环参数为: 95℃预变性2 min,94 oC变性50 S,58℃退火30 S,72 oC延伸 30 S,30个循环,最终72℃延伸5 mi
.
-
-
-可修编- 一 、移液器使用
移液器〔也称作“枪〞〕是所有分子实验操作不可或缺的工具,其正确使用是顺利开展各项实验的先决条件。为保证实验结果的准确性和稳定性,同时延长移液器的使用寿命,请大家细心操作并遵守以下使用规那么和考前须知:
1. 从未使用移液器或刚进入实验室的研究生,只有完全准确掌握移液器使用规那么前方可独立使用移液器。
2. 按需要选用适宜量程的移液器,调整刻度时,注意看移液器刻度表,不要超过最大刻度。
3. 装配吸头时,用力不要过猛,以免吸头难以脱卸,同时损坏移液器。
4. 吸取液体时,注意要慢慢向上释放控制按钮以免吸入速度过快导致液体进入移液器内。
5. 切忌平放带有残液的吸头的移液器,更不能倒放。
6. 使用移液器清洗或溶解固体物质等需反复吸打时,请装配多个叠加的吸头,且调整刻度不超过移液器最大量程的一半。
7. 移液器使用完毕,务必调到最大刻度,并稳妥地放回对应的移液器架上。
8. 细心操作,如不小心使移液器外表沾到液体,请及时清洗干净;如不小心将液体吸入移液器内,应及时清洗。
9. 严禁用沾有放射性或腐蚀性物质的手套触摸移液器外表;严禁不熟悉移液器构造者私自校对移液器刻度。
第一节 叶片总DNA的提取
一、 取样须知
1. 取样之前一般要先编号〔牌子和离心管的编号〕和挂牌,务必保证离心管中的叶片是来自于同一编号单株,编号切勿混淆; .
菌dna提取方法
菌DNA提取方法主要有以下几种常用的方法:
1. 热裂解法:将菌株经过培养后,取一部分菌体加入到含有蛋白酶K和SDS等裂解液的管内,经过高温加热和高速离心等步骤,将细胞裂解,使DNA释放到溶液中。
2. 真菌细胞壁裂解法:对于真菌等含有较坚硬的细胞壁的菌株,可以先用混合酶或纤维素酶等酶解细胞壁,然后再用热裂解法或理化方法提取DNA。
3. CTAB方法:CTAB(盐基洗脱法)常用于提取高质量的食管菌和黄杆菌等高GC含量的菌株DNA。首先,将菌体经过裂解后,使用CTAB裂解液中的盐离子与DNA结合形成沉淀,然后通过洗脱步骤将DNA纯化。
4. 醋酸盐方法:醋酸盐方法适用于提取低GC含量的菌株DNA。将菌体经过裂解后,通过添加醋酸盐裂解液,使DNA与醋酸和盐结合成为可溶性复合物,后续通过酒精沉淀等步骤将DNA沉淀出来。
5. 商业化基因提取试剂盒:市面上还有许多商业化的基因提取试剂盒,这些试剂盒提供了一套完整的操作流程和试剂,能够方便快速地提取和纯化菌DNA。
不同的菌株和研究目的可能需要使用不同的提取方法,因此在选择提取方法时需要根据具体情况进行选择。