线粒体DNA的提取方法.
- 格式:ppt
- 大小:203.50 KB
- 文档页数:17

mt DNA的分离及纯化按戴建华等报道的方法,就具体情况稍加改进,步骤如下(除特别说明,均在4℃下完成):1.1 取新鲜肝组织,放在缓冲液A(0.25M 蔗糖,0.01M Tris·Hcl,0.001M Na2-EDTA,pH8.0)中漂洗2~3次,尽可能去除表面血污、结缔组织及脂肪组织后剪碎。
按组织重﹕缓冲液A=1﹕5~10加入缓冲液A,用玻璃匀浆器冰浴匀浆。
1.2 1000 g•min-1离心15min;取上清液;15000 g•min-1离心20min,弃上清,沉淀用缓冲液B (0.25M 蔗糖,0.05M Tris·Hcl,0.007M Mg Cl2,p H7.5)洗涤,按0.5m L•g-1肝的比例加入缓冲液B 悬浮沉淀后加入DNase I 至终浓度为100 µg•m L-1,30℃下作用30min。
1.3 冰浴冷却,加入2倍体积的DNase I反应终止液(0.25M蔗糖,0.1M Na2-EDTA,pH8.0)。
15000g•min-1离心20min。
沉淀用DNaseI反应终止液洗涤一次,重复离心。
1.4 按0.5 m L•g-1肝加入缓冲液C(0.1M Nacl,0.05M Tris·Hcl,0.01M Na2-EDTA,p H8.5)悬浮沉淀,加入SDS至终浓度为1%~1.5%,吸打混匀后37℃保温15min。
1.5 用等体积的苯酚,苯酚/氯仿(1:1),氯仿/异戊醇(24:1)各抽提一次。
取水相,加0.2 倍体积1M Na Ac和2倍体积的预冷无水乙醇,混匀后放在4℃冰箱中过夜。
1.6 15000g•min-1离心30min后去上清;沉淀用70%乙醇洗涤2次,干燥,TE(0.01M Tris·Hcl,0.001M Na2-EDTA,pH8.0)溶解。
1.7 加入预处理的RNase I 至终浓度为50µg•m L-1,37℃保温1h。

线粒体DNA提取SOP
一、蛋白酶K法
1、使用液氮将50mg新鲜组织样本研磨至粉末状;
2、转入1.5mL离心管中加入溶液A(4℃)1mL,冰浴中吹打分散后沉降大块沉淀;
3、4℃,1000r/min离心1min,分离颗粒细胞核和细胞碎片;
4、回收上清至新的1.5mL离心管,12000r/min离心10min;
5、弃上清,尽量去除干净;
6、加50uL蛋白酶K,55℃水浴2.5h,期间每隔15min轻轻混匀;
7、加水至500uL;
8、加入等体积的酚、氯仿、异丙醇抽提,轻柔上下翻转离心管15min;
9、1000r/min离心10min;
10、水相转移至新管并加入各500uL的氯仿和异丙醇,轻柔上下翻转离心管15min;
11、1000r/min离心10min;
12、水相转移至新管,加入2倍体积的冰乙醇沉淀,静置10min;
13、12000r/min离心2min,沉淀即为mtDNA;
14、70%乙醇清洗线粒体DNA,置于空气中自然干燥后加入适量TE液溶解,于4℃保存。


一种优化的大白菜线粒体DNA提取方法李振兴;张德双;司龙亭;于拴;张凤兰;余阳俊;赵岫云;汪维红【摘要】介绍了一种快速、大量提取大白菜线粒体DNA的方法.以大白菜黄化苗为试验材料,通过加入一定量的DNase I和RNase A酶,充分消除核基因组DNA 和RNA的污染.通过加入蛋白酶K和SDS,并经2步变温处理,即先在50℃条件下温育1 h,接着在37℃条件下温育1 h,有效地提高了mtDNA产出率.经凝胶电泳和PCR等检测,结果表明:mtDNA电泳条带清晰,OD260与OD280比值为1.8左右,纯度较高;利用细胞核看家基因Actin设计引物,扩增mtDNA,没有获得扩增产物,表明mtDNA中没有核基因组污染;利用大白菜CMS96胞质不育系基因orf222设计引物,扩增不育系和保持系mtDNA,仅在不育系中扩增出670 bp的片段;利用5个随机引物进行RAPD分析,在保持系和不育系中可扩增出许多产物,且呈现出丰富的多态性,充分表明提取的mtDNA可以满足后续的分子生物学试验.该方法的创新之处在于,通过2步变温处理的方法充分裂解线粒体膜,释放大量mtDNA,有效地提高了mtDNA的产量.试验年获得的最高产出率为每克大白菜黄化苗获得18.83 μg mtDNA.%A fast and high productivity method for mitochondrialDNA(mtDNA)isolation in Chinese cabbage was introduced. Yellow seedlings were used in order to remove chloroplast DNA (cpDNA). DNase Ⅰ and RNase A enzyme were added to digest nuclear DNA( nDNA) and RNA in order to purify mitochondrion. Protein K and SDS were added to disrupt mitochondrial membranes and 2 steps of poecilothermal treatments with 50℃ for 1 h and37℃ for 1 h were applied to release more mtDNA. Results showed electrophoretic band of mtDNA was clear and the purity was high. The ratio of ODa60/OD280 was about 1.8. No productswere amplified for mtDNA template by using primers deigned by nuclear housekeeping Actin genes. It meant mtDNA was not contaminated by nDNA. 670 bp fragment could only be amplified in CMS lines by using primers deigned by orf222 gene special for Chinese cabbage CMS96. RAPD analysis with 5 primers showed many polymorphic bands were founded between CMS96 and maintainer lines. Therefore mtDNA isolated in this method is suitable for molecular manipulation. The innovation in this method is that 2 steps of poecilothermal treatments with 50℃ for 1 h and 37℃ for l h are used to disrupt mi tochondrial membranes and make higher productivity of mtDNA. The highest yield in our study is 18.83 μg mtDNA for 1 gram yellow seedlings.【期刊名称】《华北农学报》【年(卷),期】2011(026)002【总页数】5页(P138-142)【关键词】大白菜;线粒体DNA;提取方法;变温处理;细胞质雄性不育【作者】李振兴;张德双;司龙亭;于拴;张凤兰;余阳俊;赵岫云;汪维红【作者单位】沈阳农业大学园艺学院,辽宁沈阳110161;北京市农林科学院蔬菜研究中心,北京100097;北京市农林科学院蔬菜研究中心,北京100097;沈阳农业大学园艺学院,辽宁沈阳110161;北京市农林科学院蔬菜研究中心,北京100097;北京市农林科学院蔬菜研究中心,北京100097;北京市农林科学院蔬菜研究中心,北京100097;北京市农林科学院蔬菜研究中心,北京100097;北京市农林科学院蔬菜研究中心,北京100097【正文语种】中文【中图分类】S634.1细胞质雄性不育(Cytoplastic male sterility,CMS)现象广泛存在于高等植物中,不仅在植物杂种优势利用方面具有重要应用价值,而且在研究核质互作方面也具有重要的理论意义[1]。

鱼类线粒体DNA研究新进展一、本文概述线粒体DNA(mitochondrial DNA,mtDNA)作为生物体内的一种重要遗传物质,近年来在鱼类研究中逐渐展现出其独特的价值和潜力。
鱼类线粒体DNA研究新进展不仅深化了我们对鱼类遗传多样性的理解,还为鱼类遗传育种、系统发生、种群遗传结构分析等领域提供了有力的工具。
本文旨在综述近年来鱼类线粒体DNA研究的新进展,探讨其在鱼类生物学中的应用前景,以期为鱼类遗传资源保护和可持续利用提供理论支持和实践指导。
本文将首先回顾线粒体DNA的基本结构和特点,然后重点介绍鱼类线粒体DNA的提取方法、测序技术及其在鱼类遗传多样性、系统发生和种群遗传结构分析中的应用。
还将讨论鱼类线粒体DNA在遗传育种和遗传资源保护中的潜在应用价值,并展望未来的研究方向和挑战。
通过本文的综述,希望能够为从事鱼类线粒体DNA研究的学者提供有益的参考和启示,共同推动鱼类线粒体DNA研究的深入发展。
二、鱼类线粒体DNA的结构与功能鱼类线粒体DNA(mitochondrial DNA,mtDNA)是一种双链、闭合环状的分子,通常大小为16-20千碱基对(kb),是细胞器中唯一的DNA分子。
鱼类mtDNA的结构主要包括重链(H链)和轻链(L链),其中H链编码了大部分基因,而L链则编码了剩余的少数基因。
这些基因主要编码线粒体氧化磷酸化系统的13个蛋白质亚基,以及2个rRNA和22个tRNA,这些成分共同构成了线粒体的核糖核蛋白体,负责线粒体内蛋白质的合成。
鱼类线粒体DNA的功能主要体现在以下几个方面:mtDNA是鱼类线粒体遗传信息的载体,通过母系遗传的方式传递给后代,因此,在鱼类遗传学和进化生物学研究中,mtDNA被广泛应用为分子标记。
mtDNA编码的蛋白质是线粒体氧化磷酸化系统的重要组成部分,这些蛋白质参与线粒体的能量代谢过程,对鱼类的生命活动起着至关重要的作用。
mtDNA的突变和变异也被广泛用于鱼类种群遗传结构、遗传多样性和系统发育等研究。

适用于线粒体基因组测序的高纯度线粒体DNA提取和鉴定方法优化作者:李君朱嘉晋邓雨萍吴文鹤来源:《中国现代医生》2022年第04期[摘要] 目的优化线粒体DNA(mtDNA)提取和纯度鉴定方法以满足线粒体基因组测序的要求。
方法利用简化的蔗糖密度梯度离心法、DNA酶Ⅰ并结合质粒提取试剂盒提取纯化mtDNA、尽量降低核DNA(nDNA)污染的可能。
获得的mtDNA经NanoDrop检测、琼脂糖凝胶电泳和荧光定量PCR绝对定量法测定nDNA/mtDNA拷贝数比值等鉴定其纯度。
结果从小鼠肝脏和大脑组织中提取纯化得到mtDNA产率分别为311.7 μg/g和59.1 μg/g,其A260/280均介于1.8~2.0,A260/230浓度均大于2.0,荧光定量PCR绝对定量法测定nDNA/mtDNA拷贝数比值均低于0.005%。
结论本研究优化了mtDNA提取和鉴定方法,得到的高纯度mtDNA 适用于后续线粒体基因组测序等分子生物学研究。
[关键词] 线粒体DNA;提取;纯化;核DNA[中图分类号] R394.3 [文献标识码] A [文章编号] 1673-9701(2022)04-0040-04[Abstract] Objective To optimize mitochondrial DNA (mtDNA) extraction and purity identification methods to meet the requirements of mitochondrial genome sequencing. Methods Simplified sucrose density gradient centrifugation, DNase I, and plasmid extraction kit were used to extract and purify mtDNA and minimize the possibility of nuclear DNA (nDNA) contamination. The purity of the obtained mtDNA was determined by NanoDrop detection, agarose gel electrophoresis, and determination of nDNA/mtDNA copy number ratio by fluorescence quantitative PCR absolute quantitative method. Results The yields of mtDNA extracted and purified from mouse liver and brain tissues were 311.7 μg/g and 59.1 μg/g, respectively. The A260/280 ranged from 1.8 to 2.0, and the A260/230 concentration was greater than that of 2.0. The ratio of nDNA/mtDNA copy number determined by fluorescence quantitative PCR absolute quantitative method was lower than 0.005%. Conclusion This study optimizes the mtDNA extraction and identification methods, and the high purity mtDNA obtained is suitable for subsequent mitochondrial genome sequencing and other molecular biology research.[Key words] Mitochondrial DNA; Extraction; Purification; Nuclear DNA随着测序技术的快速蓬勃发展,获取线粒体基因组序列变得更为容易[1],如何高效分离和纯化线粒体DNA(mitochondrial DNA,mtDNA)而避免核DNA(nuclear DNA,nDNA)的污染是线粒体基因组测序及后续序列分析的关键[2]。

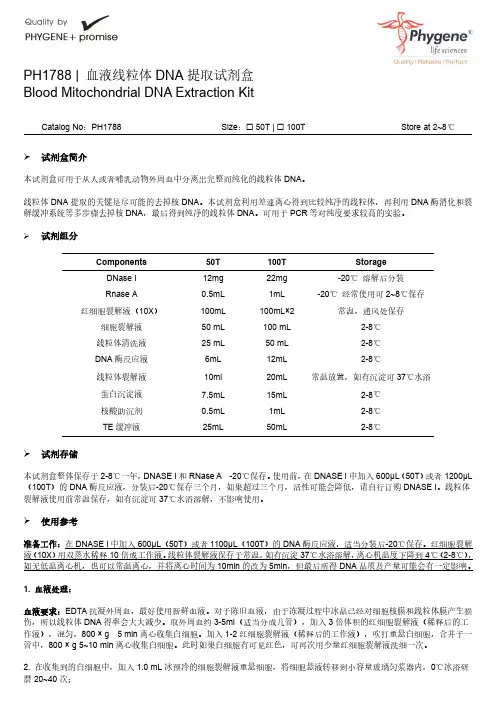
PH1788|血液线粒体DNA提取试剂盒Blood Mitochondrial DNA Extraction KitCatalog No:PH1788Size:☐50T|☐100T Store at2~8℃试剂盒简介本试剂盒可用于从人或者哺乳动物外周血中分离出完整而纯化的线粒体DNA。
线粒体DNA提取的关键是尽可能的去掉核DNA。
本试剂盒利用差速离心得到比较纯净的线粒体,再利用DNA酶消化和裂解缓冲系统等多步骤去掉核DNA,最后得到纯净的线粒体DNA。
可用于PCR等对纯度要求较高的实验。
试剂组分Components50T100T StorageDNase I12mg22mg-20℃溶解后分装Rnase A0.5mL1mL-20℃经常使用可2~8℃保存红细胞裂解液(10X)100mL100mL×2常温,通风处保存细胞裂解液50mL100mL2-8℃线粒体清洗液25mL50mL2-8℃DNA酶反应液6mL12mL2-8℃线粒体裂解液10ml20mL常温放置,如有沉淀可37℃水浴蛋白沉淀液7.5mL15mL2-8℃核酸助沉剂0.5mL1mL2-8℃TE缓冲液25mL50mL2-8℃试剂存储本试剂盒整体保存于2-8℃一年,DNASE I和RNase A-20℃保存。
使用前,在DNASE I中加入600μL(50T)或者1200μL (100T)的DNA酶反应液,分装后-20℃保存三个月,如果超过三个月,活性可能会降低,请自行订购DNASE I。
线粒体裂解液使用前常温保存,如有沉淀可37℃水浴溶解,不影响使用。
使用参考准备工作:在DNASE I中加入600μL(50T)或者1100μL(100T)的DNA酶反应液,适当分装后-20℃保存。
红细胞裂解液(10X)用双蒸水稀释10倍成工作液。
线粒体裂解液保存于常温,如有沉淀37℃水浴溶解,离心机温度下降到4℃(2-8℃),如无低温离心机,也可以常温离心,并将离心时间为10min的改为5min,但最后所得DNA品质及产量可能会有一定影响。

线粒体dna研究方法与实验方案线粒体DNA(mtDNA)是线粒体内的遗传物质,对于研究遗传学、进化生物学和疾病诊断等具有重要意义。
以下是一种常见的线粒体DNA研究方法和实验方案的概述:
1.提取线粒体DNA:
•根据研究样本的来源(如细胞培养物、组织样本或血液样本等),选择合适的DNA提取方法,常用的包括CTAB法、商业提取试剂盒法等。
•提取的DNA应当经过质量和纯度检测,确保可用于后续实验。
2.PCR扩增:
•设计合适的PCR引物,通常选择线粒体基因组中的特定区域进行扩增,如D-loop区域、编码基因区域等。
•进行PCR扩增反应,并对扩增产物进行纯化和检测,确保扩增效率和产物纯度。
3.测序分析:
•对PCR扩增产物进行测序,可采用Sanger测序或高通量测序技术。
•将测序数据与参考线粒体基因组序列进行比对,分析碱基序列的差异、突变和变异等。
4.定量PCR分析:
•通过定量PCR技术,对线粒体DNA中特定基因的拷贝数进行定量分析,可以用于研究线粒体基因拷贝数的变化和相关疾病的研究。
5.线粒体单倍型分析:
•基于PCR扩增和测序数据,进行线粒体单倍型(mtDNA haplotype)分析,可以研究人类群体的遗传多样性、迁移历史和进
化关系。
6.功能性实验:
•根据研究目的,进行线粒体DNA相关的功能性实验,如线粒体DNA复制、表达和修复等的研究。
在进行实验设计和操作过程中,需要注意实验条件的严格控制,避免污染和外源性DNA的干扰。
此外,合理分析和解读实验结果,结合相关文献和生物信息学分析,可以得到更深入的线粒体DNA研究结论。

文章编号:049026756(2002)0z 20018203提取水稻线粒体DNA 的一种简易方法裴得胜1,2,蔡平钟1,李名扬2,阎文昭1,裴炎2向跃武1,张志雄1,吴洁1(1.四川省农业科学院生物技术核技术研究所,成都610066;(2.西南农业大学生物技术中心,重庆400716)摘要:介绍了一种利用常用的普通试剂提取水稻线粒体DNA 的简便方法.与其它方法相比较,它具有省时、省钱、高效、快捷、简单等特点.用该方法提取的水稻线粒体DNA ,经紫外分光光度计测定其纯度、限制性内切酶进行酶切和随机引物进行RAPD 反应的结果表明,完全可以满足作为RFL P 和RAPD 等分析质量的要求.关键词:水稻线粒体DNA ;提取纯化;酶切;RAPD中图分类号:Q244 文献标识码:A杂交水稻是粮食增产的主要方法之一,而水稻雄性不育是杂交水稻发展的基础.因而雄性不育是当今国内外研究的焦点.研究表明水稻的雄性不育与线粒体紧密相关[1],故此提取纯化水稻线粒体DNA 成为研究水稻线粒体DNA 与细胞质雄性不育的一个必要步骤.目前提取水稻线粒体DNA 的一般方法如:国外的Douce 方法[2]、Pri ng 方法[3]、Levi ngs 方法[4]以及国内所用的蔗糖的不连续梯度方法[5,6].国外提取纯化水稻线粒体DNA 的方法存在试剂价格昂贵、购买困难等不便;国内所用的蔗糖不连续梯度方法步骤繁琐,特别在吸取中间层黄色液时比较困难,费时又耗材.我们现介绍一种使用普通试剂的简易方法,此法操作步骤较少,并且所得的线粒体DNA 较纯,能被限制性内切酶酶切.其DNA 的质量完全符合RFL P 和RAPD 等研究的要求.1 材料和方法1.1 试剂缓冲液A (50m mol/L Tris 2HCl ,pH 8.0,2.5m mol/L EDTA ,0.44mmol/L Sucrose ,0.15%BSA ,5mmol/L 22Mercaptoet hanol ),缓冲液B (50mmol/L Tris 2HCl ,p H 8.0,20m mol/L ED TA ,5mmol/L 22Mer 2captoethanol),缓冲液C (0.6mol/L Sucrose ,20mmol/L ED TA ,10mmol/L Tri s 2HCl),缓冲液D (50mmol/L Tris 2HCl ,10mmol/L EDTA ),裂解液(50mmol/L Tris 2HCl ,pH 8.0,20m mol/L EDTA ,1.5%SDS ),除22Mercaptoethanol 为SI G MA 公司产品外,其它试剂均为华美生物工程公司国产分析纯.1.2 实验方法1.2.1 分离纯化水稻Ⅱ232A ,B ,F 1(A 即不育系,B 即保持系,F 1即杂种一代,下同)线粒体 剪取水稻黄化苗50g ,用10%NaClO 消毒10min ,蒸馏水洗涤数次.吸干水分后剪碎并按每克10mL 的比例加入预冷的缓冲液A ,用组织捣碎机匀浆后用3层无菌纱布过滤,滤液在4℃下18000g 离心15min 后,收集沉淀;用10mL 预冷的缓冲液A 悬浮至无颗粒存在.在4℃下1000g 离心10min 去沉淀后,加入70mL 预冷的缓冲液B ,于4℃下18000g 离心15mi n 后弃上清液,重复用缓冲液B 洗涤沉淀一次.沉淀悬浮于8mL 预冷的缓冲液A 中并轻轻加于缓冲液C 上,在4℃下12000g 离心10mi n.必要时可用缓冲液C 洗一次.所得的沉淀为纯化的水稻线粒体收稿日期222002年4月第39卷增刊四川大学学报(自然科学版)Journal of Sichuan University (Natural Science Ed ition)Apr.2002Vol.39Issue.:200201291.2.2 提取纯化线粒体DNA 纯化的线粒体于2.4mL 缓冲液D 中充分悬浮.加入预处理的(37℃下保温10min )Prot ei nase K 至100×10-6g/mL ,轻摇2mi n 后,再加入1.2mL 裂解液,于37℃下反应1h.将所得的粘稠液倒入三角瓶中加入等体积的饱和酚且摇匀后于摇床上慢摇10min.再将混合液转入1.5mL 离心管中,于4℃下5000g 离心15mi n.转移上层液于1.5mL 离心管内并加入等体积的酚2氯仿2异戊醇(24∶23∶1)轻轻混匀后,于4℃下5000g 离心10min ,重复至中间层无蛋白质出现.取上层液并加入0.1倍体积的3mol/L NaAc 和2倍体积75%的乙醇,于-20℃放置3h ,再在4℃10000g 离心15min 后收集沉淀,用70%的乙醇洗涤两次,真空干燥5min ,最后溶于50μL TE 中在-20℃下保存备用.1.3 线粒体DNA 的定量和定性分析1.按常规方法用紫外分光光度计测定线粒体DNA 在OD 260nm 和OD 280nm 及OD 230nm 的值,计算出线粒体DNA 溶液的浓度和比较其纯度.2.取2μL 所得的DNA 溶液,用1%琼脂糖电泳以观察DNA 的带型及分子量大小.3.取1μL 线粒体DNA 溶液,加入4U 限制性内切酶于37℃下酶切4h ,用1%琼脂糖电泳以观察酶切效果.4.用OPERON 公司的OPA 17,OPD 03和OPE 193个随机引物作RAPD 反应.2 结果与分析1.紫外分光光度计测定结果:OD 260nm /OD 280nm =1.88,OD 260nm /OD 230=2.6,说明所提取的DNA 比较纯.通过OD 260nm 值计算所得的DNA 浓度达1.5×10-6g/μL.每50g 水稻黄化苗约可得线粒体DNA 58μg ,产率较高.2.所提取的DNA 电泳结果带型清晰,无拖尾且未发生降解现象(见图1).3.所提取的DNA 经限制性内切酶(EcoR I ,SABC )于37℃下酶解4h ,电泳结果重复性好、谱带清晰、酶切彻底(见图2).4.RAPD 最少为1条带,最多达12条带,分子量约在500~5000bp 之间.带型清晰,效果较好(见图3).图1 图2 图3 图1~3中的M 和M2为m arker ;A ,B 和F 1分别为水稻Ⅱ232不育系、保持系和杂种一代的mtDNA.1,2,3用引物OPA 17;4,5,6用引物OPD 03;7,8,9用OPE 19分别扩增Ⅱ232不育系、保持系和杂种一代mtDNA 所对应的扩增带3 讨论 在提取水稻线粒体过程中,如果存在酚类物质而影响最终的DN 产率时,可于缓冲液中适当加入%的V 线粒体裂解前的沉淀,要充分悬浮再缓慢加入裂解液,以提高线粒体DN 的产量线粒体裂91增刊 裴得胜等:提取水稻线粒体DNA 的一种简易方法A 1.0P P.A .02四川大学学报(自然科学版) 第39卷解前加入预热的Proteinase K可帮助更好的裂解.如果通过加入DNase I来除去核基因的污染,将导致产率降低[7].上述方法的特点之一是可不使用国外方法所用的昂贵试剂.其次可简化实验步骤,避免了国内所用蔗糖梯度方法的繁琐.再者不加DNase I,而是通过多次洗涤方法去除核DNA污染,结果证明所提取的DNA 纯度较好.在提取纯化过程中RNA一般会自动降解[8],可针对提取效果考虑是否加入RNase..参考文献:[1] 朱英国.水稻雄性不育生物学[M].武汉:武汉大学出版社,2000.256-279.[2] Douce R,et al.BBA,1972,275:148-160.[3] Pring D R,et a l.G enetics,1978,89:121-136.[4] Levings C S,et al.Scie nce,1976,193:158-160.[5] 陈毓荃.生物化学研究技术[M].北京:中国农业出版社,1995.232-235.[6] 王关林.植物基因工程原理与技术[M].北京:科学出版社,1998.605-608.[7] 赵衍,等.杭州大学学报(自然科学版),1991,18(3):321-325.[8] 谢纬武,等.中国科学,1996,26(2):172-176.A Simple Method f or Isolation of Rice Mitochon dr ial DNAPEI De2s heng1,2,CA I Pin g2z hon g1,L I Mi ng2ya n g2,YA N Wen2zhao1PEI Yan2,XIA N G Yue2w u1,Z HAN G Zhi2xi on g1,W U J ie1(1.Biotechn ology and Nuclear Techn ol ogy Research Institute,Sichuan Academy of Agricultural Sciences,Chengdu610066,China;2.Center of Biotechnology,S outhwest Agricult ural University,Ch ongqing400716,China)Abstract:A si mple met hod for i solation of rice mi tochondrial DNA is descri bed by using t he com mon reagents. Comparing wit h ot her met hods,i t not only c ost s less time and money,but also has higher efficiency.It i s re2 garded as a simple,convenient and rapi d met hod.Tested by UV2spect rophotometer,t he rice mitochondrial DNA is very pure by t his met hod.Moreover,it i s well digest ed by t he rest riction endonuclease.The result shows t hat it s qualit y can be used for RFLP or RA PD.K ey w or ds:i solation and purification;rice mitochondrial DNA;endonuclease digestion;RAPD。
动物线粒体D NA 提取的原理和方法*X夏玉玲 刘彦群 鲁 成X X (西南农业大学蚕学与生物技术学院农业部蚕桑学重点实验室 重庆 400716)摘 要 从动物线粒体的特征、线粒体的鉴定方法、提取线粒体D NA 各步骤等原理出发,比较了目前常用的几种提取线粒体D N A 的方法,提出动物线粒体D N A 提取的几点关键步骤,并提出一套优化的操作流程。
关键词 线粒体 线粒体D N A 提取方法线粒体是存在于绝大多数真核细胞内的一种基本的重要的细胞器。
它是细胞进行氧化磷酸化的场所。
线粒体基因组不仅是研究D N A 结构与复制转录的良好模型,也是研究真核细胞核酸与蛋白质合成非常合适的模型系统。
线粒体基因组与核基因组的同源基因结构对比也被广泛应用于核基因和核外基因的进化研究中。
由于线粒体基因在真核生物具有高保守性,所以它已成为了研究物种进化的一种常用的标记,并为线粒体起源提供有价值的线索[1]。
动物线粒体D NA 具有分子量小、结构简单、母性遗传和进化速度快等特点,已广泛应用于动物群体遗传学和进化生物学等领域的研究[2]。
进行动物线粒体D NA 方面意义重大,现将线粒体D N A 的提取的原理和方法介绍如下:1 提取动物线粒体D N A 的原理1.1 线粒体的特征线粒体是由内外两层膜组成,外膜光滑,内膜向内回旋折叠,形成许多横隔。
线粒体中含有多种氧化酶,在此进行TCA 循环、呼吸连电子传递和氧化磷酸化等产能作用,并传递和储存所产生的能量,是细胞的动力工厂和生物氧化的主要场所。
线粒体的形状、大小、数目和组成,在不同生物、不同组织以及生活于不同条件下的细胞中变化很大。
线粒体的外型呈多样化,绝大多数类型细胞呈圆形、卵原形,也有呈杆状的。
其体积大小不等,一般直径比较一致,为0.5~1.0L m,长度为1~5L m,最长可达到7L m 。
线粒体的数目与生物种类、组织、细胞类型和细胞生理功能变化有关。
锥虫和有的真菌只有一个线粒体,大多数动物的肝脏细胞含有上千个线粒体,生殖细胞如卵母细胞可达到30万个线粒体,家蚕的每个后部丝腺细胞只有2~4个线粒体[13],而有的细胞根本没有线粒体;在细胞生命活动旺盛时,它的数量多,在衰老时,数量少,有时可能消失;新生细胞比衰老细胞或病变细胞的线粒体多。
《外周血线粒体DNA、生长分化因子-15联合脑钠肽检测对心力衰竭的诊断价值》篇一一、引言心力衰竭(Heart Failure,HF)是一种常见的心血管疾病,其发病率和死亡率均较高。
早期诊断和有效治疗对于改善患者预后具有重要意义。
目前,临床诊断心力衰竭主要依靠临床表现、体征、影像学检查及生物标志物检测等方法。
其中,生物标志物在心力衰竭的诊断、病情评估及预后判断中发挥着重要作用。
本文旨在探讨外周血线粒体DNA(mtDNA)、生长分化因子-15(GDF-15)及脑钠肽(BNP)联合检测在心力衰竭诊断中的价值。
二、材料与方法1. 研究对象本研究纳入近期在我院接受治疗的疑似心力衰竭患者,并设立健康对照组。
所有患者均接受详细病史采集、体格检查及常规实验室检查。
2. 检测方法(1)外周血线粒体DNA(mtDNA)检测:采集患者外周静脉血,提取DNA,通过PCR技术扩增线粒体基因,分析mtDNA 的拷贝数及突变情况。
(2)生长分化因子-15(GDF-15)检测:采用酶联免疫吸附法(ELISA)测定血清中GDF-15的含量。
(3)脑钠肽(BNP)检测:利用免疫荧光法测定血清中BNP水平。
3. 数据分析采用SPSS软件进行数据分析,比较各指标在心力衰竭患者与健康人群中的差异,分析各指标的联合诊断价值。
三、结果1. 外周血mtDNA在心力衰竭患者中的表达情况研究发现,心力衰竭患者外周血mtDNA的拷贝数明显高于健康对照组,且与心功能分级呈正相关。
表明mtDNA可能参与心力衰竭的发生与发展过程。
2. GDF-15在心力衰竭患者中的表达情况GDF-15是一种与心肌细胞损伤和纤维化密切相关的生物标志物。
研究显示,心力衰竭患者血清中GDF-15水平显著升高,且与心功能分级及病情严重程度密切相关。
3. BNP在心力衰竭诊断中的应用BNP是临床上常用的心力衰竭生物标志物,其水平升高与心力衰竭的严重程度及预后不良密切相关。
本研究中,BNP在心力衰竭患者中的水平显著高于健康对照组。
人线粒体DNA(mtDNA)核酸检测试剂盒说明书【名称】通用名:人线粒体DNA(mtDNA)核酸扩增检测试剂盒英文名:Human Mitochontriol DNA Fluorescence quantitative Polymerase Chain Reaction(PCR)Diagnostic kit汉语拼音:ren xian li ti DNA he suan kuo zeng jian ce shi ji he【目的】本试剂盒适用于检测人外周血、精液或组织等样本中线粒体DNA,用于生殖、胃肠功能紊乱以及遗传性相关疾病如男性不孕等疾病的辅助诊断以及药物疗效观察。
其检测结果仅供临床参考。
【原理】本试剂盒选取一对线粒体DNA(mtDNA)特异性引物和一条特异性荧光探针,应用碱裂解法提取DNA,后者在耐热DNA聚合酶(Taq酶)作用下,配以FQ-Buffer(内含Mg2+、Tris-HCl等)、四种核苷酸单体(dNTPs)等成分,通过PCR-荧光探针法提取扩增法对线进行扩增,从而达到快速实时定量检测线粒体DNA(mtDNA)之目的。
【组成】名称数量规格核酸提取液B4管500μl/管Taq酶系1管80μl/管mtDNA–PCR MIX1管960μl/管mtDNA阳性质控品1管50μl/管(1×107Copies/ml)阴性质控品1管500μl/管备注:红细胞裂解液(10×RCLB)等另行配备。
【标本采集、保存和运输】1.全血:用无菌注射器抽取受检者静脉血1毫升,注入无菌2ml EDTA2Na(或柠檬酸钠)抗凝管,立即混匀。
2.精液:无菌条件下取精液1-3ml,转至5ml洁净的离心管中,密闭送检。
3.组织:无菌条件下取待检组织0.1-0.5g,转至1.5ml洁净的离心管中,密闭送检。
3.保存和运输:标本可立即用于测试,2-8℃保存下不应超过24小时;-70℃以下长期保存。
避免反复冻融。
・论 著・ 线粒体DNA 提取方法的比较3李伟文 陆松敏 刘建仓 武 凡 李 萍 柏干荣第三军医大学野战外科研究所(重庆,400042) 摘要 目的将提取线粒体DNA 的碱变性法、T riton 法、改进高盐沉淀法加以比较,以得到最方便快速提取线粒体DNA 的方法。
方法分离W istar 大鼠小肠上皮细胞,用3种方法提取线粒体DNA ,紫外分光光度法定量。
用琼脂糖凝胶电泳和线粒体A T Pase 8亚基基因PCR 扩增产物鉴定所提取的线粒体DNA 。
结果改进高盐沉淀法线粒体DNA 量最多,T riton 法最少。
OD 260 OD 280均在1.78~1.85间。
将改进高盐沉淀法提取线粒体DNA 用于PCR 扩增,测定出了线粒体DNA A T Pase 8亚基基因序列。
结论改进高盐沉淀法提取线粒体DNA 具有操作简单,产量多的优点,该法所提取m tDNA 可用于m tDNA 测序。
关键词 线粒体;DNA ;分子遗传学3国家“九七三”项目资金资助(G 1999054202) 1981年,A nderson 用氯化铯密度梯度分离得到线粒体DNA (m tDNA ),进行了全序列分析。
此后,m tDNA 的研究日益得到重视。
本实验将T riton 法、碱变性法与改进高盐沉淀法进行了比较,发现后者具有简便、经济、易重复等优点。
1 材料和方法111 试剂和溶液琼脂糖系P rom ega 产品,其它生化试剂系国产分析纯。
①溶液 :含T ris 2HC l 10mm o l L ,N aC l 10mm o l L ,M gC l 25mm o l L pH 7.5;②溶液 :T ris 2HC l 10mm o l L ,N aC l 400mm o l L ,ED TA 2mm o l L pH 8.0;③溶液A :含50mm o l L 葡萄糖,25mm o l L T ris 2HC l 30mm o l L ED TA N a 2,pH 8.0;④溶液B :0.2m o l L N aOH 含1%SD S (临用前用5m o l L N aOH 和10%SD S 贮存液配制);⑤溶液C :3m o l L 醋酸钾溶液,pH 5.4,含5m o l L 醋酸根离子;⑥T riton 溶解液:含10mm o l L KC l ,15mm o l L T ris 2HC l ,pH 8.3, 2.5mm o l L M gC l 2,1%V V T riton X 2100;⑦ΚDNA B am H M arker 16841、7233、6770、6527、5256 5505bp ;⑧BD 2000M arker 3000,2000,1000,750,500,200bp 。