第6讲晶体结构分析
- 格式:doc
- 大小:2.21 MB
- 文档页数:15



物质结构要点1、核外电子排布式外围核外电子排布式价电子排布式价电子定义:1、对于主族元素,最外层电子2、第四周期,包括3d与4S 电子电子排布图熟练记忆 Sc Fe Cr Cu2、S能级只有一个原子轨道向空间伸展方向只有1种球形P能级有三个原子轨道向空间伸展方向有3种纺锤形d能级有五个原子轨道向空间伸展方向有5种一个电子在空间就有一种运动状态例1:N 电子云在空间的伸展方向有4种N原子有5个原子轨道电子在空间的运动状态有7种未成对电子有3个 ------------------------结合核外电子排布式分析例23、区的划分按构造原理最后填入电子的能级符号如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全满较稳定,比后面一个元素电离能较大)例3、比较C、N、O、F第一电离能的大小 --------------- F >N>O>C例4、某元素的全部电离能(电子伏特)如下:回答下列各问:(1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有一个较大的差值_________________________________(3)此元素原子的电子层有 __________________层。
最外层电子构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O >N >C6、对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电子体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电子体从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。

物质结构要点1、核外电子排布式外围核外电子排布式价电子排布式价电子定义:1、对于主族元素,最外层电子2、第四周期,包括3d与4S 电子电子排布图熟练记忆 Sc Fe Cr Cu2、S能级只有一个原子轨道向空间伸展方向只有1种球形P能级有三个原子轨道向空间伸展方向有3种纺锤形d能级有五个原子轨道向空间伸展方向有5种一个电子在空间就有一种运动状态例1:N 电子云在空间的伸展方向有4种N原子有5个原子轨道电子在空间的运动状态有7种未成对电子有3个 ------------------------结合核外电子排布式分析例23、区的划分按构造原理最后填入电子的能级符号如Cu最后填入3d与4s 故为ds区 Ti最后填入能级为3d故为d 区4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全满较稳定,比后面一个元素电离能较大)例3、比较C、N、O、F第一电离能的大小 --------------- F>N>O>C例4、某元素的全部电离能(电子伏特)如下:I1I2 I3I4 I5 I6 I7 I823.6 35.1 54.977.4 113.9 138.1 739.1 871.1回答下列各问:(1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有一个较大的差值_________________________________ (3)此元素原子的电子层有 __________________层。
最外层电子构型为 ______________5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O>N >C6、对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征例5、N2 CO CN--C22-互为等电子体CO2 CS2N2O SCN-- CNO-- N3-互为等电子体从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。



第4章变石和猫眼4.1 概述金绿宝石的英文名称为Chrysoberyl。
这个词来源于希腊语,是金黄色(chryso)•和绿柱石(beryl)词合并而成,高度概括了金绿宝石的颜色特征。
一般情况下,金绿宝石呈明亮的褐黄色和绿黄色。
金绿宝石中的二种品种因显特殊的猫眼效应和变色效应而成为所有宝石著名的高档宝石品种。
显猫眼效应的称猫眼石,显变色效应的称变石。
4.2 基本性质4.2.1 结晶学性质(1)晶系:斜方晶系。
(2)结晶习性和表面特征:矿物晶体呈扁平状、板状或短柱状,晶面上常有平行条纹,晶体常形成假六方的三连晶穿插双晶(见图2-4-1)。
图2-4-1 金绿宝石常见晶形4.2.2 化学成分金绿宝石为铍铝氧化物,化学分子式为BeAl2O4,并含有少量微量元素Fe、Cr、Ti等,不同的微量元素使金绿宝石矿物产生不同的颜色。
4.2.3 物理性质1、光学特征(1)颜色:通常为浅-中等的黄色至黄绿色、灰绿色、褐色至黄褐色以及很罕见的浅蓝色。
(2)光泽和透明度:常为玻璃光泽。
金绿宝石通常为透明-不透明,猫眼石呈亚透明-半透明,变石通常为透明。
(3)光性:二轴晶,正光性。
(4)折射率:1.74-1.75。
(5)双折射率:0.009。
(6)色散:低,为0.014。
(7)多色性:明显,优质变石为强多色性。
(8)发光性:金绿宝石因含铁一般无荧光,变石因含铬有弱荧光。
(9)吸收光谱:金绿宝石在紫光区444nm处有强吸收窄带。
变石品种在红区690nm处有一双线,红橙区有两条弱线,以580nm中心有一吸收区,蓝区475nm、468nm两条吸收线。
(10)特殊的光学效应:部分金绿宝石显示特征的猫眼效应和变色效应,并因此决定金绿宝石重要宝石种,即猫眼石和变石。
2、力学性质(1)解理:可出现三组解理,一组发育中等,另两组发育不完全;猫眼石和变石一般无解理。
(2)断口:金绿宝常出现贝壳状断口。
(3)硬度:一般为8-8.5。
(4)密度:通常为3.72g/cm3。


第六章化学键和晶体结构一、知识框架和要求知识框架路易斯理论价键理论共价键现代共价理论杂化轨道理论化学键离子键互斥理论金属键化学键和晶体结构分子轨道理论分子晶体离子晶体晶体结构原子晶体金属晶体分子的极性分子间力取向力、诱导力、色散力对物质物理性质的影响学习要求1.掌握离子键的形成条件及其特征;2.掌握共价键的形成条件和本质及现代价键理论的基本要点,理解共价键的类型,了解键能、键长及键角等参数;3.掌握杂化轨道的概念、杂化轨道的基本类型及其空间构型的关系;4.了解分子轨道理论的基本要点,并能用其解释第一、二周期同核双原子分子的结构和性质;5.理解价层电子互斥理论的基本要点,并能用其解释多原子分子或离子的空间构型;6.理解分子间作用力和氢键对物质某些性质的影响;7.了解金属键的形成、特性和金属键理论的要点;8.掌握晶体的基本类型、性质和特点;了解极化对晶体性质的影响。
二、重点及难点解析1. 离子键、共价键和金属键的比较 化学键类型 离子键 共价键 金属键概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键 金属阳离子与自由电子通过相互作用而形成的化学键 成键微粒阴阳离子 原子 金属阳离子和自由电子 成键性质静电作用 共用电子对 电性作用 形成条件活泼金属与活泼的非金属元素 非金属与非金属元素 金属内部 实例 NaCl 、MgO HCl 、H 2SO 4 Fe 、Mg小问答1:下列关于化学键的说法,正确的是( )A. 构成单质分子的粒子一定含共价键。
B. 由非金属元素组成的化合物不一定是共价化合物。
C. 非极性键只存在于双原子单质分子里。
D. 不同元素组成的多原子分子里的化学键一定是极性键。
解析:列举法。
A 错,因稀有气体构成的单原子分子中不含共价键。
B 对,例如、 等铵盐是非金属元素组成的离子化合物。
C 错,例如在、等物质中键是非极性键。
D 错,例如中键,中键是非极性键。
晶体晶胞结构讲解物质结构要点1、核外电⼦排布式外围核外电⼦排布式价电⼦排布式价电⼦定义:1、对于主族元素,最外层电⼦2、第四周期,包括3d与4S 电⼦电⼦排布图熟练记忆 Sc Fe Cr Cu2、S能级只有⼀个原⼦轨道向空间伸展⽅向只有1种球形P能级有三个原⼦轨道向空间伸展⽅向有3种纺锤形d能级有五个原⼦轨道向空间伸展⽅向有5种⼀个电⼦在空间就有⼀种运动状态例1:N 电⼦云在空间的伸展⽅向有4种N原⼦有5个原⼦轨道电⼦在空间的运动状态有7种未成对电⼦有3个 ------------------------结合核外电⼦排布式分析例23、区的划分按构造原理最后填⼊电⼦的能级符号如Cu最后填⼊3d与4s 故为ds区 Ti 最后填⼊能级为3d 故为d区4、第⼀电离能:同周期从左到右电离能逐渐增⼤趋势(反常情况:S2与P3 半满或全满较稳定,⽐后⾯⼀个元素电离能较⼤)例3、⽐较C、N、O、F第⼀电离能的⼤⼩ --------------- F >N>O>C例4、某元素的全部电离能(电⼦伏特)如下:回答下列各问:(1)I6到I7间,为什么有⼀个很⼤的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有⼀个较⼤的差值_________________________________(3)此元素原⼦的电⼦层有 __________________层。
最外层电⼦构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增⼤(⽆反常)------------F> O >N >C6、对⾓线规则:某些主族元素与右下⽅的主族元素的性质有些相似,被称为“对⾓线规则”如:锂和镁在空⽓中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原⼦轨道重叠形式分为:σ键和π键 (具有⽅向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电⼦体:原⼦总数相等,价电⼦总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电⼦体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电⼦体从元素上下左右去找等电⼦体,左右找时及时加减电荷,保证价电⼦相等。
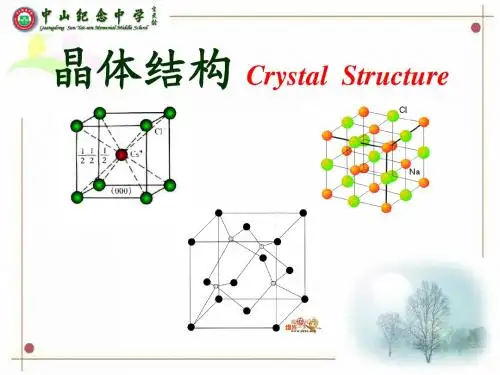
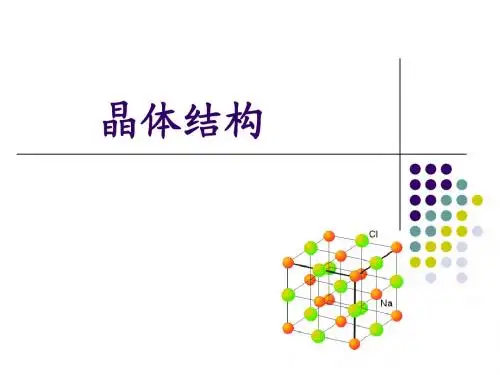
第6讲晶体结构【竞赛要求】晶胞。
原子坐标。
晶格能。
晶胞中原子数或分子数的计算及化学式的关系。
分子晶体、原子晶体、离子晶体和金属晶体。
配位数。
晶体的堆积与填隙模型。
常见的晶体结构类型,如NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、尿素、金红石、钙钛矿、钾、镁、铜等。
点阵的基本概念。
晶系。
宏观对称元素。
十四种空间点阵类型。
分子的极性。
相似相溶规律。
分子间作用力。
范德华力。
氢键。
其他分子间作用力的一般概念。
【知识梳理】一、离子键理论1916 年德国科学家Kossel(科塞尔)提出离子键理论。
(一)离子键的形成1、形成过程以NaCl 为例:(1)电子转移形成离子Na-eˉ= Na+Cl + eˉ= Clˉ相应的电子构型变化:2s22p63s1 →2s22p6 ;3s23p5→3s23p6分别达到Ne 和Ar 的稀有气体原子的结构,形成稳定离子。
(2)靠静电吸引,形成化学键,体系的势能与核间距之间的关系如图所示:注:横坐标——核间距r 。
纵坐标——体系的势能V 。
纵坐标的零点——当r 无穷大时,即两核之间无限远时,势能为零。
下面来考察Na+和Clˉ彼此接近时,势能V的变化。
图中可见:r >r0时,随着r 的不断减小,正负离子靠静电相互吸引,V减小,体系趋于稳定。
r = r0时,V有极小值,此时体系最稳定,表明形成了离子键。
r < r0时,V 急剧上升,因为Na+和Clˉ彼此再接近时,相互之间电子斥力急剧增加, 导致势能骤然上升。
因此,离子相互吸引,保持一定距离时,体系最稳定,即为离子键。
2、离子键的形成条件(1)元素的电负性差要比较大△X > 1.7,发生电子转移,形成离子键;△X < 1.7,不发生电子转移,形成共价键。
但离子键和共价键之间,并非严格截然可以区分的。
可将离子键视为极性共价键的一个极端,而另一极端为非极性共价键。
如图所示:非极性共价键极性共价键离子键极性增大化合物中不存在百分之百的离子键,即使是NaF 的化学键之中,也有共价键的成分,即除离子间靠静电相互吸引外,尚有共用电子对的作用。
△X > 1.7,实际上是指离子键的成分(百分数)大于50%。
(2)易形成稳定离子Na+(2s22p6),Clˉ(3s23p6),达到稀有气体稳定结构,Ag+(4d10)d轨道全充满的稳定结构。
所以,NaCl、AgCl均为离子化合物;而C和Si 原子的电子结构为ns2np2,要失去全部价电子形成稳定离子,比较困难,所以一般不形成离子键。
如CCl4、SiF4等,均为共价化合物。
(3)形成离子键,释放能量大Na)(s +1/2 Cl)(2g= NaCl)(s△H = -410.9 kJ·mol –1在形成离子键时,以放热的形式,释放较大的能量。
(二)离子键的特征1、作用力的实质是静电引力F∝(q1q2)/ r2(q1、q2分别为正负离子所带电量)2、离子键无方向性、无饱和性因为是静电吸引,所以无方向性;且只要是正负离子之间,则彼此吸引,即无饱和性。
(三)离子键的强度1、键能和晶格能以NaCl 为例:键能:1mol 气态NaCl 分子,离解成气体原子时,所吸收的能量。
用E i 表示。
NaCl)(g = Na)(g+ Cl)(g△H = 键能E i越大,表示离子键越强。
晶格能:气态的正负离子,结合成1mol NaCl 晶体时,放出的能量。
用U表示。
Na+)(g + Cl–)(g= NaCl)(s△H = -U(U为正值)晶格能U越大,则形成离子键时放出的能量越多,离子键越强。
键能和晶格能,均能表示离子键的强度,而且大小关系一致。
通常,晶格能比较常用。
如何求得晶格能?2、玻恩-哈伯循环( Born-Haber Circulation)Born 和Haber 设计了一个热力学循环过程,从已知的热力学数据出发,计算晶格能。
具体如下:△H1等于Na)(s的升华热(S),即△H1= S = – 108.8 kJ·mol –1△H2等于Cl2)(g的离解能(D)的一半,即△H2=(1/2)D = – 119.7 kJ·mol –1△H3等于Na)(g的第一电离能(I1),即△H3= I1 = 496 kJ·mol –1△H4等于Cl)(g的电子亲和能(E)的相反数,即△H4= – E = – 348.7 kJ·mol –1 △H5等于NaCl的晶格能(U)的相反数,即△H5= – U = ?△H6等于NaCl的标准生成热(△f H0m ),即△H6= △f H0m= – 410.9 kJ·mol –1由盖斯定律:△H6= △H1 +△H2+△H3+△H4+△H5所以:△H5=△H6-(△H1 +△H2+△H3+△H4)即:U = △H1 +△H2+△H3+△H4-△H6=108.8+119.7+496-348.7+410.9 = 186.7 kJ·mol –1以上关系称为Born-Haber循环利用盖斯定律,通过热力学也可以计算NaCl 的离子键的键能。
△H1Na的第一电离能I1;△H 2 Cl 的电子亲合能 E 的相反数 –E ; △H 3 NaCl 的晶格能 U 的相反数 –U ; △H 4 NaCl 的升华热 S ;而 △H 5 = – Ei 。
所以,通过 I 1、E 、U 和S 可求出键能 Ei 。
3、影响离子键强度的因素从离子键的实质是静电引力 F ∝ (q 1q 2) / r 2出发,影响 F 大小的因素有:离子的电荷数q 和离子之间的距离 r (与离子半径的大小相关)。
(1)离子电荷数的影响 电荷高,离子键强。
如:(2)离子半径的影响半径大,导致离子间距大,所以作用力小;相反,半径小,则作用力大。
如:(3)离子半径概念将离子晶体中的离子看成是相切的球体,正负离子的核间距 d 是r + 和r – 之和。
d = r + + r – (d 值可由晶体的X 射线衍射实验测定得到)。
1926年,哥德希密特(Goldschmidt )用光学方法测定,得到了F –和O 2– 的半径,分别为133 pm 和132 pm ,结合X 射线衍射数据得到一系列离子半径:Mg 2+ 的半径 r = --2O MgO r d = 320 pm – 132 pm =78 pm 这种半径为哥德希密特半径。
1927年,Pauling 用最外层电子到核的距离,定义为离子半径,并利用有效核电荷等关系,求出一套离子半径数据,称为 Pauling 半径。
教材上两套数据均列出。
一般在比较半径大小和讨论规律变化时,多采用Pauling 半径。
(3)离子半径的变化规律①同主族,从上到下,电子层增加,具有相同电荷数的离子半径增加。
如: Li + < Na + < K + < Cs +;F – < Cl – < Br – < I –②同周期主族元素,从左至右,离子电荷数升高,最高价离子,半径最小。
如: Na + < Mg 2+ < Al 3+ ;K + < Ca 2+ 过渡元素,离子半径变化规律不明显。
③同一元素,不同价态的离子,电荷高的半径小。
如: Ti 4+ < Ti 3+;Fe 3+ < Fe 2+④一般负离子半径较大;正离子半径较小。
如:可见,虽然F 与K 相差两个周期,但F – 的半径仍比K + 的半径大。
⑤周期表对角线上,左上元素和右下元素的离子半径相似。
如:Li + 和 Mg 2+, Sc 3+ 和 Zr 4+ 的半径相似。
(四)离子晶体的特点 1、无确定的分子量 NaCl 晶体是个大分子,无单独的NaCl 分子存在于分子中。
NaCl 是化学式,因而 58.5 是式量,不是分子量。
2、导电性水溶液或熔融态导电,是通过离子的定向迁移导电,而不是通过电子流动而导电。
3、熔点沸点较高4、硬度高,延展性差因离子键强度大,所以硬度高。
如果发生位错:发生错位,正正离子相切,负负离子相切,彼此排斥,离子键失去作用,故无延展性。
如CaCO 3可用于雕刻,而不可用于锻造,即不具有延展性。
(五)离子晶体的空间结构 1、对称性(1)旋转和对称轴 n 重轴,360度旋转,可以重复n 次。
(2)反映和对称面晶体中可以找到对称面。
(3)反映和对称中心晶体中可以找到对称中心。
2、晶胞晶胞是晶体的代表,是晶体中的最小单位,晶胞并置起来,则得到晶体。
晶胞的代表性体现在以下两个方面:一是代表晶体的化学组成;二是代表晶体的对称性,即具有相同的对称元素(对称轴,对称面和对称中心)。
晶胞是晶体中具有上述代表性的体积最小,直角最多的平行六面体。
3、离子晶体的空间结构(1)离子晶体的堆积填隙模型在离子晶体中,占据晶格结点的是正离子和负离子,负离子半径一般比正离子大,因此负离子在占据空间方面起着主导作用。
在简单的二元离子晶体中,负离子只有一种,可以认为负离子按一定的方式堆积,而正离子填充在其间的空隙中。
常见的负离子堆积方式有三种:立方密堆积或称面心立方密堆积,六方密堆积和简单立方堆积。
最后一种不是密堆积,它的晶胞是立方体,八个角顶上各有一个负离子。
在立方密堆积和六方密堆积中有两种空隙:一种是四个相邻的负离子所包围的空隙,称为四面体空隙;一种是由六个相邻的负离子所包围的空隙,称为八面体空隙。
这两种密堆积结构中,负离子数︰八面体空隙数︰四面体空隙数 = 1︰1︰2。
在简单立方堆积中,只有一种空隙,即由八个相邻的负离子 所包围的立方体空隙,而负离子数︰立方体空隙数= 1︰1。
正负离子配位数(CN +)一般可由正负离子半径比规则确定:r + /r - = 0.225 - 0.414时,CN +为4; r + /r - = 0.414 - 0.732时,CN +为6; r + / r - = 0.732 - 1时,CN +为8。
负离子配位数(CN -)可由下式确定:CN - / CN + = 正离子数 / 负离子数 = 负离子电荷 / 正离子电荷例如金红石TiO 2晶体中,r (Ti 4+ / r (O 2—) = 68 pm / 140 pm = 0.486,CN +为6,正负离子Ti 4+ 占据八面体空隙;CN -为3;金红石晶体中,负离子数︰八面体空隙数 = 1︰1,Ti 4+数只有O 2—数的一半,因此Ti 4+ 离子只占据八面体空隙数的1/2。
在描述简单离子晶体结构型式时,一般只要着重指出负离子的堆积方式以及正负离子所占空隙的种类与分数,基本上就抓住了离子晶体结构的主要特征。
对于简单的二元离子晶体来说,正负离子在空间的排列方式(即结构形式)主要取决于正负离子的数量比(或称组成比)和半径比。
常见的六种二元离子晶体典型结构型式如表1所示。