12典型晶体的结构解析
- 格式:pptx
- 大小:807.55 KB
- 文档页数:23

课时跟踪训练(十二)[基础巩固]1.普通玻璃和水晶的根本区别在于( )A.外形不一样B.普通玻璃的基本构成微粒无规则排列,水晶的基本构成微粒按一定规律做周期性重复排列C.水晶有固定的熔点,普通玻璃无固定的熔点D.水晶可用于能量转换,普通玻璃不能用于能量转换[解析]普通玻璃为非晶体,水晶为晶体,它们的根本区别在于内部微粒是否按一定规律做周期性重复排列,即晶体具有自范性。
两种物质在性质上的差异正是其内部结构不同的体现。
[答案] B2.下列不属于晶体的特点的是( )A.一定有规则的几何外形B.一定有各向异性C.一定有固定的熔点D.一定是无色透明的固体[解析]晶体的特点是有规则的几何外形(由晶体的自范性决定)、固定的熔点及各向异性,但不一定是无色透明的固体,如紫色的碘晶体和蓝色的硫酸铜晶体等。
[答案] D3.下列途径不能得到晶体的是( )A.熔融态SiO2快速冷却B.熔融态SiO2热液缓慢冷却C.FeCl3蒸气冷凝D.CuSO4溶液蒸发浓缩后冷却[解析]晶体呈现自范性是需要一定条件的,即晶体生长的速率要适当。
熔融态物质快速冷却时不能得到晶体,如熔融态SiO2快速冷却得到看不到晶体外形的玛瑙,热液缓慢冷却则形成水晶。
FeCl3、AlCl3等固体均易升华,其蒸气凝华则得到晶体。
D项析出胆矾晶体(CuSO4·5H2O)。
[答案] A4.水的状态除了气、液和固态外,还有玻璃态。
它是由液态水急速冷却到165 K时形成的。
玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述中正确的是( )A.水由液态变为玻璃态,体积缩小B .水由液态变为玻璃,体积膨胀C .玻璃态是水的一种特殊状态D .玻璃态水能使X射线产生衍射[解析] 玻璃态水无固定形状,不存在晶体结构,故玻璃态水不是晶体,不能使X射线产生衍射;因密度与普通水相同,故水由液态变为玻璃态时体积不变。

物质结构要点1、核外电子排布式外围核外电子排布式价电子排布式价电子定义:1、对于主族元素,最外层电子2、第四周期,包括3d与4S 电子电子排布图熟练记忆 Sc Fe Cr Cu2、S能级只有一个原子轨道向空间伸展方向只有1种球形P能级有三个原子轨道向空间伸展方向有3种纺锤形d能级有五个原子轨道向空间伸展方向有5种一个电子在空间就有一种运动状态例1:N 电子云在空间的伸展方向有4种N原子有5个原子轨道电子在空间的运动状态有7种未成对电子有3个 ------------------------结合核外电子排布式分析例23、区的划分按构造原理最后填入电子的能级符号如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全满较稳定,比后面一个元素电离能较大)例3、比较C、N、O、F第一电离能的大小 --------------- F >N>O>C例4、某元素的全部电离能(电子伏特)如下:回答下列各问:(1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有一个较大的差值_________________________________(3)此元素原子的电子层有 __________________层。
最外层电子构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O >N >C6、对角线规则:某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”如:锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电子体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电子体从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。

晶体结构解析
晶体结构解析是通过实验测定晶体的结构,并确定晶体中原子或分子的排列方式、空间坐标和键合情况等信息的过程。
晶体结构解析对于研究材料的物理、化学和生物学性质以及设计新材料具有重要意义。
晶体结构解析的步骤包括:
1. 晶体的培养和选取:选择合适的晶体生长条件,培养出高质量的晶体。
2. X 射线衍射实验:使用 X 射线衍射仪对晶体进行衍射实验,得到衍射图谱。
3. 数据处理和结构因子计算:对衍射图谱进行数据处理,计算结构因子。
4. 结构模型建立:根据结构因子和化学知识,建立晶体的结构模型。
5. 结构精修:通过不断调整结构模型的参数,使其与实验数据相符合,得到最终的晶体结构。
晶体结构解析需要结合化学、物理学和数学等多学科知识,需要专业的实验技能和计算能力。
目前,晶体结构解析已经成为材料科学、化学、生物学等领域的重要研究手段。

几种典型晶体结构的特点分析徐寿坤有关晶体结构的知识是高中化学中的一个难点,它能很好地考查同学们的观察能力和三维想像能力,而且又很容易与数学、物理特别是立体几何知识相结合,是近年高考的热点之一。
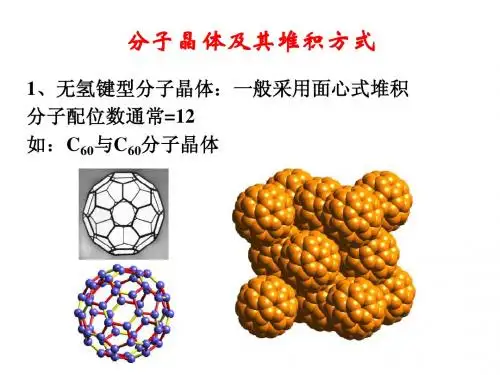
熟练掌握NaCl 、CsCl 、CO 2、SiO 2、金刚石、石墨、C 60等晶体结构特点,理解和掌握一些重要的分析方法与原则,就能顺利地解答此类问题。
通常采用均摊法来分析这些晶体的结构特点。
均摊法的根本原则是:晶胞任意位置上的原子如果是被n 个晶胞所共有,则每个晶胞只能分得这个原子的1/n 。
1. 氯化钠晶体由下图氯化钠晶体结构模型可得:每个Na +紧邻6个-Cl ,每个-Cl 紧邻6个+Na (上、下、左、右、前、后),这6个离子构成一个正八面体。
设紧邻的Na +-a ,每个Na +与12个Na +等距离紧邻(同层4个、上层4个、下层4个),距离为a 2。
由均摊法可得:该晶胞中所拥有的Na +数为4216818=⨯+⨯,-Cl 数为441121=⨯+,晶体中Na +数与Cl -数之比为1:12. 氯化铯晶体每个Cs +紧邻8个-Cl -紧邻8个Cs +,这8个离子构成一个正立方体。
设紧邻的Cs +与Cs +间的距离为a 23,则每个Cs +与6个Cs +等距离紧邻(上、下、左、右、前、后)。
在如下图的晶胞中Cs +数为812164112818=+⨯+⨯+⨯,-Cl 在晶胞内其数目为8,晶体中的+Cs 数与-Cl 数之比为1:1,则此晶胞中含有8个CsCl 结构单元。
3. 干冰每个CO 2分子紧邻12个CO 2分子(同层4个、上层4个、下层4个),则此晶胞中的CO 2分子数为4216818=⨯+⨯。
4. 金刚石晶体每个C 原子与4个C 原子紧邻成键,由5个C 原子形成正四面体结构单元,C-C 键的夹角为'28109︒。
晶体中的最小环为六元环,每个C 原子被12个六元环共有,每个C-C 键被6个六元环共有,每个环所拥有的C 原子数为211216=⨯,拥有的C-C 键数为1616=⨯,则C 原子数与C-C 键数之比为2:11:21=。

14种晶体结构晶体是由原子、分子或福隔离子按照一定的空间规则排列而成的有序固体。
晶体结构是指晶体中原子、离子或分子排列的规则和顺序。
在固体物质中,晶体结构的种类有很多种,其中比较常见的有以下14种:1. 立方晶体结构:最简单的晶体结构之一,具有三个等长的边和六个等角,包括简单立方、体心立方和面心立方三种类型。
2. 六方晶体结构:其晶胞的基本结构是六方密堆,其中最典型的就是六方晶体和螺旋晶体。
3. 正交晶体结构:晶胞具有三个不相互垂直的晶轴,分别被称为a、b 和c 轴,是最常见的晶体结构之一。
4. 单斜晶体结构:晶胞具有两个不相互垂直的晶轴,是晶体结构中的一种。
5. 三方晶体结构:具有三个相等的轴,夹角为60度,最常见的晶体结构之一是石英。
6. 菱晶体结构:晶胞内部有四面体结构,是一种简单的晶体结构。
7. 钙钛矿晶体结构:一种具有钙钛矿结构的晶体,包括钙钛矿结构和螺旋钙钛矿结构。
8. 蜗牛晶体结构:晶胞的形状像一只蜗牛的壳,是晶体结构中的一种。
9. 立方密排晶体结构:晶胞的结构是立方密排,是晶体结构中的一种。
10. 体心立方晶体结构:晶体结构的晶胞中有一个原子位于晶体的中心,是晶体结构中的一种。
11. 面心立方晶体结构:晶体结构的晶胞的各个面的中心有一个原子,是晶体结构中的一种。
12. 钻石晶体结构:晶体结构的晶胞构成了一种钻石结构,是晶体结构中的一种。
13. 银晶体结构:晶体结构的晶胞构成了一种银结构,是晶体结构中的一种。
14. 锶钛矿晶体结构:晶体结构的晶胞构成了一种锶钛矿结构,是晶体结构中的一种。
晶体结构的种类繁多,每种晶体结构都有其独特的结构特点和性质,对晶体的物理和化学性质有着重要的影响。
研究晶体结构不仅可以帮助我们更好地了解晶体的构成和性质,还有助于我们在材料科学、物理化学等领域的应用和研究。
因此,对晶体结构的研究具有重要的科学意义和应用价值。

典型的晶体结构
晶体是由具有规则排列的原子、分子或离子组成的固体。
晶体结构是指晶体中各个原子、分子或离子的排列方式和周期性的空间堆积规律。
钠氯化物晶体是一种典型的离子晶体,其晶体结构由钠离子(Na+)和氯离子(Cl-)组成。
钠氯化物晶体结构属于立方晶系,具体来说是面心立方晶系。
在立方晶系中,晶胞由于具有三个相等的边长和90度的内角,因此钠氯化物晶体结构的晶胞形状是一个立方体。
在钠氯化物晶体结构中,每个钠离子都被六个氯离子包围,而每个氯离子也被六个钠离子包围。
这种排列方式使得钠氯化物晶体呈现出高度的对称性和周期性。
在晶体结构中,钠离子和氯离子的排列方式是相互平衡的,以使得整个晶体结构达到最低能量状态。
钠氯化物晶体中的钠离子和氯离子之间通过离子键相互吸引。
离子键是一种强大的化学键,它是由正负电荷之间的电静力吸引力所形成的。
钠离子和氯离子之间的离子键使得钠氯化物晶体具有高熔点、脆性和良好的导电性。
钠氯化物晶体结构的周期性排列使得其具有许多重要的性质和应用。
由于其高熔点和稳定性,钠氯化物被广泛应用于熔盐堆核能反应堆的燃料。
此外,钠氯化物晶体也广泛用于制备其他化合物和合金,
以及用作化学试剂和催化剂。
钠氯化物晶体结构是一种典型的离子晶体结构,具有高度的对称性和周期性排列。
其晶胞形状为立方体,钠离子和氯离子通过离子键相互吸引并形成稳定的晶体结构。
钠氯化物晶体结构不仅具有重要的化学性质和物理性质,还有广泛的应用领域。




几种常见晶体结构分析河北省宣化县第一中学 栾春武 邮编 075131栾春武:中学高级教师,张家口市中级职称评委会委员。
河北省化学学会会员。
市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。
联系电话: E-mail :一、氯化钠、氯化铯晶体——离子晶体由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。
阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。
离子的配位数分析如下:离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为14,面上的微粒属于该单元中所占的份额为12,中心位置上(嚷里边)的微粒才完全属于该单元,即所占的份额为1。
1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。
每个Na +周围与其最近且距离相等的Na +有12个。
见图1。
| 晶胞中平均Cl -个数:8×18 + 6×12 = 4;晶胞中平均Na +个数:1 + 12×14 = 4因此NaCl 的一个晶胞中含有4个NaCl (4个Na +和4个Cl -)。
2.氯化铯晶体中每个Cs +周围有8个Cl -,每个Cl -周围有8个Cs +,与一个Cs +距离最近且相等的Cs +有6个。
晶胞中平均Cs +个数:1;晶胞中平均Cl -个数:8×18 = 1。
因此CsCl 的一个晶胞中含有1个CsCl (1个Cs +和1个Cl -)。
二、金刚石、二氧化硅——原子晶体1.金刚石是一种正四面体的空间网状结构。
每个C 原子以共价键与4个C 原子紧邻,因而整个晶体中无单个分子存在。
由共价键构成的最小环结构中有6个碳原子,不在同一个平面上,每个C 原子被12个六元环共用,每C —C 键共6个环,因此六元环中的平均C 原子数为6×112 = 12 ,平均C —C 键数为6×16 = 1。
晶体晶胞结构讲解物质结构要点1、核外电⼦排布式外围核外电⼦排布式价电⼦排布式价电⼦定义:1、对于主族元素,最外层电⼦2、第四周期,包括3d与4S 电⼦电⼦排布图熟练记忆 Sc Fe Cr Cu2、S能级只有⼀个原⼦轨道向空间伸展⽅向只有1种球形P能级有三个原⼦轨道向空间伸展⽅向有3种纺锤形d能级有五个原⼦轨道向空间伸展⽅向有5种⼀个电⼦在空间就有⼀种运动状态例1:N 电⼦云在空间的伸展⽅向有4种N原⼦有5个原⼦轨道电⼦在空间的运动状态有7种未成对电⼦有3个 ------------------------结合核外电⼦排布式分析例23、区的划分按构造原理最后填⼊电⼦的能级符号如Cu最后填⼊3d与4s 故为ds区 Ti 最后填⼊能级为3d 故为d区4、第⼀电离能:同周期从左到右电离能逐渐增⼤趋势(反常情况:S2与P3 半满或全满较稳定,⽐后⾯⼀个元素电离能较⼤)例3、⽐较C、N、O、F第⼀电离能的⼤⼩ --------------- F >N>O>C例4、某元素的全部电离能(电⼦伏特)如下:回答下列各问:(1)I6到I7间,为什么有⼀个很⼤的差值?这能说明什么问题? _________________________(2)I4和I5间,电离能为什么有⼀个较⼤的差值_________________________________(3)此元素原⼦的电⼦层有 __________________层。
最外层电⼦构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增⼤(⽆反常)------------F> O >N >C6、对⾓线规则:某些主族元素与右下⽅的主族元素的性质有些相似,被称为“对⾓线规则”如:锂和镁在空⽓中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱7、共价键:按原⼦轨道重叠形式分为:σ键和π键 (具有⽅向性和饱和性)单键 -------- 1个σ键双键------1个σ键和1个π键三键---------1个σ键和2个π键8、等电⼦体:原⼦总数相等,价电⼦总数相等----------具有相似的化学键特征例5、N2 CO CN-- C22-互为等电⼦体CO2 CS2 N2O SCN-- CNO-- N3- 互为等电⼦体从元素上下左右去找等电⼦体,左右找时及时加减电荷,保证价电⼦相等。