第三章大气化学反应动力学
- 格式:ppt
- 大小:562.50 KB
- 文档页数:64

化工原理第二版下册答案化工原理是化学工程专业的基础课程,它包括了化学工程领域内的基本原理和基础知识。
本文档将围绕《化工原理第二版下册》中的答案进行详细解析和讲解,希望能够帮助学习者更好地理解和掌握化工原理的相关知识。
第一章,化工原理概述。
在化工原理概述部分,主要介绍了化工原理的基本概念、发展历程以及其在化学工程领域中的重要性。
学习者需要深入理解化工原理的内涵和外延,明确其在工程实践中的应用价值和意义。
此外,还需要了解化工原理与其他相关学科的关系,以及其在工程实践中的具体应用。
第二章,物质的基本性质。
物质的基本性质是化工原理中的重要内容之一,它包括了物质的组成、结构、性质以及相互转化规律等方面的内容。
学习者需要掌握物质的基本分类、性质参数的测定方法以及物质在化学工程过程中的应用。
此外,还需要了解物质的相变规律、热力学性质以及其在工程实践中的具体应用。
第三章,化学反应动力学。
化学反应动力学是化工原理中的重要内容之一,它包括了化学反应速率、反应机理以及影响反应速率的因素等方面的内容。
学习者需要掌握化学反应速率的表达式、反应速率常数的计算方法以及影响反应速率的因素。
此外,还需要了解反应动力学模型的建立方法、反应速率控制步骤以及其在工程实践中的具体应用。
第四章,流体力学。
流体力学是化工原理中的重要内容之一,它包括了流体的基本性质、流体流动规律以及流体在工程实践中的应用等方面的内容。
学习者需要掌握流体的基本性质参数、流体流动的基本方程以及流体在管道、泵站、阀门等设备中的流动规律。
此外,还需要了解流体的黏性、湍流、层流等特性以及其在工程实践中的具体应用。
第五章,传热学。
传热学是化工原理中的重要内容之一,它包括了传热的基本规律、传热方式以及传热设备的设计与应用等方面的内容。
学习者需要掌握传热的基本参数、传热方式的传热系数计算方法以及传热设备的设计原理。
此外,还需要了解传热的对流、辐射、传导等方式以及其在工程实践中的具体应用。

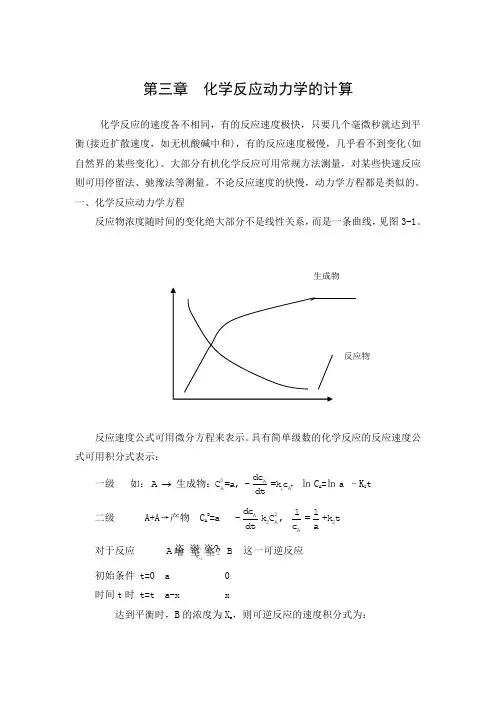
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。



化学动力学化学动力学的概述化学反应动力学主要研究两方面的内容,一是化学反应进行的快慢即反应速率的研究,包括反应快慢的描述,影响反应速率的各种因素。
二是对反应机理的阐述,确定反应的历程,用所建立起来的理论来解释实验得到的结论。
化学反应进行的动力学描述 一、反应速率我们如何对一个反应进行的快慢进行描述呢,注意到反应进度ξ是描述一个反应进行程度的物理量,如果建立起来ξ与时间t 的关系,我们就可以确定出一个反应进行的快慢。
那么t∂∂ξ就可以用来衡量一个反应的快慢,称之为化学反应的转化速率。
我们常用的描述反应快慢的物理量是化学反应速率r=tV ∂∂ξ1,即单位体积内反应进度随时间的变化率。
对于上式,若V 不是t 的函,那么则可以放入微分号内,写成r=tc t V n t V BB B B ∂∂=∂∂=∂∂ννξ1)()(其中νB 表示化学计量数。
对于不同的物质来说νB 是不同的,若有反应αA →βB+γC ,我们定义r A = -tc A∂∂α1为A 的消耗速率,或r B = t c B ∂∂β1的生成速率。
需要注意的是,对于一个反应来说不同物质的化学反应速率是相同的,但是各自的生成(消耗)速率是不同的,与化学计量数成正比。
对于气相反应,我们还可以通过理想气体状态方程来写出它的用压力表示的速率表达式,以及换算关系。
二、速率方程我们确定了描述反应快慢的物理量——化学反应速率,那么这个速率与什么有关,具体的关系又是什么呢?这个关系就是速率方程。
对于反应αA+βB=γC+…来说,其速率方程为,r=k[c A ]a [c B ]b ,其中的r 为整个反应的化学反应速率,若针对某一具体的物质应为r A =k A [c A ]a [c B ]b ,其他物质的表达形式与之类似。
其中,k 称为速率常数,只与温度有关,a 和b 为对应浓度的指数,与α和β一般不等。
只有在基元反应中,才相等。
a+b 称为反应级数,对于任何一个能写成上述简单速率方程的表达式,都是成立的,无论基元反应还是非基元反应。



第三章化学动力学基础1. 有A气体和B气体进行反应,若将A气体浓度增加一倍,速率增加400 %,若将B气体的浓度增加一倍,速率增加200%,试写出反应式。
2. 下列生成NO2的反应:2NO +。
2 —2NO2其反应速率表示式为v 二k[NO]2[O2]如果压力增加到原来的两倍,试计算速率之变化。
3. 在抽空的刚性容器中,引入一定量纯A气体,发生如下反应:A(g)——B(g) + 2C(g)。
设反应能进行完全,经恒温到323K时,开始计时,测定体系总压随时间的变化关系如下:求该反应级数及速率常数4. 若气体混合物体积缩小到原来的1/3,下列反应的初速率变化为多少?2SO2 + O2 > 2SO3的k = 1.35 105. 在308K 时,反应N2O5© —2NO2(g) +1/2O2(g)在318K时,k = 4.98 10「5,试求这个反应的活化能?6. CH3CHO 的热分解反应是:CH3CHO(g) > CH4(g) + CO(g)在700K 时,k=0.0105,已知Ea=188.1kJ mol-二试求800K 时的k。
7. 已知HCI(g)在1atm和25C时的生成热为一88.2kJ mol",反应H2(g) + Cl 2(g) = 2HCI(g)的活化能为112.9kJ mol_1。
试计算逆反应的活化能。
8. 某一个化学反应,当温度由300K升高到310K时,反应速率增加了一倍,试求这个反应的活化能。
9. 某化学反应,在300K时,20min内反应完成了50%,在350K时,5min内反应完成了50%,计算这个反应的活化能。
10. 已知在320 C时反应SO2Cl2(g) > SO2(g)+Cl 2(g)是一级反应,速率常数为2.2 10「5S「试求:(1)10.0gSO2 Cl2分解一半需多少时间?(2)2.00gSO2Cl2经2h之后还剩多少克?39kJmo「S当人发烧到313K时,11. 在人体内,被酵母催化的某生化反应的活化能为此反应的速率常数增大到多少倍?催化剂12. ---------------------------------------------------------- 蔗糖催化水解C12H22O11+H2O* 2C6H12O6是一级反应,在25 C速率常数为5.7 10电"。


化学反应动力学模型的构建与应用第一章前言化学反应动力学是研究化学反应速率和机理的分支学科。
它对于揭示和优化化学反应过程、控制反应速率以及设计合成新材料等方面有着重要的作用。
化学反应动力学模型是一种数学模型,它能够描述化学反应过程的速率和机理,为化学反应过程的探究和优化提供了重要的理论依据。
本文将围绕化学反应动力学模型的构建与应用展开,首先介绍化学反应动力学的基本概念和研究方法,然后重点讲解化学反应动力学模型的构建方法和不同类型的模型,最后探究化学反应动力学模型在实际应用中的作用和发展前景。
第二章化学反应动力学的基本概念和研究方法化学反应动力学主要研究的是化学反应速率和反应机理。
化学反应速率描述的是单位时间内反应物消耗或产物生成的速率。
反应速率可以由反应物浓度的变化率来表示,并受到反应温度、方法、溶液浓度、催化剂等因素的影响。
反应机理则是描述化学反应发生过程中的分子碰撞、化学键形成和断裂、中间物形成和消失等过程的机理。
化学反应动力学的研究方法主要有实验和理论两种。
实验方法包括描绘速率规律的瞬态方法和测定动力学参数的稳态方法,其中稳态方法又分为初始速率法、半衰期法和等时方法。
理论方法则是通过建立数学模型来描述化学反应过程和机理的变化。
化学反应动力学模型是理论方法的一种实现形式,它将反应速率和反应机理等信息转换为数学公式,并求解出反应过程的变化规律。
第三章化学反应动力学模型的构建方法化学反应动力学模型的构建方法分为经验方法和理论方法两类。
经验方法是指通过对大量实验数据的分析和归纳得到的模型,如Arrhenius公式、Michaelis-Menten方程等。
理论方法则是通过基于化学反应机理的方程式和动力学参数来构建模型,如Langmuir-Hinshelwood模型、Eley-Rideal模型等。
构建化学反应动力学模型的步骤包括:确定反应机理和反应速率、建立动力学方程、确定动力学参数、验证模型的可靠性。
化学反应原理综合教案:结合课件、实验、练习等资源,全方位教学第一章:化学反应基本概念1.1 化学反应与化学变化引导学生理解化学反应与化学变化的概念及区别。
通过实例分析,让学生掌握化学反应的基本特征。
1.2 化学反应的类型讲解化合反应、分解反应、置换反应和复分解反应的定义及特点。
通过PPT展示各类反应的实例,加深学生对反应类型的理解。
1.3 化学反应的计量数讲解化学反应中物质的摩尔概念。
引导学生运用化学方程式计算反应物与物的物质的量。
第二章:化学反应速率与化学平衡2.1 化学反应速率讲解化学反应速率的定义及表示方法。
分析影响化学反应速率的因素,如浓度、温度、压强等。
2.2 化学平衡讲解化学平衡的概念及特征。
引导学生理解平衡常数及其应用。
2.3 化学反应速率和化学平衡的应用通过实例分析,让学生掌握化学反应速率和化学平衡在实际问题中的应用。
第三章:化学反应动力学3.1 化学反应动力学基本概念讲解化学反应动力学的定义及研究内容。
引导学生理解反应速率与时间的关系。
3.2 零级反应、一级反应和二级反应讲解零级反应、一级反应和二级反应的定义及特点。
通过实例分析,让学生掌握各类反应的计算方法。
3.3 化学反应动力学的应用通过实例分析,让学生了解化学反应动力学在工业生产、药物研发等领域的应用。
第四章:化学实验技能4.1 化学实验基本操作讲解化学实验的基本操作,如称量、溶解、过滤等。
演示实验操作步骤,让学生掌握实验技能。
4.2 化学实验方案设计引导学生掌握化学实验方案设计的方法。
通过实例分析,让学生学会编写化学实验报告。
4.3 化学实验安全与环保讲解化学实验安全的基本知识。
引导学生关注化学实验过程中的环保问题。
第五章:化学反应与生活5.1 生活中的化学反应分析生活中常见的化学反应现象,如饮食、洗涤剂等。
引导学生了解化学反应在生活中的应用。
5.2 化学反应与能源讲解化学反应在能源领域的应用,如燃烧、电池等。
引导学生关注化学反应与能源开发的关系。