02第二章 化学热动力学
- 格式:ppt
- 大小:320.50 KB
- 文档页数:66


第二章化学热力学基础2.1 热力学概论2.1.11) 高炉炼铁反应Fe2O3 + 3CO = 2Fe + 3CO2 ?2) 汽车尾气污染问题2NO + 2CO = N2 + 2CO2 ?3) 将石墨转化为金刚石C (Graphite) = C (Diamond) ?实现这些化学反应的可能性及反应程度等问题需要化学热力学来解决热力学(themodynamics) :不需要知道物质的内部结构,只从能量观点出发,专门研究能量相互转变过程中所遵循规律的科学。
热力学将宏观物体作为整体看待,直接以宏观实验与观察为基础,从物体表现出的整体宏观现象上总结抽象出共同的规律作为自然法则,然后进行逻辑推演,进而解释和解决各种有关问题。
其理论支柱是四条热力学基本定律,它们是在漫长的岁月中,总结大量正反两方面的实践经验抽象出的宏观法则。
✓热力学研究各种能量之间的转换关系,如电能和机械能、电能和热能等。
✓热力学研究在各种变化过程中发生的各种能量效应。
✓热力学能判断一定条件下的变化能否发生以及进行到什么程度。
所以,尽管热力学是物理学的分支学科,但其应用范围极其广泛,它可以应用于工程学、化学、生物学等学科。
本章从热力学应用于化学的角度,对热力学的基本原理给予初步简介,仅帮助同学们初步地了解如何从宏观角度解释一些化学问题的方法。
化学热力学利用热力学的基本方法、原理来研究化学变化和与化学变化有关的物理变化中能量的转化或传递的学科。
研究化学反应时,常遇到这样一些问题:当几种物质放在一起时,①它们能发生反应吗?②如果发生反应,能量如何变化?③反应是否可进行到底?④反应速率多大?⑤反应是如何进行的(反应机理)?化学热力学的研究范围:①②③属于化学热力学问题,也就是化学反应的方向、限度以及伴随的能量变化。
而④⑤属于化学动力学问题。
化学热力学的作用:☞预测反应发生的可能性及进行的方向(判据)(热力学第二定律)☞判断反应进行的限度(平衡问题)☞确定化学反应的热效应(热力学第一定律)化学热力学的局限性通过化学热力学的研究,能够比较满意地解决①②③这三个问题,但并不能够解决④⑤这两个问题,体现出化学热力学的局限性,因为:✓热力学的研究对象是宏观物体,对于个别原子、分子等微观粒子的性质是无能为力的。

高一化学必修一第二章知识点总结第二章化学反应的热力学一、热力学基础1、热力学定律热力学是研究动力学和热力过程的一门学科,総称为热力学(thermodynamics),定律是热力学最重要的理论基础,可以概括为:第一定律:能量守恒定律,即能量守恒,能量不会凭空消失,也不会凭空而产生,只能从一种形式转换到另一种形式,总量都是不变的。
第二定律:熵守恒定律,即熵守恒,工作、温度及其它能量的变化只能趋于热量流失的方向,熵值随时间的变化只会增大,不会减小。
二、热化学新计量1、热化学热热化学热定义为随着化学反应发生而产生的热量,或者说,当某一反应进行一次能量变化时,会产生固定数量的热量。
这种能量是反应发生时由吸收或放出的能量的总和,它是反应的量的,不受温度变化的影响。
2、热化学分析热化学分析是利用其来测定反应物和生成物的量,以及酸-碱反应,还原离子反应和加成反应的热量放出量,以此确定反应是否满足II定律。
热化学分析只能在室温下进行,必须先准备偏常气体,即使用实验室仪器将反应物保持在正常状态下。
三、熵变和焓变1、熵变熵变是指物质系统遵熵守恒定律发生的物理量变化所导致的物理热效应,它是指室温下反应发生时,总熵的变化量。
反应发生时,总熵会减小,反应结束时,总熵则会增加。
2、焓变焓变是由热化学热产生的热力学热量,它也可以表示物质系统在改变温度时所能吸收或释放的热量。
焓变是由热化学热产生的热力学热量,它可以表示物质系统在改变温度时所能吸收或释放的热量,它可以用热化学热试剂测定出来,也可以用热力学的方法来测定。
焓的正负也决定了反应体系的热稳定性,负焓变表示反应体系具有热稳定性,正焓变表示反应体系具有热不稳定性。
四、电离平衡电离平衡是气体介质中混合能量的变化,也是电离温度(Ionization Temperature)的概念,它是指气体介质中混合电荷的各种形式的混合能量的动态平衡,温度的变化也会影响电离平衡的状态。
电离平衡的偏移会影响气体分子间的能量交换,从而发生化学反应。


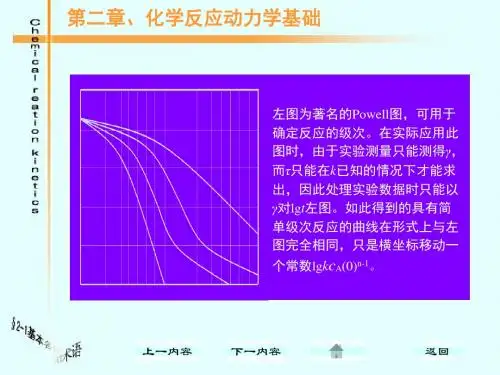
第二章化学动力学三复习题和习题解答3.1 宏观反应动力学3.1.1判断正误1. 质量作用定律只适用于基元反应。
()2. 对于平行反应,其产物浓度之比等于速率常数之比。
()3. 一般来说,活化能较大的反应对温度更敏感。
()4. 确定动力学速率方程的关键是确定反应级数。
()5. 确定反应级数的常用方法有积分法和微分法。
()6. 利用尝试法确定反应级数只适用于简单级数的反应。
()7.阿伦尼乌斯方程仅适用于基元反应。
()8. 化学反应的摩尔恒容反应热与正向反应和逆向反应的活化能有一定关系。
()9. 基元反应的分子数是个微观的概念。
()10.化学反应的反应级数与反应分子数是一回事。
()11. 化学反应的反应级数只能是正整数。
()12. 在工业上,放热的对行反应存在一个最佳反应温度。
()13. 对于酶催化反应,通常作用条件较温和。
()14. 不同级数反应的速率常数,其量纲是不一样。
()15. 不能只利用速率常数的量纲来判断反应级数。
()16. 不同级数反应的半衰期与浓度的关系是不一样的。
()17. 若某反应的半衰期与浓度无关,则该反应为零级反应。
()18. 在一级、二级和三级反应速率方程中,浓度与时间的直线关系是不同的。
()19. 化学反应动力学主要研究反应的速率与机理问题。
()20. 通常用瞬时速率表示反应速率。
()答案除7,10,11,15,17错外,其余都正确。
3.1. 2 选择题1. 基元反应的分子数是个微观的概念,其值()(a)可为0、l、2、3 (b)只能是1、2、3这三个正整数(c)也可是小于1的数值(d)可正,可负,可为零2. 化学反应的反应级数是个宏观的概念、实验的结果,其值()(a)只能是正整数(b)一定是大于1的正整数(c)可以是任意值(d)一定是小于1的负数3. 已知某反应的级数是一级,则可确定该反应一定是()(a)简单反应(b)单分子反应(c)复杂反应(d)上述都不对4. 基元反应2A→B,为双分子反应,此反应的级数()(a)可能小于2 (b)必然为1(c)可能大于2 (d)必然为25. 某反应速率常数单位是mol·l-1·s-1,该反应级数为()(a)3级 (b)2级(c)1级 (d)0级6. 某反应物反应了3/4所需时间是反应了1/2所需时间的2倍,则该反应级数为()(a) 0级 (b) 1级(c) 2级 (d) 3级7. 某反应在指定温度下,速率常数是k=4.62×10-2min-1,反应物的初始浓度为0.1mol·l-1,则该反应的半衰期为()(a) 15min (b) 30min(c) 150min (d) 不能求解8. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度的关系是()38(a) 成正比(b) 成反比(c) 平方成反比(d) 无关9. 一个反应的活化能为83.68kJ/mol,在室温27℃时,温度每升高1K,反应速率常数增加的百分数()(a) 4% (b) 90%(c) 11% (d) 50%10. 反应A + B→C + D 的速率方程r = k[A ][B ],则反应(a) 是二分子反应(b) 是二级反应,不一定是二分子反应(c) 不是二分子反应(d) 是对A、B 各为一级的二分子反应11. 有关基元反应的描述在下列诸说法中哪一个是不正确的()(a) 基元反应的反应级数一定是正整数(b) 基元反应是“态-态”反应的统计平均结果(c) 基元反应进行时无中间产物,一步完成(d) 基元反应不一定符合质量作用定律12. 下列有关反应级数的说法中,正确的是()(a) 反应级数只能是大于零的数(b) 具有简单级数的反应都是基元反应(c) 反应级数等于反应分子数(d) 反应级数不一定是正整数,如果反应物A的初始浓度减少一半,A的半衰期增大1倍,则该反13. 对于反应A P应为()(a) 零级反应(b) 一级反应(c) 二级反应(d) 三级反应14. 某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为定值,此反应是()(a)负级数反应(b)一级反应(c) 零级反应(d) 二级反应15. 某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍,则该反应的级数是()3940 (a ) 零级 (b ) 一级反应(c ) 二级反应 (d ) 三级反应16. 某反应无论反应物的起始浓度如何,完成65%反应的时间都相同,则反应的级数为( ) (a ) 零级反应 (b ) 一级反应 (c ) 二级反应 (d ) 三级反应17. 某气相化学反应用浓度表示的速率系数c k 和用压力表示的速率系数p k 相等,该反应的半衰期( )(a ) 与初始浓度无关 (b ) 与初始浓度成正比 (c ) 与初始浓度成反比 (d ) 与反应温度无关 18. 动力学研究中,任意给定的化学反应 A + B → 2D ,是( ) (a ) 表明为二级反应 (b ) 表明是双分子反应 (c ) 表示了反应的计量关系 (d ) 表明为基元反应19. 某个反应,其正反应活化能为逆反应活化能的 2 倍,反应时吸热120 kJ·mol -1,则正反应的活化能为( )(a ) 120 kJ·mol -1 (b ) 240 kJ·mol -1(c ) 360 kJ·mol -1 (d ) 60 kJ·mol -120. 对于平行反应,各反应的活化能不同,以下措施不能改变主、副产物比例的是 (a ) 提高反应温度 (b ) 延长反应时间 (c ) 加入适当的催化剂 (d ) 降低反应温度答案1 b 2 c 3 a 4 d 5 d 6 b 7 a 8 a 9 c 10 b11 d 12 d 13 c 14 c 15 b 16 b 17 a 18 c 19 b 20b3.1.3 填空题1. 质量作用定律只适于________________反应。



化学热⼒学动⼒学基础第⼆章化学热⼒学基础及化学平衡1. 有⼀活塞,其⾯积为60cm2,抵抗3atm的外压,移动了20cm,求所作的功。
(1)⽤焦⽿;(2)⽤卡来表⽰。
2. 1dm3⽓体在绝热箱中抵抗1atm的外压膨胀到10dm3。
计算:(1)此⽓体所作的功;(2)内能的变化量;(3)环境的内能变化量。
3. 压⼒为5.1atm,体积为566dm3的流体,在恒压过程中,体积减少到1/2,(1)求对流体所作的功(2)求流体的内能减少365.75kJ时,流体失去的热量?4. 在⼀汽缸中,放⼊100g的⽓体。
此⽓体由于压缩,接受了2940kJ的功,向外界放出了2.09kJ的热量。
试计算每千克这样的⽓体内能的增加量。
5. 在1atm、100℃时,⽔的摩尔汽化热为40.67kJ?mol-1,求:1mol⽔蒸汽和⽔的内能差?(在此温度和压⼒下,⽔蒸汽的摩尔体积取作29.7dm3)6. 某体系吸收了3.71kJ的热量,向外部作了1.2kJ的功,求体系内部能量的变化。
7. 某体系作绝热变化,向外部作了41.16kJ的功,求此体系内能的变化量。
8. 有⼀⽓体,抵抗2atm的外压从10dm3膨胀到20dm3,吸收了1254J的热量,求此⽓体的内能变化?9. ⼀理想⽓体在恒定的⼀⼤⽓压下,从10dm3膨胀到16dm3,同时吸热125.4J的热量,计算此过程的?U和?H。
10. 在300K时3mol的理想⽓体等温膨胀,它的内压为8atm,抵抗2atm的恒压⼒作功,体积增加到4倍,试求W、Q、?U和? H。
11. 现有2dm3氮⽓在0℃及5atm下抵抗1atm的恒外压作等温膨胀,其最后的压⼒为1atm,假设氮⽓为理想⽓体,求此过程的W、?U、?H及Q。
12. 在1atm下,2molH2和1molO2反应,在100℃和1atm下⽣成2mol⽔蒸汽,总共放出了115.8kJ?mol-1热量。
求⽣成每摩尔H2O(g)时的?H和?U。


人教版化学选修1-2知识点总结
本文对于人教版化学选修1-2的知识点进行了总结,以下是各章节的内容概括:
第一章无机化学基础
介绍了化学的基本概念,原子结构和元素周期律等理论知识。
阐述了化学键的种类和化学反应的基本概念,重点介绍了氧化还原反应和酸碱反应。
第二章化学热力学
介绍了化学热力学的基本概念,如焓、熵、自由能等。
讲解了热力学第一定律和第二定律,解释了化学反应热和热平衡等概念。
第三章化学平衡
介绍了化学平衡的基本概念和化学平衡条件,讲解了化学平衡
常数及其影响因素,包括温度、压力和浓度的变化对化学平衡的影响。
第四章氧化还原反应
深入介绍了氧化还原反应的基本概念和电化学的相关内容,包
括标准电极电位、电动势和电解等内容。
第五章化学动力学
介绍了化学动力学的基本概念和速率方程,以及速率常数和反
应级数等概念,讲解了影响化学反应速率的因素,包括浓度、温度、催化剂等。
第六章化学实验
讲解了常见的化学实验技术,包括物质的分离和纯化、物质的
鉴别和检验、化学计量和化学反应等实验内容,重点介绍了气体的
收集和消耗实验。
第七章高分子材料
介绍了常见的高分子材料,如合成树脂和塑料等,以及塑料的制备和应用领域,探讨了高分子材料与人们日常生活的关系。
第八章化学与能源问题
介绍了化学在能源领域的应用,包括化石燃料的开发和利用、核能和可再生能源的利用等,讨论了化学在能源领域的作用和未来发展前景。
本文列出了各章节的内容概括,供学习化学选修1-2的同学参考,希望本文对大家有所帮助。
第⼆章化学热⼒学和化学动⼒学基础第⼆章化学热⼒学和化学动⼒学基础⼀、选择题1、下列叙述中正确的是()A.反应物的转化率不随起始浓度⽽变;B.⼀种反应物的转化率随另⼀种反应物的起始浓度⽽变;C.平衡常数不随温度变化;D.平衡常数随起始浓度不同⽽变化。
2、化合物A有三种⽔合物,它们的脱⽔反应的Kp分别为A·3H2O(s)= A·2H2O(s)+ H2O(g)Kp1A·2H2O(s)= A·H2O(s)+ H2O(g)Kp2A·H2O(s)= A(s)+ H2O(g)Kp3为使A·2H2O晶体保持稳定(不风化也不潮解),容器中⽔蒸⽓压⼒P H2O应为()。
A. P H2O> Kp1B. P H2O必须恰好等于Kp1C. P H2O必须恰好等于Kp2D.Kp1 > P H2O> Kp23、已知2H2(g)+ S2(g)= 2H2S(g)Kp12Br2(g)+ 2H2S(g)= 4HBr(g)+ S2(g)Kp2H2(g)+ Br2(g)= 2HBr(g)Kp3则Kp3等于()。
A.(Kp1/ Kp2)1/2B.(Kp1·Kp2)1/2C. Kp2/ Kp1D. Kp1·Kp24、催化剂能使化学反应速度加快,是因为它:()A.增⼤了K?值B.增⼤了反应的活化能C.降低了反应的活化能D.增⼤了反应物的浓度5、可逆反应:A(g)+B2(g)AB2(g),当其它条件不变,增加B的分压时,下列各项增⼤的是()A.正反应速率常数B.逆反应速率常数C.正反应速率D.化学平衡常数6、已知298.15K时,ΔbHm?(H-H)=436kJ/mol,ΔbHm?(F-F)=158kJ/mol,ΔbHm?(H-F)=566kJ/mol,则反应H2 + F2 = 2HF的ΔrHm?为()A.538kJ/molB.-538kJ/molC.28kJ/molD.-28kJ/mol>0,达平衡后,若使平衡向右移动7、已知反应C(s)+H可采取的办法是()A.升⾼温度B.增加压⼒C.加⼊催化剂D.恒温恒容下引⼊⽆关⽓体8、⽔在100℃,1P?下变为⽔蒸汽的ΔH、ΔS、ΔG的情况为()A.ΔS<0,ΔH>0,ΔG=0B.ΔS>0,ΔH>0,ΔG=0C.ΔS>0,ΔH>0, ΔG>0D.ΔS>0,ΔH<0,ΔG<09、某温度下,反应CO(g)+H2O(g) CO2(g)+H2(g)达平衡时,ΔH为负值,要提⾼CO的转化率,可采取的⽅法是()A.加⼤总压⼒B.减⼩总压⼒C.使⽤催化剂D.降低温度10、常温常压下,NH4Cl(s)吸热分解为NH3⽓体和HCl⽓体,其反应的ΔH、ΔS、ΔG应为()A.ΔS<0,ΔH<0,ΔG<0B.ΔS>0,ΔH>0,ΔG<0C.ΔS>0,ΔH>0,ΔG>0D.ΔS>0,ΔH<0,ΔG<011、C(s)+O2(g)=CO2(g), ΔH1=-393.5kJ/mol;C(s)+1/2O2(g)=CO(g), ΔH2=-110.5kJ/mol ;则CO(g) +1/2O2(g) =CO2(g)的反应热ΔH3为( )A.-514.0 kJ/molB.283.0 kJ/molC.-283.0kJ/mol12、某温度下,反应H2(g)+Br2(g)2HBr(g)的平衡常数Kp= 4.0×10-2,则反应HBr(g)1/2H2(g)+1/2Br2(g) 平衡常数Kp=()A.1/(4×10-2)B. 0.5×4×10-2C. 1/(4×10-2)1/2D. (4×10-2)1/213、反应:2H2O(l) 2H2(g)+O2(g), ΔH?=571.8kJ/mol, 则ΔHf?H2O(l)=( )A,285.9kJ/mol B.571.8 kJ/mol C.-571.8 kJ/mol D.-285.9 kJ/mol14、在放热反应中,温度增⾼10℃将会()A.不影响反应B.使平衡常数增加C.降低平衡常数D.不改变反应速度15、有助于反应3O22O3△rHm=69000 cal(1caL = 4.1868J)进⾏的条件是()A.⾼温和⾼压B.⾼温和低压C.低温和⾼压D.多加臭氧16、密闭容器中的反应4NH3(g)+ 5O2(g)4NO(g)+ 6H2O(g),在此平衡体系中加⼊惰性⽓体以增加系统的压⼒,这时()A.NO平衡浓度增加B. NO平衡浓度减少C.加快正反应速度D. 平衡时NH3和NO的量并没有变化17、在绝对温度T时,某⼀反应的吉布斯⾃由能变是△G,焓变是△H,则该反应的熵变△S 是:()A. (△G-△H)/TB. (△H-△G)/TC. T(△G-△H)D. T(△H-△G)18、某基元反应2A(g)+B(g)=C(g),将2moL A(g)和1moL B(g)放在1L容器中混合,问A与B开始反应的速率是A、B都消耗⼀半时速率的⼏倍()A. 0.25B. 4C. 8D. 相等19、当⼀个反应的速率常数k的⾃然对数与绝对温度的倒数作图时,直接影响直线斜率的因素是()。