淀粉酶活性研究
- 格式:docx
- 大小:17.86 KB
- 文档页数:4

实验四、淀粉酶活性的测定一、实验目的:1、了解α - 淀粉酶和β - 淀粉酶的不同性质及其淀粉酶活性测定的意义;2、学会比色法测定淀粉酶活性的原理及操作要点。
二、实验原理:淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。
根据α-淀粉酶和β-淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化;β-淀粉酶不耐热,70℃ 15min 则被钝化。
测定时,使其中一种酶失活,即可测出另一种酶的活性。
淀粉在淀粉酶的催化作用下可生成麦芽糖,利用麦芽糖的还原性与3,5-二硝基水杨酸反应生成棕色的3-氨基-5-硝基水杨酸,测定其吸光度,从而确定酶液中淀粉酶活力(单位重量样品在一定时间内生成麦芽糖的量)。
三、实验用具:1、实验设备研钵,具塞刻度试管,离心管,分光光度计,酸度计,电热恒温水浴锅,离心机,电磁炉。
2、实验材料与试剂(1)0.1mol/l pH5.6的柠檬酸缓冲液:A液:称取柠檬酸20.01g,定容至1000ml;B液:称取柠檬酸钠29.41g,定容至1000ml;取A液55ml与B液145ml混匀。
(2)1%可溶性淀粉溶液:1g淀粉溶于100ml 0.1mol/l pH5.6的柠檬酸缓冲液;(3)1%3,5-二硝基水杨酸试剂:称取3,5-二硝基水杨酸1g、NaOH 1.6g、酒石酸钾钠30g,定容至100ml水中,紧盖瓶塞,勿使CO2进入;(4)麦芽糖标准溶液:取麦芽糖0.1g溶于100ml水中;(5)pH 6.8的磷酸缓冲液:取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8,加水稀释至1000ml即得。
(6)0.4mol/L的NaOH溶液;(7)1%NaCl溶液。
(8)实验材料:萌发的谷物种子(芽长约1cm)四、操作步骤1、酶液提取:取6.0g浸泡好的原料,去皮后加入10.0mL 1%的NaCl 溶液,磨碎后以2000r/min 离心10min,转出上清液备用。

淀粉酶活力的测定方法淀粉酶是一种能够降解淀粉的酶类。
测定淀粉酶活力的方法主要有光密度法、滴定法、浊度法、电极法等。
下面将详细介绍这几种方法。
一、光密度法光密度法是利用淀粉酶在一定温度和pH值条件下降解淀粉产生的葡萄糖,与p-二硫化苯胺生成的被称为多脱氧萘酚蓝的有色物质在特定波长下的吸光度变化来测定淀粉酶活力。
测定步骤:1. 准备试剂:液体缓冲液、淀粉溶液、pH 7.0缓冲液、2%~4%淀粉溶液、0.1% p-二硫化苯胺、1%酶液。
2. 在试管中加入2 mL pH 7.0缓冲液、2 mL 2%~4%淀粉溶液和1 mL 酶液,置于37恒温槽中培养10分钟。
3. 取出试管后,立即加入5 mL p-二硫化苯胺试剂和1 mL液体缓冲液,混匀后,放置15分钟使产生的多脱氧萘酚蓝发色充分。
4. 测定吸光度:使用特定波长的光源(通常为540 nm)对反应液进行吸光度测定。
5. 用纯水代替酶液重复上述步骤,结果作为对照组。
6. 计算淀粉酶活力:对照组的吸光度减去实验组的吸光度,乘以吸光度系数K (由标准淀粉酶活力校准得出),即可得出淀粉酶的活力。
二、滴定法滴定法是通过滴定试剂滴定淀粉酶产生的葡萄糖来测定淀粉酶活力的方法。
测定步骤:1. 准备试剂:碘滴定剂(0.02 mol/L碘酸钾,0.2 mol/L硫酸),0.1 mol/L氢氧化钠溶液,0.1%淀粉溶液。
2. 取一定量的淀粉酶加入试管中。
3. 预热培养:将试管放置于37水浴中预热,约5分钟。
4. 添加滴定剂:将试管中的淀粉加入10 mL淀粉溶液中,迅速搅拌。
5. 滴定:在反应时加入少量滴定剂,然后滴定到反应性红色消失的那一点为止。
6. 计算淀粉酶活力:滴定所使用的硫酸溶液的体积与滴定所使用的碘滴定剂的体积之间的比值即为滴定效价,根据滴定效价计算淀粉酶的活力。
三、浊度法浊度法是通过测定淀粉酶降解淀粉导致溶液浑浊度变化来测定淀粉酶活力的方法。
测定步骤:1. 准备试剂:0.1 mol/L淀粉溶液,0.1 mol/L缓冲液,1%淀粉酶溶液。

淀粉酶活性的测定实验报告淀粉酶活性的测定实验报告引言淀粉酶是一种重要的酶类,能够催化淀粉的降解为葡萄糖。
淀粉酶活性的测定对于了解酶的特性以及其在生物化学过程中的作用具有重要意义。
本实验旨在通过测定淀粉酶的活性,探究其受到不同因素的影响,为进一步研究酶的功能提供基础数据。
材料与方法1. 实验材料:淀粉酶溶液、淀粉溶液、缓冲液、I2-KI试剂、洗涤液。
2. 实验仪器:比色皿、移液管、离心机、恒温水浴。
实验步骤:1. 预热水浴至37°C。
2. 准备不同浓度的淀粉溶液(0.2%、0.4%、0.6%、0.8%、1.0%),并分别加入比色皿中。
3. 向每个比色皿中加入相同体积的淀粉酶溶液,混匀后立即放入预热的水浴中。
4. 在反应开始后的不同时间点(如0、5、10、15、20分钟),取出一个比色皿,立即加入I2-KI试剂,形成蓝色淀粉-碘复合物。
5. 使用比色计测定各比色皿中的吸光度,并记录下实验数据。
6. 重复实验步骤2-5,以获得可靠的结果。
结果与讨论通过实验测定得到各个时间点下不同淀粉浓度的吸光度值,进而计算出淀粉酶的活性。
实验结果显示,随着淀粉浓度的增加,淀粉酶的活性也随之增加。
这是因为淀粉浓度的增加会提供更多的底物供淀粉酶催化反应,从而增加反应速率。
然而,当淀粉浓度超过一定范围时,淀粉酶的活性开始饱和,即使再增加淀粉浓度,反应速率也不再显著增加。
此外,实验结果还显示,随着反应时间的增加,淀粉酶的活性逐渐增加,但增加速率逐渐减缓。
这是因为淀粉酶需要一定的时间来结合底物,并催化反应发生。
随着反应进行,底物逐渐减少,淀粉酶与底物的结合也变得更加困难,从而导致反应速率的下降。
此外,实验还可以探究其他因素对淀粉酶活性的影响,如温度、pH值等。
通过调节这些因素,可以进一步了解淀粉酶的特性以及其在生物体内的作用机制。
结论通过本实验的测定,我们得出了淀粉酶活性与淀粉浓度和反应时间的关系。
实验结果表明,淀粉酶活性随着淀粉浓度的增加而增加,并随着反应时间的增加而逐渐饱和。
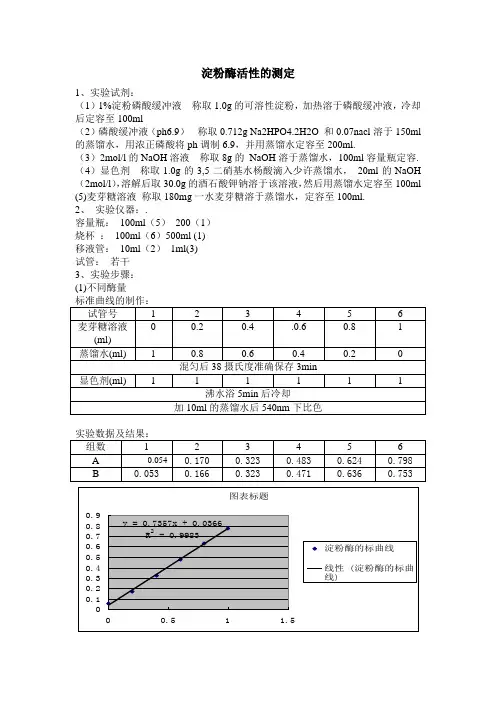
淀粉酶活性的测定
1、实验试剂:
(1)1%淀粉磷酸缓冲液称取1.0g的可溶性淀粉,加热溶于磷酸缓冲液,冷却后定容至100ml
(2)磷酸缓冲液(ph6.9)称取0.712g Na2HPO4.2H2O 和0.07nacl溶于150ml 的蒸馏水,用浓正磷酸将ph调制6.9,并用蒸馏水定容至200ml.
(3)2mol/l的NaOH溶液称取8g的NaOH溶于蒸馏水,100ml容量瓶定容. (4)显色剂称取1.0g的3,5二硝基水杨酸滴入少许蒸馏水,20ml的NaOH (2mol/l),溶解后取30.0g的酒石酸钾钠溶于该溶液,然后用蒸馏水定容至100ml (5)麦芽糖溶液称取180mg一水麦芽糖溶于蒸馏水,定容至100ml.
2、实验仪器:.
容量瓶:100ml(5)200(1)
烧杯:100ml(6)500ml (1)
移液管:10ml(2)1ml(3)
试管:若干
3、实验步骤:
(1)不同酶量
(2)平行实验(酶量30ul)。

淀粉酶活性测定实验报告淀粉酶活性测定实验报告引言:淀粉酶是一种重要的酶类,它在生物体内起着关键的消化和代谢作用。
淀粉酶能够将淀粉降解为较小的分子,以供生物体吸收和利用。
因此,测定淀粉酶的活性对于了解生物体的消化系统以及酶的功能机制具有重要意义。
本实验旨在通过测定淀粉酶的活性,探究其在不同条件下的变化规律,从而加深对淀粉酶的认识。
材料与方法:1. 实验器材:试管、移液管、恒温水浴、分光光度计。
2. 实验试剂:淀粉溶液、淀粉酶溶液、碘液、磷酸盐缓冲液。
3. 实验步骤:a. 准备一系列稀释淀粉酶溶液,分别为0.1、0.2、0.3、0.4、0.5 mg/mL。
b. 取一定量的淀粉溶液置于试管中,加入相应浓度的淀粉酶溶液,混匀。
c. 将试管置于恒温水浴中,保持温度在37°C,反应10分钟。
d. 在反应结束后,加入适量的磷酸盐缓冲液停止反应。
e. 加入适量的碘液,使溶液变为蓝黑色。
f. 使用分光光度计测定溶液的吸光度,记录下吸光度值。
g. 重复以上步骤,分别测定其他浓度的淀粉酶溶液。
结果与讨论:通过实验测定,我们得到了不同浓度淀粉酶溶液的吸光度值,并以吸光度值作为淀粉酶活性的指标。
根据实验结果,我们可以得出以下结论:1. 淀粉酶活性与浓度呈正相关关系:实验结果显示,随着淀粉酶溶液浓度的增加,吸光度值也随之增加。
这表明淀粉酶的活性与其浓度呈正相关关系。
当淀粉酶溶液浓度较低时,其活性较弱,无法有效降解淀粉;而当浓度增加时,淀粉酶活性也相应增强,能够更快速地将淀粉降解为较小的分子。
2. 淀粉酶活性受温度影响较大:实验中将反应温度保持在37°C,这是因为淀粉酶在人体内的最适温度为37°C。
然而,当温度偏离最适温度时,淀粉酶的活性会受到显著影响。
过高或过低的温度都会导致淀粉酶的构象变化,从而影响其催化效率。
因此,合适的温度对于淀粉酶的活性至关重要。
3. 淀粉酶活性受pH值影响:酶活性与pH值之间存在一定的关系。

唾液淀粉酶活性的观察实验报告范文3篇An experimental report on salivary amylase activity唾液淀粉酶活性的观察实验报告范文3篇小泰温馨提示:实验报告是把实验的目的、方法、过程、结果等记录下来,经过整理,写成的书面汇报。
本文档根据实验报告内容要求展开说明,具有实践指导意义,便于学习和使用,本文下载后内容可随意修改调整及打印。
本文简要目录如下:【下载该文档后使用Word打开,按住键盘Ctrl键且鼠标单击目录内容即可跳转到对应篇章】1、篇章1:唾液淀粉酶活性观察实验报告文档2、篇章2:唾液淀粉酶活性的测定文档3、篇章3:淀粉酶活性测定实验报告文档篇章1:唾液淀粉酶活性观察实验报告文档2 唾液淀粉酶活性观察实验报告一、实验目的1.了解环境因素对酶活性的影响及酶的高效性;2.掌握酶定性分析的方法和注意事项。
二、基本原理1.酶是生物催化剂,具有极高的催化效率,其催化效率比一般催化剂高106~1013.在生物体内过氧化氢酶能催化H2O2分解成H2O和O2,铁粉地H2O2分解也有催化作用,但其效率远低于酶。
2.酶的活性受温度的影响。
在一定的温度范围内,温度升高,酶的活性也会增大。
当到了最大值后,此时温度为酶的最适温度,由于温度过高,酶开始失活,导致酶的效率降低,最后完全失活。
3.酶的活性受PH值的影响。
酶在一定范围的PH值下才有活性,高于或低于最适PH,都会使酶的活性降低。
4.酶活性常受到某些物质的影响。
有些物质能使酶的活性增加,称为激活剂,有些物质能使酶的活性降低,称为抵制剂。
5.碘液指示淀粉水解程度的不同色变化:淀粉淀粉酶紫色糊精淀粉酶暗褐糊精淀粉酶红色糊精淀粉酶麦芽糖+少量葡萄糖加碘后:蓝色紫红色暗褐色红棕色黄色三、试剂与器材篇章2:唾液淀粉酶活性的测定文档【按住Ctrl键点此返回目录】影响唾液淀粉酶活性的研究摘要:讨论了不同条件下唾液淀粉酶的活性差异,实验结果表明,影响唾液淀粉酶活性的因素很多,必须在适宜的条件下,才能发挥最佳催化作用;淀粉酶具有高度专一性,其活性受温度、pH值、激活剂及抑制剂、酶浓度以及作用时间等多种因素的影响;每个人产生唾液淀粉酶的量不同,活性强弱也有差异。

检测淀粉酶活性的方法
淀粉酶活性可以使用多种方法来检测,常用的有以下几种:
1.比色法:使用酶活性与颜色变化有关的试剂,如
比色剂,来检测淀粉酶活性。
2.电位检测法:使用电位计来直接测量酶酶解淀粉
过程中产生的电流。
3.磷酸酶试剂盒法:使用含有磷酸的试剂盒,在酶
解淀粉过程中产生的磷酸可以通过酶解磷酸酶来酶消耗,由此反映淀粉酶活性。
4.放射性检测法: 淀粉酶将淀粉分解成葡萄糖,葡
萄糖可以通过磷酸甘油酶合成磷酸甘油,这种合成过程中产生的14C碳可以通过放射性计数来检测淀粉酶活性。
这些方法都有其特点和适用范围,需要根据实验需求来选择最合适的方法。
1.比色法是最常见的检测淀粉酶活性的方法之一,
它通过酶解淀粉产生的葡萄糖或其他物质的颜色变化来检测淀粉酶活性。
常用的比色剂有银离子试剂、染料试剂等。
2.电位检测法是一种直接测量淀粉酶活性的方法,
它通过测量酶解淀粉产生的电流来检测淀粉酶活性。
3.磷酸酶试剂盒法是通过检测淀粉酶酶解淀粉产生
磷酸,再由磷酸酶进行消耗来反映淀粉酶活性。
4.放射性检测法是一种特殊的检测方法,它使用含
有放射性碳的淀粉或磷酸甘油试剂,通过检测放射性碳的计数变化来检测淀粉酶活性。
这些方法都有其优缺点,选择其中一种方法需要根据实验需求和条件来确定,如实验灵敏度、试剂成本、操作难度等因素。

实验七 淀粉酶活性的测定一、目的淀粉酶是水解淀粉的糖苷键的一类酶的总称,按照其水解淀粉的作用方式,可以分成a淀粉酶,b淀粉酶等。
a淀粉酶和b淀粉酶是其中最主要的两种,存在于禾谷类的种子中。
b淀粉酶存在于休眠的种子中,而a淀粉酶是在种子萌发过程中形成的,本实验的目的在于 掌握这两种酶的提取和测定方法。
二、原理a淀粉酶和b淀粉酶,各有其一定的特性,如b淀粉酶b淀粉酶不耐热,在高温下易钝 化,而a淀粉酶不耐酸,在 pH 3.6 以下则发生钝化,在萌发种子的提取液中,这两种淀粉 酶同时存在。
可利用这两种酶的不同特性加以处理,钝化其一,即可测定另一种酶的活性。
测定a淀粉酶活性时,可将提取液加热到 70℃维持 15 分钟以钝化b淀粉酶,而测定b淀粉 酶时,可用 pH 3.6的醋酸缓冲液处理提取液,以钝化a淀粉酶。
淀粉酶水解淀粉生成的麦芽糖,可用 3, 5二硝基水扬酸试剂测定,由于麦芽糖能将后 者还原生成硝基氨基水扬酸的显色基团, 其颜色的深浅与糖的含量成正比, 故可求出麦芽糖 的含量。
常用单位时间内生成麦芽糖的毫克数表示淀粉酶活性的大小。
在实验中要严格控制温度及时间,以减小误差。
并且在酶的作用过程中,四支测定管及 空白管不要混淆。
三、实验材料、仪器和试剂1.实验材料萌发的小麦种子(芽长 1 厘米左右)2.仪器(1)小台秤(2)研钵(3)容量瓶:50ml ´1, 100ml´1(4)具塞刻度试管:15ml ´6(5)试管:8 支(6)刻度吸管:1ml,2ml,10ml(7)离心机(8)恒温水浴(9)分光光度计3.试剂(1) 1%淀粉溶液, 称取1克可溶性淀粉, 加入80ml左右蒸馏水, 在电炉上加热溶解, 等 冷却后, 定容到 100ml。

淀粉酶活性测定淀粉酶是一种非常重要的酶类,是一种负责水解淀粉质的消化酶。
淀粉酶活性测定可以用于评价淀粉酶的水解能力和功能,有助于监测动物体内的淀粉酶活性水平,以及在食品、农业、医学等方面的应用。
在此文中,我们将详细介绍淀粉酶活性测定的方法、原理、重要性等相关知识。
1、Iodine-starch法此方法是基于淀粉直接加热与淀粉酶水解后不同的化学反应。
淀粉水解后的葡萄糖分子,会使加入碘化钾后的淀粉溶液变成淡黄色或透明状态,因而用这种方法来测定淀粉酶活性。
操作步骤:(1)将淀粉溶液分配到不同的试管中,并分别加入一定量的淀粉酶和缓冲液;(2)将试管随之放入水浴器中,在一定的温度下反应一定时间后;(3)将反应好的样品加入适量的碘化钾溶液,混合均匀;(4)观察样品颜色的变化与对照样品进行比较。
淀粉酶活性越强,颜色变化越明显。
2、DNS法(3,5-dinitrosalicylic acid)此法是由3,5-二硝基水杨酸和淀粉水解后形成的糖类反应,也是一种将淀粉水解后产生的葡萄糖利用于测定淀粉酶活性的方法。
(3)在沸水中进行加热封闭处理,使淀粉酶反应后产生的糖分子与DNS反应生成产物,颜色变化呈红色。
淀粉直接加热会发生硫酸化反应,而加入淀粉酶水解后,形成的产物降解了银离子和碘化物的复合物,导致样品中碘的浓度下降,进而改变样品的颜色。
2、DNS法淀粉酶活性水平是衡量动物消化能力的重要指标之一,同时,则涉及到食品、中药、农业等领域相关工作的研究。
用于测定淀粉酶活性,在动物营养研究和饲料生产中具有广泛的应用。
在动物营养领域中,淀粉酶活性测定可以用来评价不同饲料淀粉的消化能力和饲料营养价值,甚至可以评价不同品种和不同饲料来源的淀粉酶活性差异。
在饲料生产方面,淀粉酶活性测定有助于优化饲料制造流程和配方,从而提高生产效率和经济效益。
此外,在工业领域,淀粉酶的活性测定也具有重要的应用价值。
例如,在酿酒过程中,淀粉酶活性的测定可以使发酵操作更加稳定和高效。

实验24淀粉酶活性的测定植物中的淀粉酶能将贮藏的淀粉水解成麦芽糖。
淀粉酶几乎存在于所有植物中,其中以禾谷类种子的淀粉酶活性最强。
植物中有α–淀粉酶和β–淀粉酶,其活性因植物的生长发育时期不同而有所变化。
通过本实验掌握淀粉酶的提取和测定方法。
一、原理α–淀粉酶和β–淀粉酶,各有其一定的特性,如β–淀粉酶不耐热,在高温下易钝化,而α–淀粉酶不耐酸,在 pH3.6 以下则发生钝化。
通常提取液中同时有两种淀粉酶存在,测定时,可根据它们的特性分别加以处理,钝化其中之一,即可测出另一酶的活性。
将提取液加热到70 ℃维持 15 min 以钝化β–淀粉酶,便可测定α–淀粉酶的活性。
或者将提取液用pH3.6 之醋酸在0 ℃加以处理,钝化α–淀粉酶,以求出β–淀粉酶的活性。
淀粉酶水解淀粉生成的麦芽糖,可用 3 , 5 –二硝基水杨酸试剂测定。
由于麦芽糖能将后者还原生成 3 –氨基–5 –硝基水杨酸的显色基团,在一定范围内其颜色的深浅与糖的浓度成正比,故可求出麦芽糖的含量。
以单位重量样品在一定时间内生成的麦芽糖的量表示酶活力。
二、实验材料、试剂与仪器设备(一)实验材料萌发的小麦(芽长 1 cm 左右)。
(二)试剂1. 1 %淀粉:称取 1.0g 淀粉溶于 100mL 0.1mol/L pH 5.6 的柠檬酸缓冲液中。
2. 0.1mol/L pH5.6 的柠檬酸缓冲液: A 液:称取柠檬酸 20.01 g ,溶解后稀释至 l000 mL ;B 液:称取柠檬酸钠 29.41 g ,溶解后稀释至 1000 mL 。
取 A 液 55 mL 与 B 液 145 mL 混匀,即为 pH5.6 之缓冲液。
3. 3, 5 –二硝基水杨酸溶液:精确称取 3, 5 –二硝基水杨酸 1 g 溶于 20 mL 2 mol/L 氢氧化钠中,加入 50 mL 蒸馏水,再加入 30 g 酒石酸钾钠,待溶解后,用蒸馏水稀释至 100 mL ,盖紧瓶塞,勿使二氧化碳进入。

一、实验目的1. 了解淀粉酶的生物学特性及其在生物体内的作用。
2. 掌握淀粉酶活性的测定方法。
3. 分析淀粉酶活性受温度、pH值等因素的影响。
二、实验原理淀粉酶是一种水解淀粉的酶,可以将淀粉分解为麦芽糖和葡萄糖。
淀粉酶活性是指单位时间内淀粉酶催化淀粉分解的速率。
本实验采用DNS法测定淀粉酶活性,DNS 法是一种灵敏、准确、精确度高的测定方法,适用于测定小样品淀粉酶活性。
三、实验材料与仪器1. 实验材料:淀粉酶、淀粉、DNS试剂、标准葡萄糖溶液、pH缓冲液、蒸馏水、试管、恒温水浴锅、移液器、量筒、滴定管等。
2. 实验仪器:pH计、电子天平、电子显微镜、分光光度计等。
四、实验步骤1. 配制淀粉酶溶液:称取适量淀粉酶,用蒸馏水溶解,配制成一定浓度的淀粉酶溶液。
2. 配制淀粉溶液:称取适量淀粉,用蒸馏水溶解,配制成一定浓度的淀粉溶液。
3. 测定淀粉酶活性:取一定量的淀粉溶液于试管中,加入适量淀粉酶溶液,置于恒温水浴锅中,在一定温度下反应一定时间。
4. 测定DNS反应液:取一定量的反应液,加入DNS试剂,置于沸水浴中反应一定时间。
5. 比色:用分光光度计在特定波长下测定DNS反应液的吸光度。
6. 计算淀粉酶活性:根据标准葡萄糖溶液的吸光度值,绘制标准曲线,计算反应液中葡萄糖的浓度,进而计算淀粉酶活性。
五、结果与分析1. 淀粉酶活性随温度升高而增加,在一定温度范围内达到最大值,之后随温度升高而降低。
2. 淀粉酶活性随pH值升高而增加,在一定pH范围内达到最大值,之后随pH值升高而降低。
3. 淀粉酶活性受激活剂和抑制剂的影响,其中激活剂可以增强淀粉酶活性,抑制剂可以抑制淀粉酶活性。
六、实验结论1. 淀粉酶是一种水解淀粉的酶,在生物体内具有重要作用。
2. DNS法是一种灵敏、准确、精确度高的测定淀粉酶活性的方法。
3. 淀粉酶活性受温度、pH值、激活剂和抑制剂等因素的影响。
七、实验讨论1. 实验过程中,淀粉酶溶液和淀粉溶液的浓度对实验结果有较大影响,需要严格控制浓度。
测定淀粉酶活性的两种方法的比较研究一、简述淀粉酶是一种能够催化淀粉分解为糖类物质的生物催化剂,其在食品工业、生物塑料生产以及医药等领域具有广泛的应用价值。
为了更好地了解和评估淀粉酶的活性,本研究将比较分析两种常用的测定淀粉酶活性的方法:碘量法和比浊法。
该方法系通过加入碘与淀粉样液来测量淀粉的水解程度,但是它无法避免一些还原性物质的干扰。
比浊法是基于酶反应产生胶体体系的形成,据此原理可测定淀粉酶活力。
本实验旨在比较这两种方法在测定淀粉酶活性时的优缺点,并分析其可能的原因,以期找到一种更为理想和高效的测定手段。
1. 淀粉酶的简介及重要性淀粉酶是一种能够催化淀粉分解为糖类物质的生物催化剂,它在食品工业、发酵工业以及生物塑料工业等领域具有广泛的应用。
淀粉酶的活性是衡量其性能的重要指标,催化效率越好。
研究淀粉酶活性的方法对于这些行业的发展具有重要意义。
淀粉酶在食品工业中扮演着关键角色。
在制作面条、饼干等食品时,需要确保食品中的淀粉得到充分分解,从而提高食品的口感和品质。
淀粉酶能够有效分解淀粉,使其转化为糖类物质,为食品提供甜味和黏性,因此它是食品工业中不可或缺的酶制剂。
淀粉酶在发酵工业中也有重要应用。
发酵工程中常用的糖化酶就是一种淀粉酶,它能够将淀粉转化为葡萄糖,为微生物提供能量和生长所需的碳源。
通过使用不同类型的淀粉酶,可以对不同种类的微生物进行定向发酵,生产出各种有用的产品,如抗生素、酶制剂等。
淀粉酶在生物塑料工业中也有潜在的应用前景。
生物可降解塑料是一种环保型的生物塑料,其降解过程需要淀粉酶的参与。
通过利用淀粉酶降解塑料中的淀粉成分,可以降低塑料对环境的污染,为实现可持续发展提供新的途径。
淀粉酶在各个领域都具有重要的应用价值。
研究淀粉酶活性的方法,对于推动相关领域的技术进步和产业发展具有重要意义。
2. 淀粉酶活性测定的方法和目的在淀粉酶活性的研究中,有多种方法可用于测定酶活力。
本部分将详细介绍两种常见的淀粉酶活性测定方法:碘量法和比色法,并阐述它们的目的。
探究影响酶活性的因素实验报告一、实验介绍本次实验是为了探究影响酶活性的因素,以淀粉酶为对象进行研究。
淀粉酶是一种消化淀粉的酶,分泌于胰腺和口腔两个部位。
在口腔中,淀粉酶可以分解淀粉质为葡萄糖,并改善口腔健康。
实验中我们分别以不同的酶液浓度、pH值、温度等参数对淀粉酶酶活进行观察和测量,以期研究影响酶活性的因素。
二、实验方法1、制备淀粉酶酶液将5g淀粉酶粉末加入100mL色谱纯水中,60℃加热,搅拌溶解,待完全溶解并滤除杂质后使用。
2、制备淀粉溶液将10g淀粉粉末加入100mL色谱纯水中,50℃加热,搅拌溶解,待淀粉完全溶解后,加入色谱纯水稀释至1L,即制备出淀粉溶液。
3、制备不同酶液浓度将50mL淀粉酶液分别加入50mL、40mL、30mL、20mL、10mL色谱纯水中,并标记为50倍、40倍、30倍、20倍、10倍浓度的酶液。
4、测量酶活性分别取1mL不同浓度的淀粉酶液加入试管中,再加入4mL 淀粉溶液,以50℃加热,10min后停止反应。
后加入硫酸钠溶液,恒定时间后使用紫外分光光度计测定程序中指定波长下的吸光度值(A值),以此计算出淀粉酶活性。
5、探究影响酶活性的因素- 不同浓度淀粉酶液测量酶活性- 在不同pH值下测量淀粉酶酶活性,分别以pH4、pH5、pH6、pH7、pH8、pH9为条件进行实验。
- 在不同温度下测量淀粉酶酶活性,分别以10℃、20℃、30℃、40℃、50℃、60℃为条件进行实验。
实验条件:使用同一批淀粉酶液和淀粉溶液,保证实验条件一致。
三、实验结果1、不同浓度淀粉酶液测量酶活性浓度(倍)A490值酶活性50 1.03 281.139U/mL 40 0.88 240.681U/mL 30 0.69188.493U/mL 20 0.44 119.865U/mL 10 0.18 49.180U/mL2、在不同pH值下测量淀粉酶酶活性pH值A490值酶活性4 0.58 158.470U/mL5 1.01 275.099U/mL6 1.12305.458U/mL 7 1.26 342.466U/mL 8 0.86 234.426U/mL 9 0.62 168.904U/mL3、在不同温度下测量淀粉酶酶活性温度(℃)A490值酶活性10 0.18 49.180U/mL 20 0.53 144.503U/mL 30 0.93253.924U/mL 40 1.23 334.852U/mL 50 1.42 386.578U/mL 60 1.26 342.466U/mL四、实验分析根据实验结果可以得出如下结论:1、淀粉酶酶活受浓度影响的趋势为:酶活性随着浓度的升高而增加,且不同浓度之间的酶活性有明显差异,浓度越高,酶活性越大。
实验七淀粉酶活性的测定一、研究背景及目的酶是高效催化有机体新陈代谢各步反应的活性蛋白,几乎所有的生化反应都离不开酶的催化,所以酶在生物体内扮演着极其重要的角色,因此对酶的研究有着非常重要的意义。
酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。
二、实验原理萌发的种子中存在两种淀粉酶,分别是α-淀粉酶和β-淀粉酶,β-淀粉酶不耐热,在高温下易钝化,而α-淀粉酶不耐酸,在pH3.6下则发生钝化。
本实验的设计利用β-淀粉酶不耐热的特性,在高温下(70℃)下处理使得β-淀粉酶钝化而测定α-淀粉酶的酶活性。
酶活性的测定是通过测定一定量的酶在一定时间内催化得到的麦芽糖的量来实现的,淀粉酶水解淀粉生成的麦芽糖,可用3,5-二硝基水杨酸试剂测定,由于麦芽糖能将后者还原生成硝基氨基水杨酸的显色基团,将其颜色的深浅与糖的含量成正比,故可求出麦芽糖的含量。
常用单位时间内生成麦芽糖的毫克数表示淀粉酶活性的大小。
然后利用同样的原理测得两种淀粉酶的总活性。
实验中为了消除非酶促反应引起的麦芽糖的生成带来的误差,每组实验都做了相应的对照实验,在最终计算酶的活性时以测量组的值减去对照组的值加以校正。
在实验中要严格控制温度及时间,以减小误差。
并且在酶的作用过程中,四支测定管及空白管不要混淆。
三、材料、试剂与仪器1、实验材料:萌发的小麦种子(芽长1厘米左右)2、仪器:722光栅分光光度计:DK-S24型电热恒温水浴锅:离心机:3、试剂:①1%淀粉溶液(称取1克可溶性淀粉,加入80ml蒸馏水,加热熔解,冷却后定容至100ml);②pH5.6的柠檬缓冲液:A液(称取柠檬酸20.01克,溶解后定容至1L)B液(称取柠檬酸钠29.41克,溶解后定容至1L)取A液5.5ml、B液14.5ml混匀即为pH5.5柠檬酸缓冲液;③3,5-二硝基水杨酸溶液(称取3,5-二硝基水杨酸1.00克,溶于20ml 1M氢氧化钠中,加入50ml蒸馏水,再加入30克酒石酸钠,待溶解后,用蒸馏水稀释至100ml,盖紧瓶盖保存);④麦芽糖标准液(称取0.100克麦芽糖,溶于少量蒸馏水中,小心移入100ml容量瓶中定容);⑤0.4M NaOH四、实验步骤1. 酶液的制备称取2克萌发的小麦种子与研钵中,加少量石英砂,研磨至匀浆,转移到50ml容量瓶中用蒸馏水定容至刻度,混匀后在室温下放置,每隔数分钟振荡一次,提取15-20分钟,于3500转/分离心15分钟,取上清液备用。
淀粉酶活力测定实验报告淀粉酶活力测定实验报告引言:淀粉是一种常见的多糖类物质,广泛存在于植物的种子、块茎和根部等部位。
淀粉酶是一类能够催化淀粉水解为糖类的酶,广泛存在于植物、动物和微生物中。
淀粉酶活力的测定对于研究淀粉酶的性质、功能以及酶的催化机制具有重要意义。
本实验旨在通过测定淀粉酶活力的方法,探究淀粉酶的催化作用及其影响因素。
实验材料与方法:材料:1. 淀粉溶液2. 淀粉酶溶液3. 碘液4. 盐酸5. 碘化钾溶液6. 蒸馏水方法:1. 预先制备好一定浓度的淀粉溶液和淀粉酶溶液。
2. 取一定量的淀粉溶液,加入适量的淀粉酶溶液,混匀后放置一段时间。
3. 取适量的混合液,加入盐酸,停止淀粉酶的活性。
4. 加入碘液,使混合液呈现蓝黑色。
5. 用碘化钾溶液滴定至混合液呈现淡黄色,记录滴定所需的碘化钾溶液体积。
6. 重复上述步骤,分别改变淀粉酶的浓度、温度和pH值等条件,进行多组实验。
结果与讨论:通过实验测定,我们得到了不同条件下淀粉酶活力的数据,并进行了分析和讨论。
1. 淀粉酶浓度对活力的影响:在一定温度和pH值下,我们分别取不同浓度的淀粉酶溶液进行实验。
结果显示,淀粉酶活力随着酶浓度的增加而增加,但当酶浓度达到一定程度后,活力的增加趋势趋于平缓。
这说明在一定范围内,淀粉酶活力与酶浓度呈正相关关系。
2. 温度对活力的影响:我们分别在不同温度下进行实验,结果显示,淀粉酶活力随着温度的升高而增加,但当温度超过一定范围后,活力开始下降。
这是因为温度的升高可以增加酶分子的运动速度和碰撞频率,促进酶与底物的结合,从而提高活力。
然而,过高的温度会导致酶分子的构象变化和热失活,从而降低活力。
3. pH值对活力的影响:我们在不同pH值下进行实验,结果显示,淀粉酶活力在一定范围内随着pH值的变化而增加。
这是因为pH值的变化可以改变酶分子的电荷状态和离子化程度,从而影响酶与底物的结合能力和催化效率。
然而,当pH值偏离酶的最适pH值时,酶分子的构象发生改变,导致活力的降低。
淀粉酶活力的测定实验报告淀粉酶活力的测定实验报告引言:淀粉酶是一种重要的酶类,广泛存在于生物体内。
它能够催化淀粉的水解反应,将淀粉分解为可溶性糖类。
淀粉酶活力的测定对于了解酶的功能和特性具有重要意义。
本实验旨在通过测定淀粉酶活力的方法,探究酶的催化作用以及影响酶活力的因素。
实验材料与方法:材料:- 淀粉溶液- 淀粉酶溶液- 盐酸溶液- 碘液- 试管- 恒温水浴方法:1. 准备一系列浓度不同的淀粉溶液,如0.1%、0.2%、0.3%等。
2. 将试管标记为不同的浓度,并分别加入相应浓度的淀粉溶液。
3. 在每个试管中加入相同体积的淀粉酶溶液,并迅速混合。
4. 将试管放入恒温水浴中,保持恒定的温度。
5. 在一定时间间隔内,取出一定体积的反应液,加入碘液停止反应。
6. 通过比色法测定淀粉的浓度,进而计算淀粉酶的活力。
结果与讨论:实验结果显示,淀粉酶活力随着淀粉溶液浓度的增加而增加。
这是因为淀粉酶需要与淀粉分子结合才能发挥催化作用,高浓度的淀粉溶液提供了更多的底物供给,从而增加了酶的活性。
另外,我们还观察到淀粉酶活力随着反应时间的延长而增加,但在一定时间后趋于稳定。
这是因为酶的活性在反应初期较高,但随着反应进行,底物浓度逐渐减少,酶的活性也会逐渐降低。
此外,实验结果还显示淀粉酶活力受到温度的影响。
在较低温度下,酶的活性较低,而在适宜的温度范围内,酶的活性最高。
然而,当温度过高时,酶会发生变性,活性会显著下降。
结论:通过本实验,我们成功测定了淀粉酶的活力,并探究了影响酶活力的因素。
实验结果表明,淀粉酶活力受到淀粉溶液浓度、反应时间和温度的影响。
深入了解酶的催化作用和特性,有助于我们更好地理解生物体内的代谢过程,并为工业生产中的酶应用提供理论依据。
然而,本实验还存在一些局限性。
首先,我们仅仅测定了淀粉酶活力的影响因素,对于其他酶的活力测定仍需进一步研究。
其次,实验结果受到实验条件和操作的影响,仍需要进一步优化实验方法和控制实验条件。
淀粉酶活性研究宁加彬1,王文移2(青岛科技大学)摘要:淀粉酶主要用作果汁加工中的淀粉分解和提高过滤速度以及蔬菜加工、糖浆制造、葡萄糖等加工制造。
淀粉酶活性的研究在淀粉催化分解工程中占有重要地位。
文中综述了淀粉酶活性及其热稳定性,电场对淀粉酶活性的影响。
pH值、温度、淀粉浓度和钙的添加量以及瞬时高压处理对α-淀粉酶的热稳定性和活性的影响关键词:淀粉酶酶活性热稳定性淀粉酶是水解淀粉和糖原的酶类总称,通常通过淀粉酶催化水解织物上的淀粉浆料,由于淀粉酶的高效性及专一性,酶退浆的退浆率高,退浆快,污染少,产品比酸法、碱法更柔软,且不损伤纤维。
对淀粉酶的研究,有利于我们更好的理解其催化机理。
淀粉是植物种子的主要贮存物质,淀粉酶的主要作用是催化淀粉的水解,淀粉被水解成简单有机化合物并提供细胞生长所需的能量。
1、淀粉酶的研究概况淀粉酶研究经历了一个较长的奠定和发展时期。
在中国知网依据主题——淀粉酶进行检索,结果显示在1979-2013年共涉及15840篇文献。
其中,2005年以前的总计5256篇,2005-2010年5256篇,也就是说2005年之前的研究篇数仅占目前土壤酶研究总数的1/3。
而从2005年开始我国对土壤酶活性研究的论文以超百篇的速度增加,且增加趋势较为明显,仅2012年就有724篇。
针对我国淀粉酶活性研究的快速发展,该文就我国淀粉酶研究种类及研究方法的资料进行归纳总结,旨在进一步扩宽我国淀粉酶活性研究的范围,为今后淀粉酶的研究提供一些新的思路,同时也可促进我国淀粉酶研究方法的发展。
2、淀粉酶的分类淀粉酶是水解淀粉和糖原酶类的统称。
按水解淀粉方式不同,把淀粉酶分为α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶和异淀粉酶四类。
目前淀粉酶已广泛地应用于食品、发酵、畜牧业生产、谷物加工、纺织、造纸、轻化工业、医药和临床分析等领域 (Ashok et al.,2000;Lili,2000;柳辉等,2007;张剑等,2009)。
其中,中温淀粉酶主要应用于饴糖、啤酒、黄酒、葡萄糖、味精以及抗生素等行业,也可以用于高质量的丝绸人造棉、化学纤维的退浆。
淀粉酶广泛存在于微生物、植物和动物体中。
现已有大量有关土壤微生物产淀粉酶及酶学性质的文献报道(卢涛等,2002,四川大学学报(自然科学版),39(6):1131—1133;张应玖等。
2002)。
3、淀粉酶活性3.1、电场对淀粉酶活性影响用不同强度电场处理α- 淀粉酶5min,处理后分别在第1天与第10天测定电场对α- 淀粉酶活性的影响。
第1天测定结果表明,电场对酶产生明显影响,而且不同强度电场对α- 淀粉酶活性的影响程度不同,在0。
5--6。
0kV/cm范围内,酶活性随场强增加呈非单调性变化,与对照组相比,变化幅度在5。
5%--26。
2%之间。
第10天测定,酶活性变化幅度在0。
2%--16。
3%之间,表明电场对酶产生的影响经过一定时间后趋于消失。
不同强度电场导致酶活性增加的效应不同,并且呈非单调性变化。
我们认为,不同强度电场对酶蛋白分子的构象产生了不同影响,处理酶所用的电场能量虽然不足以改变酶蛋白氨基酸序列,但可以改变酶蛋白的构象。
在地球环境( 电场、引力场) 中,生物体具有固有态势,当外界环境发生变化时,势必引起生物体生物态势的变化,达到新的生物态势,从而影响生命过程。
酶蛋白中氧氢键( O-H)与碳氧键( C- O)均为极性键,在电场作用下,分子或分子基团的偶极矩将发生化,改变酶蛋白的构象而影响酶活性,产生不同的宏观生物学效应。
电场处理过的酶放置一定时间后,酶活性增加效应趋于消失,这意味着电场作用对生命过程影响具有时间效应,这对指导电生物效应的开发利用具有重要意义。
生命体是一个复杂系统,其生命过程也是一个复杂的过程,各部分之间存在相互联系与协调作用,并不是所有电场处理都有利于植物生长与发育。
有利于植物生长发育的酶活性、构象以及不同电场处理条件( 电场强度、频率和处理时间) 对生物体产生的影响都是需要进一步研究的问题。
3.2、pH值、温度、淀粉浓度和钙的添加量对α-淀粉酶的热稳定性和活性的影响α-淀粉酶水解可溶性淀粉的最适酸度为pH510;高浓度淀粉可以较好地保护酶的活性和热稳定性,一定量的钙离子可提高α-淀粉酶的热稳定性和催化效率。
向5%(w/w)的可溶性淀粉中添加10mmol/LCa2+,α-淀粉酶活性和热稳定性能最大限度的发挥。
与对照酶(不加Ca2+,在2h内最适反应温度为75℃)相比,加Ca2+酶的热稳定性可提高10℃。
该酶在使用时,一次性投料要比分次投料的效果好。
底物的存在能提高α-淀粉酶的活性与热稳定性,高浓度的底物对α-淀粉酶的保护作用更好。
无外加Ca2+时,α-淀粉酶的最适反应温度为75℃,当加入Ca2+浓度为10mmol/L,可使上述温度提高10℃,且催化效能也明显提高。
当Ca2+用量为10mmol/L~15mmol/L时,可使α-淀粉酶的催化活性最大限度发挥。
3.3、几种环境条件对唾液淀粉酶活性的影响唾液淀粉酶是生物催化剂,影响酶活性的因素很多,必须在各种合适的条件下,才能发挥其正常的催化作用。
淀粉酶的活性受温度、pH值、激活剂及抑制剂、酶浓度以及作用时间等多种因素影响,唾液淀粉酶的最适温度为37—40℃,最适pH为6。
8。
偏离此最适环境时,酶的活性减弱。
低浓度的Cl-离子能增加淀粉酶的活性,是它的激活剂。
Cu2+等金属离子能降低该酶的活性,是它的抑制剂。
每个人产生唾液淀粉酶的量不同,活性强弱也有差异。
不同人的酶活性受环境条件影响程度也不同,有些人的酶活性在一定条件下几乎不受影响,而有些几乎失活。
人体唾液淀粉酶在37℃活性最强,但0℃、100℃下酶活性并没有完全丧失,而是活性受到影响,特别是0℃时酶活性受影响比较大,其活性比较弱,由此可知很多水果、蔬菜中的酶在低温时活性比较低,有利于保鲜。
同时发现中性环境中淀粉酶活性最强,不同来源的酶对碱的耐受度不同,有的影响不大,有的几乎失活。
稀释的唾液,由于酶浓度降低,其活性也相应降低,出现相应的颜色反应。
3.4、瞬时高压处理对α- 淀粉酶活性的影响瞬时高压作用对α- 淀粉酶具有有效的钝化作用,在pH 6 时,25 ℃、35 ℃、45 ℃下分别处理1 次,80~ 120 MPa 时α- 淀粉酶活性下降较慢,120 MPa后活性下降变快;提高进料温度,可以增强瞬时高压对α- 淀粉酶的钝化效果。
pH 6、25 ℃时,在100 MPa 、120 MPa和140 MPa 下分别对α-淀粉酶处理3 次,在相同的作用压力下,α- 淀粉酶活性随处理次数的增加呈下降趋势;α- 淀粉酶活性降低幅度随处理次数的增加而变小。
常压下α- 淀粉酶在pH 值5。
0~8。
0 时较为稳定,pH 值低于4 时严重失活;120 MPa 下,α- 淀粉酶活性较常压下低;活性下降幅度在强酸时更大,其次为强碱,pH 6 时最小。
瞬时高压作用对α- 淀粉酶具有有效的钝化作用,由于α- 淀粉酶流体在微射流均质机内的高速撞击、涡旋、气穴、剪切等一系列运动过程中,其构象和活性中心被破坏;随着压力加大,酶逐渐丧失活性;压力越大,丧失活性的α- 淀粉酶分子越多。
进料温度为45 ℃时,瞬时高压对α- 淀粉酶的钝化作用明显比低温时好。
由于压力增大是通过增加电机的输出功率而获得,因此,在提高压力的同时,电机频率也随之增加,流量也随之增大,物料的温升也随之增大,流量的增加未必能抑制酶的钝化,但物料温升的增加应该对酶的钝化有积极贡献。
进料温度和压力越高,物料的温升也越高,导致蛋白质的热变性强度增加,从而也会降低α- 淀粉酶的活性。
因此在120 MPa 以后,α-淀粉酶活性下降加快,并且提高进料温度后,活性下降幅度增大。
但由于α- 淀粉酶耐热性较强,所以相对于压力来说,进料温度对α- 淀粉酶活性的影响较小。
在相同的进料温度和处理次数下,随着压力的提高,α- 淀粉酶活性逐渐下降,且变化趋势是由慢变快。
另外,提高进料温度,可以增强瞬时高压对α-淀粉酶的钝化效果。
处理次数对α- 淀粉酶活性有一定的影响。
在相同的进料温度和作用压力下,α- 淀粉酶活性随处理次数的增加呈下降趋势。
且α- 淀粉酶活性降低幅度随处理次数的增加而变小。
4、研究展望及评述目前,国内外对淀粉酶的研究已取得了可喜的成绩,如KIHARA M等利用定点诱变和随机诱变的方法达到了取代原大麦淀粉酶7个氨基酸经诱变后的淀粉酶与原酶相比,耐热性提高了11.6 ℃,且这种转基因的大麦种子能稳定地传给子代,从而为工业利用淀粉酶提供了种子质量保障。
尽管微生物来源的淀粉酶活力低,距工业应用还存在一定的差距,但通过诱变育种和基因工程手段处理菌株,可大大提高菌种产酶能力可以预见,通过物种定向改性以及转基因技术来提高酶的活性和热稳定性仍将是未来淀粉酶的研究热点。
5、参考文献[1]Ashok P.,Poonarn N.,and Carlos R.S.,2000,Advances inmicro-bial amylases,Biotechl.Appl.Biochem.,(31):135-152[2]W eem aes C, RubensP,De Cordt S,et al.Temperature sensiti-vity and pressure resistance of mushroom polyphenoloxidase[J].J FoodScience,1997,62(2):261- 266.[3] Gomes MRA, Ledward DA. Effect of high- pressure treat-ment on the activity of some polyphenoloxidases[J].Food Chemistry,1996,56(1):1- 5.[4] 钟业俊,刘成梅等.瞬时高压处理对α- 淀粉酶活性的影响[J].粮食加工,2006(4):92-94[5]李伟,文红梅,朱荃.白术提取液及成分对唾液淀粉酶活性的影响.时珍国医国药,2006,17,(11):2123-2124[6]张继千,吴波等.海洋菌Wll产中温淀粉酶的酶学特性.基因组学与应用生物学,2010,29,(1):71-74[7]杨玉萍.几种环境条件对唾液淀粉酶活性的影响.新乡学院学报,2009,8,26,(4):42-44[8]姚占全,田晓,杨体强.电场对淀粉酶活性影响及存留时间的研究.内蒙古师范大学学报,2007,1,(1):58-60[9]张剑,易华锋等.α-淀粉酶的活性及其热稳定性的究.ChinaBrewing,2008,10:20-23[10]白坤,于德贵等.α-淀粉酶的性质及其液化作用[J].中国酿造,1995(7):101。