乙烯的性质
- 格式:doc
- 大小:25.50 KB
- 文档页数:3

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。

乙烯知识点总结文库1. 物理性质乙烯是一种无色、无味、可燃的气体,在常温下呈现为无色、无味的气体,但可以在软泥煤、天然气、石油等矿物燃料中找到。
乙烯的比重为0.552g/cm3,沸点为-103.6℃,在常温下为无色无味的气体。
2. 化学性质乙烯是一种不稳定的化合物,可以和氧气、溴、氯等元素发生剧烈的化学反应。
乙烯可以和氯气作用生成氯乙烷,和溴作用生成1,2-二溴乙烷,和氢卤酸发生反应生成卤代乙烷等。
此外,乙烯还可以和羰基化合物发生羰基化反应,生成乙烯基醛、醇和酸。
3. 生产方法乙烯的生产方法主要包括烷烃裂解、醇脱水、乙烷氧化和原生材料合成等几种方法。
烷烃裂解是通过加热石油烃类化合物,使其分解为乙烯和其他烃类物质。
醇脱水是通过将醇类化合物和酸性或碱性催化剂一起加热,使其分解为乙烯和水。
乙烷氧化是将乙烷和氧气在铋钒酸盐催化剂的作用下,产生一氧化碳和二氧化碳并生成乙烯。
原生材料合成是通过木材、秸秆等生物质性原料提取乙醇,再通过脱水反应制得乙烯。
4. 应用领域乙烯是一种重要的工业原料,广泛用于合成塑料、橡胶、溶剂和化肥等化工产品。
乙烯可以被用来制造聚乙烯、聚氯乙烯、聚苯乙烯、聚丙烯、聚碳酸酯等各种合成树脂和塑料。
另外,乙烯还可以用于制造橡胶、制造合成纤维、制造皂化物质等。
在化工工业中,乙烯还可以被用作溶剂、去除,干燥、发泡等劬利剂。
此外,乙烯还可以用于制造氯化乙烯、醋酸乙烯、烯烃类石油树脂、乙烯醛、酒精类食品添加剂等。
另外,作为一种无毒、无害的气体,乙烯还可以被用于制造乙烯化植物生长调节剂、消毒剂等。

乙烯的性质一、物理性质通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。
二、化学性质①常温下极易被氧化剂氧化。
如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。
②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。
CH2═CH2+3O2→2CO2+2H2O③烯烃臭氧化:CH2=CH2+O3,在锌保护下水解→2HCHO2CH2=CH2+O2—Ag、加热,酸性水解→2CH3—CHO加成反应:CH2═CH2+Br2→CH2Br—CH2Br(常温下使溴水褪色)CH2═CH2+HCl—催化剂、加热→CH3—CH2Cl(制氯乙烷)CH2═CH2+水—催化剂、170℃→CH3CH2OH(制酒精)CH2═CH2+H2—Ni或Pd,加热→CH3CH3CH2═CH2+Cl2→CH2Cl—CH2Cl加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
加聚反应:nCH2═CH2→-(CH2—CH2)- n (制聚乙烯)三、制取酒精硫酸一比三,催化脱水是硫酸。
温度速至一百七,不生乙醚生乙烯。
反应液体呈黑色,酒精炭化硫酸致。
为防暴沸加碎瓷,排水方法集乙烯。
苯的性质一、物理性质常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味。
苯可燃,有毒,也是一种致癌物质。
苯是一种碳氢化合物也是最简单的芳烃。
它难溶于水,易溶于有机溶剂,本身也可作为有机溶剂。
苯是一种石油化工基本原料。
结构平面正六边形。
溶解性:不溶于水,可与乙醇、乙醚、乙酸、汽油、丙酮、四氯化碳和二硫化碳等有机溶剂互溶。
二、化学性质苯参加的化学反应大致有3种:一种是其他基团和苯环上的氢原子之间发生的取代反应;一种是发生在苯环上的加成反应(注:苯环无碳碳双键,而是一种介于单键与双键的独特的键);一种是普遍的燃烧(氧化反应)(不能使酸性高锰酸钾褪色)。

乙烯的性质
乙烯(ethylene)是一种无色的、无味的、有毒的气态烃,其分子式为C2H4,它是一种二元烃,也是最简单的烃之一,是乙烯和乙
烯氧化物等衍生物的重要原料。
乙烯是一种极易挥发的液体,分子量非常小,无色无味,具有强烈的自毒性,对氧气有很强的氧化性,容易结合氧形成乙烯的氧化物。
因其分子结构的特殊性,它也是多种重要的化学反应的催化剂,可以用来合成乙烯氧化物,如乙烯醇,乙烯酸,乙酰乙酸等等。
由于乙烯的特性,它广泛应用于日常生活中,如用来制作塑料,橡胶,颜料,染料,农药等物质,也是普通水溶液,溶剂,膜,浆料等物质的重要原料。
乙烯也可以用在医学上,如作为药丸的表面功能材料,也可以用在精细化学工业上,使用乙烯氧化物可以制造用于制造医疗器械,仪器和仪器的部件,如管道,晶体,测量仪器,照相机,玻璃等类型的装置。
乙烯也是火焰反应的主要成分,由于它具有非常强烈的氧化性,它可以被用来加热材料,它是许多化学反应的主要原料,如催化剂,还可以用来制造半导体、液晶等新型材料。
乙烯是生物体中重要的一种激素,它不仅可以促进植物生长发育,还可以促进植物对环境的适应,对动物也有特殊的作用,如促进生长发育,合成抗体,调节内分泌功能等。
综上所述,乙烯是一种重要的物质,它具有极强的氧化性,可以用于许多工业,催化剂,材料,药物等,而且也是生物体重要的激素
之一,可以促进植物及动物的生长发育及其对环境的适应。
因此,乙烯是一种具有重要作用的物质。

生产工艺路线选择乙烯物理性质:通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4 沸点(℃):-103.9 相对密度(水=1):0.61 相对蒸气密度(空气=1):0.98 饱和蒸气压(kPa):4083.40(0℃) 燃烧热(kJ/mol):1411.0 临界温度(℃):9.2 临界压力(MPa):5.04 闪点(fp):无意义引燃温度(℃):425 爆炸上限%(V/V):36.0 爆炸下限%(V/V):2.7 溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
乙醛:外观与性状:无色液体,有强烈的刺激臭味,易挥发。
熔点(℃):-121沸点(℃):20.8相对密度(水=1):0.78相对蒸气密度(空气=1):1.52饱和蒸气压(kPa):98.64(20℃)燃烧热(kJ/mol):279.0 kcal/mol临界温度(℃):188闪点(℃):-39 原料来源:石油裂化催化剂性能:钯盐催化剂溶液有毒,具有酸性,并含有高浓度的氯离子,有强烈的腐蚀性.安全:产品都是易燃易爆有毒物质,与空气能形成爆炸混合物。
环保分析:如是用碳钢制造,要求内衬耐酸耐温橡胶和瓷砖,各法兰连接处和同氧气的罐子腐蚀更严重,一般需采用特种材料。
先进性:通过可得区与理想反应器超级结构法两步系统预分析确定基本单元数量与连接类型,提供求解初值与变量边界,大大降低了模型求解复杂度。
经济性分析:1.反应条件缓和,有较高的选择性2.反应热的除去比较方便,有氧化可用反应物或溶剂的蒸发以移走反应热3.反应温度易控,温度分布均匀4.反应设备结构简单,生产能力高,工艺条件乙醛生产方法1.乙醇氧化法2CH3CH2OH+O2→2CH3CHO+2H2O2.乙炔水合法C2H2+H2O→CH3CHO3.乙烯直接氧化法CH2CH2+O2→CH3CHO1、反应温度一席液相痒化生产乙醛在热力学上是很有利的,温度因素主要影响反应速率和选择性。

乙烯性能描述常温常压下,乙烯是一种无色气体,但通常以带压低温液体的形式进行储存、运输。
健康危害:具有较强的麻醉作用。
急性中毒:吸入高浓度乙烯可立即引起意识丧失,无明显的兴奋期,但吸入新鲜空气后,可很快苏醒。
对眼及呼吸道粘膜有轻微刺激性。
与液态的乙烯接触,会由于其迅速蒸发而导致身体组织冻伤。
慢性影响:长期接触,可引起头昏、全身不适、乏力、思维不集中;个别人有胃肠道功能紊乱。
环境危害:对环境有危害,对水体、土壤和大气可造成污染。
燃爆危险:易燃,与空气混合能形成爆炸性混合物;遇明火、高热或与氧化剂接触,有引起燃烧爆炸的危险;与氟、氯等接触会发生剧烈的化学反应。
有害燃烧产物:一氧化碳、二氧化碳。
职业接触限值:中国MAC(mg/m3):未制定标准;TLVTN:ACGIH 窒息性气体。
液态乙烯及气体特性和安全数据物理特性分子式:C2H4分子量:28.05CAS No.:74-85-1类别:不饱和碗烃(脂肪类的)外观:无色液体,气体呈云雾状比空气重气味:微甜,略具烃类特有的臭味凝固点:-169.2℃(大气压下)沸点:-103.7℃(大气压下)闪点1 : 约-136.1℃燃烧温度2:450℃燃烧限值:在空气中体积比为2.7—36%比重:0.569(-104℃)相对蒸气密度:0.977(0℃/1.013bar)蒸气压力:0.999bara (-104℃)40.05bara (0℃)溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚安全数据TLV3:在空气中为1000ppm(v/v) 液态下影响:对眼部和皮肤造成冻伤和组织损伤气态下影响:窒息、眩晕和恶心,高浓度会导致麻醉,无法感觉到疼痛、冷热注:1可燃性液体的蒸气在液体表面与空气混合,能即刻被点燃所需的最低温度2在空气中能够维持自我燃烧的物质被点燃所需要的最低温度3对身体产生影响的最低限值。

高中乙烯知识点在高中化学的学习中,乙烯是一个非常重要的有机化合物。
了解乙烯的相关知识,对于我们深入理解有机化学的基本概念和原理有着重要的意义。
首先,让我们来认识一下乙烯的分子结构。
乙烯的分子式为C₂H₄,结构简式为 CH₂=CH₂。
它的分子中含有碳碳双键,这是乙烯具有特殊化学性质的关键所在。
与只含有单键的烷烃相比,双键的存在使得乙烯的化学性质更加活泼。
乙烯是一种无色、稍有气味的气体,密度略小于空气,难溶于水。
在实验室中,我们通常通过乙醇的消去反应来制取乙烯。
具体的反应方程式为:CH₃CH₂OH →(浓硫酸、170℃)CH₂=CH₂↑ + H₂O。
在这个反应中,浓硫酸起到了催化剂和脱水剂的作用。
需要注意的是,反应温度必须控制在 170℃,如果温度过低,会发生副反应生成乙醚。
乙烯的化学性质非常活泼。
由于其分子中含有碳碳双键,容易发生加成反应。
例如,乙烯与溴水发生加成反应,使溴水褪色,反应方程式为:CH₂=CH₂+ Br₂ → CH₂Br—CH₂Br。
这个反应可以用来鉴别乙烯和烷烃。
乙烯还能与氢气发生加成反应,生成乙烷,CH₂=CH₂+ H₂ →(催化剂)CH₃—CH₃。
与氯化氢发生加成反应生成氯乙烷,CH₂=CH₂+HCl →(催化剂)CH₃—CH₂Cl 。
这些加成反应在有机合成中具有重要的应用,可以通过乙烯来制取各种其他的有机化合物。
乙烯在一定条件下还能发生加聚反应,生成聚乙烯。
这是一种重要的高分子化合物,广泛应用于塑料制造等领域。
反应方程式为:nCH₂=CH₂ →(催化剂)—CH₂—CH₂n—。
在工业上,乙烯是一种重要的化工原料。
通过石油的裂解可以大量获得乙烯。
乙烯的产量是衡量一个国家石油化工发展水平的重要标志。
乙烯在植物生长过程中也起着重要的作用。
它是一种植物激素,能够促进果实成熟。
在农业生产中,人们常常利用乙烯的这一性质来催熟水果。
接下来,让我们通过一些例题来巩固一下乙烯的知识点。
例 1:下列物质中,能使溴水褪色的是()A 甲烷B 乙烯C 苯D 乙酸解析:乙烯能与溴水发生加成反应而使溴水褪色,甲烷、苯、乙酸都不能与溴水发生反应使其褪色,答案选择 B。

乙烯物理化学性质归纳乙烯是一种无色、易燃、带有特殊气味的化学物质,其化学式为C2H4。
它是最简单的烯烃,也是最重要的工业化学品之一。
由于其独特的物理和化学性质,乙烯在许多领域都有广泛的应用。
本文将重点归纳乙烯的物理和化学性质。
一、物理性质1、外观与形态:乙烯是一种无色透明气体,具有流动性,没有固定的形状。
2、沸点和熔点:乙烯的沸点为-169℃,熔点为-173℃。
这两个温度点均低于其他常见的烃类化合物。
3、密度和折射率:乙烯的密度为1.179kg/m³,折射率为1.369。
4、蒸汽压和临界参数:乙烯的蒸汽压在常温下为0.537kPa,临界温度为91.7℃,临界压力为4.87MPa。
二、化学性质1、反应活性:乙烯具有高度的反应活性,可以参与多种化学反应,如氧化、氢化、卤化、聚合等。
2、氧化反应:在空气中,乙烯容易被氧化,生成乙醛、乙酸等化合物。
3、氢化反应:乙烯可以与氢气发生加成反应,生成乙烷。
这种反应是工业上生产高纯度乙烷的主要途径。
4、聚合反应:乙烯可以自身聚合生成聚乙烯,也可以与其他烯烃进行共聚。
这是生产聚乙烯的主要化学反应。
5、卤化反应:乙烯可以与卤素(如氯、溴)发生取代反应,生成二氯乙烷、二溴乙烷等化合物。
6、其他反应:乙烯还可以与水发生加成反应,生成乙醇;在高温下,乙烯可以发生裂解反应,生成炭黑和氢气。
三、应用领域由于乙烯的上述物理和化学性质,它在许多领域都有广泛的应用。
以下是几个主要的应用领域:1、塑料和橡胶生产:乙烯是生产聚乙烯的主要原料,聚乙烯是世界上产量最高的塑料。
乙烯也用于生产橡胶和其他合成材料。
2、化学工业:乙烯是许多化学品的原料,如乙醛、乙酸、乙胺等。
这些化学品广泛应用于制药、农业、纺织等领域。
3、燃料工业:乙烯可以用于生产乙醇和乙烷等燃料,也可以直接用作燃料。
4、农业:乙烯可以促进植物生长,提高产量。
在农业上,它常被用作催熟剂。
5、其他领域:除了上述应用领域,乙烯还广泛应用于纤维、涂料、电子等领域。
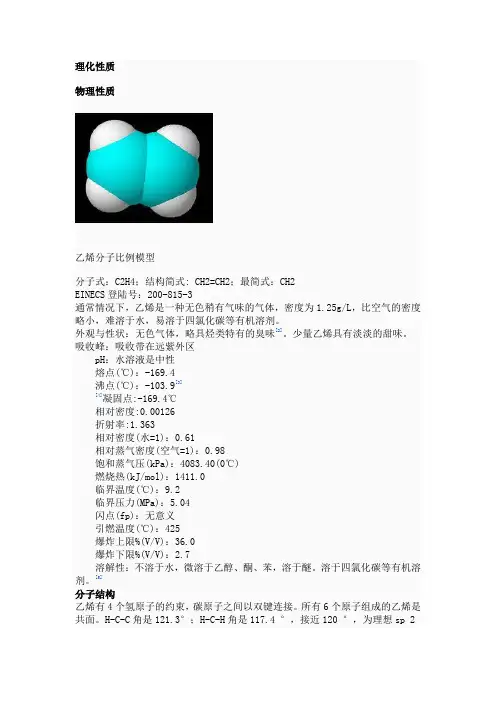
理化性质物理性质乙烯分子比例模型分子式:C2H4;结构简式: CH2=CH2;最简式:CH2EINECS登陆号:200-815-3通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味[2]。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4沸点(℃):-103.9[3][4]凝固点:-169.4℃相对密度:0.00126折射率:1.363相对密度(水=1):0.61相对蒸气密度(空气=1):0.98饱和蒸气压(kPa):4083.40(0℃)燃烧热(kJ/mol):1411.0临界温度(℃):9.2临界压力(MPa):5.04闪点(fp):无意义引燃温度(℃):425爆炸上限%(V/V):36.0爆炸下限%(V/V):2.7溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
[5]分子结构乙烯有4个氢原子的约束,碳原子之间以双键连接。
所有6个原子组成的乙烯是共面。
H-C-C角是121.3°;H-C-H角是117.4 °,接近120 °,为理想sp 2混成轨域。
这种分子也比较僵硬:旋转C=C键是一个高吸热过程,需要打破π键,而保留σ键之间的碳原子。
VSEPR模型为平面矩形立体结构也是平面矩形。
双键是一个电子云密度较高的地区,因而大部分反应发生在这个位置。
化学性质①常温下极易被氧化剂氧化。
如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。
②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。
CH2═CH2+3O2→2CO2+2H2O③烯烃臭氧化:CH2=CH2+O3,在锌保护下水解→2HCHOCH2=CH2+(1/2)O2—Ag、加热,酸性水解→CH3—CHO•加成反应:CH2═CH2+Br2→CH2Br—CH2Br(常温下使溴水褪色)CH2═CH2+HCl—催化剂、加热→CH3—CH2Cl(制氯乙烷)CH2═CH2+水—催化剂、170℃→CH3CH2OH(制酒精)CH2═CH2+H2—Ni或Pd,加热→CH3CH3CH2═CH2+Cl2→CH2Cl—CH2Cl加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。


乙烯结构特点乙烯,也被称为乙烯烷,是一种无色、可燃的气体。
它是一种重要的有机化合物,由两个碳原子和四个氢原子组成,化学式为C2H4。
乙烯是一种不饱和的烃,具有特殊的结构特点和化学性质。
乙烯的分子结构特点主要体现在以下几个方面:1. 双键结构:乙烯分子由两个碳原子通过一个共享电子对连接在一起,形成了一个碳-碳双键。
这个双键使得乙烯具有不饱和的性质,并且使得乙烯的化学反应具有独特的特点和活性。
2. 线性结构:乙烯分子由两个碳原子和四个氢原子组成,呈线性排列。
这种线性结构使得乙烯分子更加稳定,并且具有较高的反应活性。
3. π电子云:乙烯的双键上存在一个π电子云,这个π电子云对于乙烯分子的性质具有重要影响。
π电子云使得乙烯分子具有共轭体系,具有较强的吸收紫外线的能力,并且在化学反应中容易发生电子迁移,从而影响了乙烯的反应性质。
乙烯的结构特点使其具有许多重要的应用和化学性质。
首先,乙烯是合成聚乙烯的原料,聚乙烯是一种重要的塑料材料,广泛应用于包装、建筑、电子等领域。
其次,乙烯可以通过加氢反应转化为乙烷,这是一种常用的工业反应。
乙烯还可以通过氧化反应制备乙烯醇、乙醛等化合物,这些化合物在化工领域有广泛的应用。
乙烯还具有一些特殊的化学性质。
由于乙烯分子中的π电子云,乙烯具有较强的亲电性和核磁性。
乙烯可以与许多化合物进行加成反应、取代反应、氧化反应等,形成不同的产物。
乙烯还可以通过聚合反应形成高分子化合物,如聚乙烯、聚丙烯等。
总结而言,乙烯具有双键结构、线性结构和π电子云等结构特点,这些特点使得乙烯具有不饱和性和较强的反应活性。
乙烯在化工领域有广泛的应用,是许多重要化合物的原料和中间体。
对于研究乙烯的结构特点和化学性质,有助于深入了解乙烯的应用和反应机理,从而推动相关领域的发展。
乙烯的性质
乙烯是一种广泛应用的有机化合物,它具有多种重要的物理与化学性质,更是当今社会的重要原料。
本文将对乙烯的性质进行深入研究,旨在为其进一步开发提供参考价值。
首先,从物理性质的角度来看,乙烯的分子量为28.05,其熔点为-107.2℃,沸点为-26.2℃,空气中的饱和蒸汽压为36.5kPa,比旋度为1.2998,以及折射率为1.5048等。
其次,乙烯也有一些明显的化学性质,它是一种稳定性强的碳氢化合物,极难与其他物质反应,空气中的乙烯极易被氧化,形成乙酸和乙醛,而在较高温度下乙烯也可以发生氧化分解反应,形成碳氢化合物。
此外,乙烯也有一定的化学稳定性,它可以与氧化剂反应,但不能与氧气、空气和水反应,在少量硫酸铵的存在下也不易被氧化分解。
另外,乙烯也有诸多实际用途。
由于其良好的黏度和机械性能,乙烯可以用于制造玻璃、橡胶和塑料等产品,是现代化学工业中一种重要的原料。
此外,乙烯也是润滑剂和碳氢化合物的重要原料,可用于制造各种有机胺、醇、醛、醚、甲烷类化合物、呋喃、烯烃类物质等。
总之,乙烯具有很多独特的性质,其物理与化学性质使其在现代工业实际应用中更为重要。
从上述研究可以得出,乙烯具有稳定性强、化学稳定性高、黏度好等优点,可以广泛应用于实际工业场合。
因而,深入研究乙烯的性质和应用,有助于更好地发挥其在社会经济发展中可能发挥的独特作用。
乙烯的知识点总结乙烯的性质1. 物理性质(1)物理状态:乙烯在常温常压下是一种无色无味的气体,但可以在低温下被液化。
(2)密度:乙烯的密度为0.568 g/cm3。
(3)熔点和沸点:乙烯的熔点为-169.2°C,沸点为-103.7°C。
2. 化学性质(1)燃烧性:乙烯是易燃的气体,与空气中的氧气可以发生燃烧反应,产生二氧化碳和水。
(2)与氯化铝反应:乙烯可以与氯化铝发生加成反应,形成氯代乙烷。
(3)与溴反应:乙烯可以与溴发生加成反应,形成1,2-二溴乙烷。
(4)与硫酸反应:乙烯可以与浓硫酸发生加成反应,形成乙醇。
乙烯的制备1. 由乙烷脱氢制备:乙烯可以由乙烷在高温下经催化剂催化脱氢而得到。
2. 由煤制气制备:乙烯可以由煤制气产物中的一系列气体进行加工而得到。
3. 由炼油气中分离得到:炼油气中含有大量的乙烯,可以通过分离提纯而得到。
4. 由乙醇脱水得到:乙烯可以通过乙醇脱水而得到。
乙烯的应用1. 用于生产聚乙烯:乙烯是生产聚乙烯的重要原料,聚乙烯是一种常用的塑料,广泛用于包装、建筑、电子、机械等领域。
2. 用于生产聚氯乙烯:乙烯可以用于生产聚氯乙烯,聚氯乙烯是一种重要的合成材料,用于制作管道、日常用品、建筑材料等。
3. 用于生产乙烯醇:乙烯可以经过氧化反应得到乙烯醇,乙烯醇是一种重要的有机化工原料,用于制备乙二醇、醋酸乙烯酯等。
4. 用于生产聚丙烯:乙烯是生产聚丙烯的原料之一,聚丙烯是一种重要的合成材料,用于制作汽车零部件、纺织品、医疗器械等。
5. 用于生产聚对苯二甲酸乙二醇酯:乙烯可以用于生产聚对苯二甲酸乙二醇酯,这是一种重要的工程塑料,用于制作汽车零部件、电子产品外壳等。
乙烯的安全性1. 乙烯是一种有毒气体,吸入大量乙烯可引起中毒,严重者可危及生命。
2. 乙烯是一种易燃气体,遇到明火或热源极易发生爆炸,应储存和使用时严格遵守安全操作规程。
3. 乙烯对皮肤、眼睛和呼吸道有刺激性,接触后应及时用清水冲洗,并寻求医疗帮助。
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。
乙烯的性质
授课者:番禺中学冯金洪
教学目标:1、掌握乙烯的性质
2、了解乙烯的用途
3、通过加成反应,加聚反应等概念的归纳,对学生进行科学抽象方法的指导。
重难点:乙烯的化学性质;乙烯的加聚反应(难点)
实验电教器材:模型、CAI课件
教学过程:(上一课讲授乙烯的实验室制法时,已收集乙烯,观察其物理性质,并将乙烯通入溴水、酸性高锰酸钾溶液,乙烯燃烧三个实验做完。
) [复习]写出乙烯的电子式、结构式,指出结构特点。
[板书]三、乙烯的性质
1、物理性质
(学生回忆)无色、稍有气味,难溶于水,密度与空气接近。
2、化学性质
[展示]乙烯分子模型,要求学生从乙烯的结构特点,判断乙烯的化学性质的活泼性。
[提问]上一节课已做实验,将乙烯通入溴水中有何现象?发生什么反应?
[演示]模型演示反应原理
[板书](1)加成反应
H H
CH2=CH2+ Br―Br H―C―C―H
Br Br
[提问分析加成反应的定义]
定义:(见课本P87黑体字)
常见加成试剂:H2、HCl、H2O
[练习]:完成下列反应方程式
CH2=CH2+ H2
CH2=CH2+ HCl
CH2=CH2+ H2O
[小结]加成反应的实质:
CH2=CH2上―C=C―的一个碳碳键断裂,能够与其它原子或原子团形成新的共价键。
[板书]断一“键”加二“原子或原子团”
对比:加成反应和置换反应
加成反应:断一加二,有进无出
置换反应:一上一下,有进有出
[板书](2)氧化反应
(回忆乙烯通入酸性高锰酸钾溶液中的现象及燃烧的现象,分析乙烯的氧化)
1 CH2=CH2+3O2点燃2CO2+2H2O (与甲烷燃烧对比)明亮火焰,有黑烟
2、使酸性高锰酸钾溶液褪色(被氧化)
3、2CH2=CH2+O2催化剂2CH3CHO
[小结]:上述反应说明乙烯具有还原性
[板书](3)聚合反应
[演示]CAI:乙烯的加聚
n CH2=CH2 催化剂[CH2-CH2]
[板书]实质:加成反应(自身加成),又叫加聚反应。
[记忆方法]口诀:双键变单键,二头留一键,彼此结成链。
注意n的位置。
[小结]:乙烯的化学性质并用结构观点说明。
[板书]乙烯分子中C=C中一个碳碳键易断裂
易加成、加聚,易氧化
[板书]四、用途阅读课本P88—89
[总结]本节课重点:乙烯的化学性质
[练习]略
课外作业:P90 4、5、6。