乙烯的结构和性质
- 格式:ppt
- 大小:396.50 KB
- 文档页数:12

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。

乙烯知识点归纳总结1. 乙烯的结构和性质乙烯是一种无色气体,具有特殊的气味和易燃性。
它是一种烯烃,由两个碳原子和四个氢原子组成。
乙烯具有高度不饱和的结构,因此容易与其他化合物进行反应。
它的分子结构是一个双键的碳链,双键部分容易发生加成反应,可以与其他分子形成加成产物。
2. 乙烯的生产乙烯是一种重要的工业原料,它的生产主要通过裂解石油或天然气中的烃类化合物来实现。
常用的生产方法有石油蒸馏、裂解炉、催化裂解等。
其中,裂解炉是一种重要的生产方法,通过高温将重质烃类分子裂解成轻质的乙烯和其他烯烃。
此外,乙烯也可以通过乙烷的脱氢或醋酸的脱羧而得到。
3. 乙烯的用途乙烯作为一种重要的有机化学原料,具有广泛的用途。
首先,它是合成塑料和橡胶的重要原料之一。
例如,聚乙烯是一种重要的塑料材料,广泛用于包装、建筑、家具等领域。
此外,乙烯还可以用于合成乙烯醇、醋酸乙烯酯、氯乙烯等重要的有机化合物。
另外,乙烯还可以用于制备合成纤维、合成洗涤剂、合成香料等。
4. 乙烯的反应乙烯作为一种烯烃,具有高度不饱和的结构,因此容易发生多种反应。
首先,乙烯可以与氢气发生加成反应,生成乙烷。
其次,乙烯可以和溴水发生加成反应,生成1,2-二溴乙烷。
此外,乙烯还可以和氯气、溴气、氢氧化钠等发生加成反应,生成不同的产物。
此外,乙烯还可以参与聚合反应,形成聚合物材料,如聚乙烯、聚氯乙烯等。
5. 乙烯的安全性乙烯是一种有毒气体,长时间接触或高浓度吸入可引起中毒。
另外,乙烯具有较高的易燃性,容易在空气中发生爆炸。
因此,在生产和使用过程中,需要严格控制乙烯的浓度和使用条件,确保安全生产和使用。
综上所述,乙烯是一种重要的有机化学原料,具有广泛的生产和应用价值。
它的结构和性质决定了它在合成塑料、橡胶、合成纤维等领域的重要地位。
同时,需要注意乙烯的安全问题,加强生产和使用过程中的安全管理和控制。
希望本文对乙烯的相关知识有所帮助,能够更好地理解和应用这一重要化学品。

乙烯的结构和性质乙烯是一种化学式为C2H4的有机化合物,由两个碳原子和四个氢原子组成。
结构上,乙烯呈现出双键结构,其中两个碳原子通过一个共享的π键连接在一起。
这种双键结构使得乙烯能够表现出许多特殊的性质。
乙烯的结构使得其在化学反应中表现出活泼性,特别是在与其他有机分子发生加成反应时。
例如,乙烯能够与氢发生加成反应,生成乙烷。
这是因为乙烯的双键上的π电子云能够被氢原子的正电荷吸引,从而形成乙烷的化学键。
这种加成反应是许多有机化合物合成的重要步骤。
乙烯还可以与卤素发生加成反应。
在此反应中,乙烯的双键上的π电子云也能够被卤素原子的正电荷吸引,形成稳定的化学键。
例如,当乙烯与氯气反应时,会生成氯乙烷。
除了加成反应,乙烯还可以发生聚合反应。
聚合是将许多相同或不同的分子通过化学键连接在一起形成高分子化合物的过程。
乙烯可以通过聚合反应产生聚乙烯。
聚乙烯是一种具有高拉伸强度和耐磨性的塑料,在许多工业和商业应用中广泛使用。
乙烯的物理性质也受到其分子结构的影响。
由于乙烯的分子量相对较小,因此它是一种无色、无味、可燃的气体。
乙烯有较低的沸点和相对较高的熔点。
它在室温下是气体,但可以通过冷却或加压变为液体。
乙烯的密度比空气小,因此可以上升到空气中。
从化学稳定性的角度看,乙烯是一种相对不稳定的化合物。
由于其双键结构具有高能量,因此容易发生添加反应,并进一步转化为其他化合物。
此外,乙烯在大气中极易被氧化,因此容易燃烧。
乙烯和空气中的氧气在高温下反应,产生二氧化碳和水。
值得注意的是,乙烯对于环境和人类健康具有潜在的危害。
乙烯是一种危险的化学物质,长期接触可以导致呼吸系统疾病、癌症和中枢神经系统损伤等健康问题。
此外,乙烯还是温室气体的一种,对地球的气候变化起着重要作用。
总结起来,乙烯是一种具有双键结构的有机化合物,其结构决定了它在化学反应中的活性和物理性质。
乙烯可以进行加成反应和聚合反应,并具有一些特殊的化学和物理性质。
然而,乙烯的不稳定性和对环境和健康的潜在危害需要我们在使用和处理乙烯时保持警惕。


高中乙烯知识点乙烯是一种非常重要的有机化学物质,它是许多化学工业中生产的最基本的原材料之一,称为基础化学品,也是学习有机化学的基础。
乙烯的结构简单,但是却涉及到很多有机反应和实验室技巧。
在高中化学教学中,乙烯的键合、物理性质、化学反应和应用等方面的知识是非常重要的。
本文将从以下几个方面讨论高中乙烯的知识点。
乙烯的结构与性质乙烯的简单结构式为C2H4,由两个碳原子和四个氢原子组成。
在乙烯分子中,碳原子之间是双键成键,氢原子占据了碳原子上剩余可结合价电子的位置。
乙烯的物理性质非常重要。
它是无色、无臭、易挥发的气体,密度小于空气,可以被吸收或者溶解在水中。
乙烯需要以低温和高压的方式储存,通常在沼气、天然气和炼油等过程中提取。
乙烯的化学反应1. 加成反应乙烯通过加成反应,从而形成一系列有机化合物,如烷烃、醇、卤代烃、醛、酮等。
其中,最常见的乙烯加成反应是乙烯和氢气的加成反应,生成乙烷。
C2H4 + H2 --> C2H6同时,乙烯还可以与卤素原子(如氯、溴、碘等)发生加成反应,形成haloalkanes。
例如,乙烯和氯气反应可以得到1,2-二氯乙烷。
C2H4 + Cl2 --> CH2ClCH2Cl2. 氧化反应乙烯和氧气通常可以在高温和高压下发生氧化反应,生成乙烯醇或者乙醛。
例如,通过乙烯和水在高温和高压情况下的反应,可以得到乙烯醇。
C2H4 + H2O --高温高压--> C2H5OH3. 酸碱反应乙烯虽然是个不带离子的分子,但是却可以在一定的条件下发生酸碱反应。
比如,乙烯可以在氢氧化钠存在下形成乙烯基钠,再与卤素化合物进行烷化反应生成相应的烷基卤。
例如,乙烯和氯化氢反应可以得到1-氯乙烷。
C2H4 + NaOH --> CH2=CHNa + H2OCH2=CHNa + HCl --> CH3CH2Cl + NaCl乙烯的应用乙烯是化学工业中的重要原材料。
它是化学品和复合材料的制造基石,在生产聚丙烯、聚乙烯等塑料时发挥着至关重要的作用。
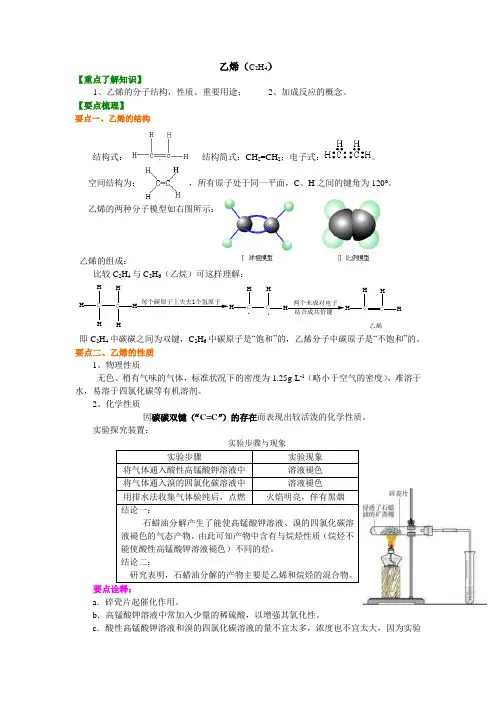
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。

石油化工的龙头——乙烯一、乙烯的组成和结构乙烯分子的结构简式:CH2〓 CH2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置①浓H2SO4的作用:催化剂、脱水剂。
②浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL酒精,再将15 mL浓硫酸缓缓地加入,并不断搅拌。
③由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(使溴水褪色)乙烯除了与溴之外还可以与H 2O 、H 2、卤化氢、Cl 2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H 2O 的加成反应而生成乙醇。
3)聚合反应nCH2=其中 CH 2=CH 2 为单体 —CH 2—CH 2— 为链节 n 为聚合度聚乙烯的分子很大,相对分子质量可达到几万到几十万。


乙烯知识点归纳总结乙烯,也称作乙烯烃,是一种无色气体,化学式为C2H4、以下是乙烯的知识点的归纳总结:1.结构和化学性质:-乙烯分子由两个碳原子和四个氢原子组成。
它属于不饱和烃,因为它含有双键。
-乙烯是一个高度反应性的化合物,可以发生多种化学反应。
它与氯气反应产生氯乙烯,与溴化氢反应产生溴乙烯,与水反应产生乙醇等。
-乙烯可以进行加聚反应,形成聚乙烯,是一种常见的塑料材料。
2.生产方法:-乙烯可以通过石油或天然气中的碳氢化合物进行热裂解或催化裂解得到。
-在热裂解过程中,碳氢化合物在高温下分解,生成乙烯和其他副产品。
热裂解常用的原料是轻质石脑油和天然气。
-催化裂解是在催化剂的作用下,将碳氢化合物在较低的温度和压力下转化为乙烯。
常用的催化剂包括氧化钙、氯化铝和氯化锆等。
3.应用领域:-聚乙烯是乙烯最重要的应用之一、由于其高强度、耐腐蚀性和良好的绝缘性能,聚乙烯被广泛用于塑料制品、包装材料、绝缘材料等。
-乙烯也用于生产乙烯醇、乙醛、聚乙烯醇等有机化合物。
-乙烯可以通过氧化反应制备乙二醇,乙二醇是一种重要的有机化学品,用于制造聚酯纤维和塑料。
-乙烯还可以用于生产乙酸乙酯、乙醇丙酮等化学品。
4.环境和安全问题:-乙烯是一种易燃气体,与空气形成混合物可形成爆炸。
-乙烯的燃烧会产生有毒气体,因此在储存、运输和使用乙烯时需要注意安全措施。
-乙烯的生产和使用过程会排放大量的温室气体,对环境造成负面影响。
因此,乙烯生产和使用的环保问题也需要引起重视。
以上是对乙烯的知识点的归纳总结。
乙烯作为一种重要的化学品,在塑料、化学工业等领域有广泛的应用。
然而,乙烯的生产和使用也面临诸多环境和安全问题,需要引起重视,并采取相应的措施加以解决。

高中化学乙烯知识点总结高中化学:乙烯知识点总结乙烯是一种重要的有机化合物,也是化学中的重要研究对象。
在高中化学中,乙烯是一个重要的知识点,本文将对乙烯的结构、性质、制备和应用等方面进行总结。
一、乙烯的结构乙烯的分子式为C2H4,由两个碳原子和四个氢原子组成。
乙烯的分子中有一个双键,双键的存在使得乙烯分子具有平面结构。
乙烯的分子式中只有两个碳原子,因此乙烯属于烯烃类化合物。
二、乙烯的性质1. 物理性质乙烯是一种无色、无味、易燃的气体,密度比空气小,可以溶于水和有机溶剂。
2. 化学性质乙烯是一种不稳定的化合物,容易发生加成反应、氧化反应、聚合反应等。
其中,加成反应是乙烯最常见的反应类型,乙烯可以与许多物质发生加成反应,如氢气、卤素、水等。
3. 燃烧性质乙烯是一种易燃气体,可以与氧气发生燃烧反应,生成二氧化碳和水。
乙烯的燃烧反应是放热反应,燃烧时会放出大量的热能。
三、乙烯的制备1. 从石油中提取乙烯是石油中的一种重要组分,可以通过石油的分馏和裂化等工艺提取得到。
2. 从天然气中提取天然气中也含有乙烯,可以通过天然气的分离和提纯等工艺提取得到。
3. 从乙烷中制备乙烯可以通过乙烷的脱氢反应制备得到,反应条件为高温高压下进行。
四、乙烯的应用1. 化工原料乙烯是化工生产中的重要原料,可以用于制备乙烯基聚合物、乙烯基共聚物、乙烯基化合物等。
2. 燃料乙烯可以作为燃料使用,可以用于发电、加热等。
3. 医药乙烯可以用于制备医药中的一些重要化合物,如乙烯基乙酸、乙烯基胺等。
4. 农业乙烯可以用于农业生产中,可以促进植物生长、提高产量等。
五、乙烯的环境影响乙烯是一种易燃气体,如果不妥善处理可能会对环境造成污染。
此外,乙烯的制备和使用也会产生一定的废气和废水,对环境造成一定的影响。
六、结语乙烯是一种重要的有机化合物,具有广泛的应用前景。
在高中化学中,学习乙烯的结构、性质、制备和应用等方面,可以帮助学生更好地理解有机化学的基本原理和应用。
乙烯知识点归纳总结一、乙烯的分子结构乙烯是一种无色、易燃、具有强烈气味的有机化合物,分子式为C2H4。
其结构式为H2C=CH2,乙烯分子是由两个碳原子和四个氢原子组成的,其中碳原子以双键连接,这是乙烯最重要的结构特征。
二、乙烯的物理性质乙烯是一种透明、无味的气体,具有强烈的刺激性。
其密度为0.925g/L,比空气轻。
在标准压力下,乙烯的沸点为-103.7℃,熔点为-100.6℃。
乙烯的溶解性较好,可以溶解在有机溶剂中。
三、乙烯的化学性质1、氧化反应:乙烯与氧气反应,生成环氧乙烷和水。
2、加成反应:乙烯与氢气反应,生成乙烷;与卤素单质反应,生成卤代烷;与水反应,生成乙醇。
3、聚合反应:乙烯在一定条件下可以聚合成高分子化合物。
4、裂解反应:在热和催化剂的作用下,乙烯发生裂解反应,生成小分子烯烃。
四、乙烯的制备主要通过石油裂解和天然气转化两种方法制备乙烯。
石油裂解是将石油中的长链烃断裂成乙烯的过程;天然气转化是将天然气转化为合成气,再进一步转化为乙烯的过程。
五、乙烯的应用1、制造聚合物:乙烯在聚合反应中生成高分子化合物,广泛用于制造塑料、纤维、橡胶等产品。
2、制造有机溶剂:乙烯与水反应生成乙醇,乙醇是一种良好的有机溶剂,可用于制造涂料、油漆等产品。
3、农业用途:乙烯是一种植物生长调节剂,可以促进植物生长和开花。
4、其他用途:乙烯还可用于制造乙醛、乙基胺等化学物质,以及用作制冷剂等。
六、乙烯的安全措施由于乙烯易燃、易爆,因此在处理和储存时应采取以下安全措施:1、储存于阴凉、通风的库房中,远离火源和热源。
2、避免与氧化剂、酸类物质混存。
3、使用防爆电气设备,并定期检查电线绝缘层是否完好。
4、使用前必须对设备进行彻底清洗和干燥,避免产生静电火花。
因式分解知识点归纳总结因式分解是数学中的一种重要技巧,它可以帮助我们简化计算,解决实际问题,并且还在数学竞赛中占有重要的地位。
因式分解就是把一个多项式分解为几个整式乘积的形式,它是一种重要的数学思维方法。
乙烯结构特点乙烯,也被称为乙烯烷,是一种无色、可燃的气体。
它是一种重要的有机化合物,由两个碳原子和四个氢原子组成,化学式为C2H4。
乙烯是一种不饱和的烃,具有特殊的结构特点和化学性质。
乙烯的分子结构特点主要体现在以下几个方面:1. 双键结构:乙烯分子由两个碳原子通过一个共享电子对连接在一起,形成了一个碳-碳双键。
这个双键使得乙烯具有不饱和的性质,并且使得乙烯的化学反应具有独特的特点和活性。
2. 线性结构:乙烯分子由两个碳原子和四个氢原子组成,呈线性排列。
这种线性结构使得乙烯分子更加稳定,并且具有较高的反应活性。
3. π电子云:乙烯的双键上存在一个π电子云,这个π电子云对于乙烯分子的性质具有重要影响。
π电子云使得乙烯分子具有共轭体系,具有较强的吸收紫外线的能力,并且在化学反应中容易发生电子迁移,从而影响了乙烯的反应性质。
乙烯的结构特点使其具有许多重要的应用和化学性质。
首先,乙烯是合成聚乙烯的原料,聚乙烯是一种重要的塑料材料,广泛应用于包装、建筑、电子等领域。
其次,乙烯可以通过加氢反应转化为乙烷,这是一种常用的工业反应。
乙烯还可以通过氧化反应制备乙烯醇、乙醛等化合物,这些化合物在化工领域有广泛的应用。
乙烯还具有一些特殊的化学性质。
由于乙烯分子中的π电子云,乙烯具有较强的亲电性和核磁性。
乙烯可以与许多化合物进行加成反应、取代反应、氧化反应等,形成不同的产物。
乙烯还可以通过聚合反应形成高分子化合物,如聚乙烯、聚丙烯等。
总结而言,乙烯具有双键结构、线性结构和π电子云等结构特点,这些特点使得乙烯具有不饱和性和较强的反应活性。
乙烯在化工领域有广泛的应用,是许多重要化合物的原料和中间体。
对于研究乙烯的结构特点和化学性质,有助于深入了解乙烯的应用和反应机理,从而推动相关领域的发展。