基础化学配位化合物
- 格式:pptx
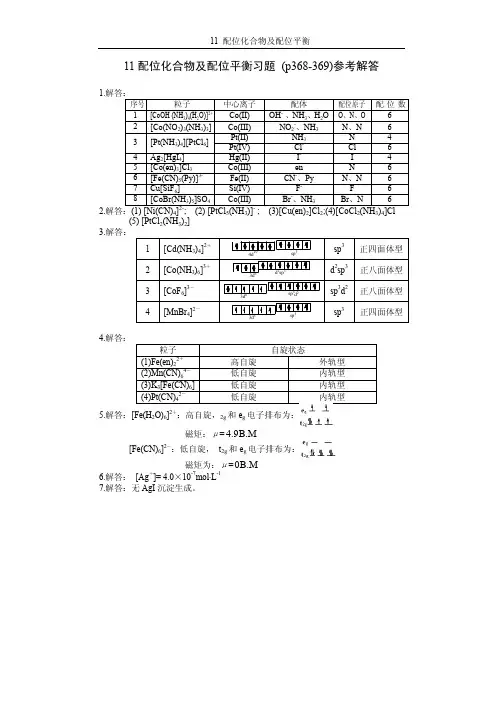
- 大小:623.12 KB
- 文档页数:68




第八章络合物(配位化合物)化学基础【竞赛要求】场理论。
Ti(H2O)36的颜色。
路易斯酸碱的概念。
【知识梳理】一、配合物基本知识1、配合物的定义由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
[Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
[Co(NH3)6]、[Cr(CN)6]也是配位化合物。
判断的关键在于是否含有配位单元。
思考:下列化合物中哪个是配合物①CuSO4·5H2O②K2PtCl6③KCl·CuCl2④Cu(NH2CH2COO)2⑤KCl·MgCl2·6H2O⑥Cu(CH3COO)2注意:①配合物和配离子的区别②配合物和复盐的区别2、配合物的组成中心离子内界单齿配体配位体多齿配体配合物螯合配体外界(1)配合物的内界和外界以[Cu(NH3)4]SO4为例:[Cu(NH3)4]2+SO24内界外界内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是-1-K可以无外界,如Ni(CO)4但不能没有内界,内外界之间是完全电离的。
(2)中心离子和配位体中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。
如Fe3+、Fe、Co、Ni、Cu、Co等,只要能提供接纳孤对电子的空轨道即可。
配位体:含有孤对电子的阴离子或分子。
如NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。
(3)配位原子和配位数配体中给出孤对电子与中心离子直接形成配位键的原子,叫配位原子。
配位单元中,中心离子周围与中心离子直接成键的配位原子的个数,叫配位数。
配位化合物[Cu(NH3)4]SO4的内界为[Cu(NH3)4]2+,中心Cu2+的周围有4个配体NH3,每个NH3中有1个N原子与Cu2+配位。

化学中的配位化合物化合物是由不同原子通过共价或离子键相互结合形成的物质,而配位化合物则是在这个基础上引入了一个中心离子,使得周围的分子(配体)以孪晶体的方式围绕中心离子达到稳定的结构。
配位化合物的结构一般有两种,一种是具有点群对称的配位化合物,形成简单、对称的分子结构,大部分金属的情况都可以用点群的理论来解释。
另一种是非点群对称的配位化合物,由于存在不对称的原子、分子轨道、配体偏离等因素,使得其结构更为复杂。
不同种类的配位化合物均有着精细的内部结构和相关的理论研究。
以下将简单介绍一些常见的配位化合物及其特性。
1. 氨基酸配合物氨基酸是生物体中基础的分子构成单元,能通过阳离子交换、水解、还原等方式形成两性离子、金属离子配合物等,而在生命的进化过程中扮演了重要的角色。
例如,在乳酸菌中形成的结晶化氢桥纤维素(HBNC)中,氧原子上存在的羧基(O-H)和羧酸根基相连形成具有羟基和羧基的链状结构,进而与其它羟基和尿酸等形成氢键和金属离子配合物。
这些配合物有着天然的抗氧化、生物酸等很好的保健作用。
2. 金属络合物金属络合物即为金属离子与配体发生协同作用形成的化合物。
一般来说,金属离子具有可导电性、电子电离能低、主量子数较低、容易失去电子等特性,而其与配体之间的协同作用则存在着多种络合键,如项链式、夹心戒指式、四面体结构等。
这些络合物往往具有一定的生物活性、化学稳定性和物理性能特征,同时也在催化、光催化等领域为人们所利用。
例如,著名的血红蛋白就是由铁离子与血红蛋白配体组成,具有保护红细胞、传递氧气等作用。
而且通过控制金属离子的丰度、配合物的带电性等可以实现多种功能,例如合成光致消除材料、催化剂及光电转换器件等等。
3. 铁与铜络合物铁与铜被广泛应用在催化剂、生物学等领域,其化学性质与络合物的结构密切相关。
铁与铜的化合物因其含有容易发生氧化还原反应的过渡金属离子而具有很大的生物活性;而其复杂的化学结构和理论分析则常常是人们探寻其性质的难点。

高考化学常见配位化合物化学是一门研究物质组成、性质和变化的科学,而配位化学则是化学中一个重要的分支。
配位化学是研究含有金属离子或金属原子与配位基(通常是带负电的原子团或分子)相互作用形成稳定化合物的学科。
在高考化学中,配位化合物也是一个重要的考点。
本文将介绍高考化学中常见的配位化合物。
1. [Fe(CN)6]4-:这是高考中常见的一个配位化合物。
它的结构为八面体形,铁离子(Fe2+)与六个氰根离子(CN-)配位形成。
该化合物稳定性很高,可以用作铁的标准溶液,也用于分析化学和生物化学实验中。
2. [Cu(NH3)4]2+:这是另一个高考中常见的配位化合物。
它的结构为正方形平面形,铜离子(Cu2+)与四个氨分子配位形成。
该化合物常用于铜盐的检测和分离,同时也可用来制备其他铜配合物。
3. [Ag(NH3)2]+:这个化合物是银阳离子与两个氨分子配位形成,它在高考化学实验中常用来检测和分析卤素离子(如氯离子、溴离子等)。
4. [Co(NH3)6]3+:这是一个典型的八面体配合物,其中钴离子(Co3+)与六个氨分子配位形成。
该化合物常用于有机合成中的氧化反应,同时也是高考中的重要考点。
5. [Ni(CO)4]:这是一个重要的四面体配合物,在其中镍离子(Ni2+)与四个一氧化碳配位形成。
该化合物是重要的工业催化剂,常用于有机合成反应中。
6. [PtCl2(NH3)2]:这是一个常见的方阵配合物,在其中铂离子(Pt2+)与两个氯离子(Cl-)和两个氨分子配位形成。
该化合物具有良好的溶解性,广泛用于医学和生物化学领域。
这些配位化合物是高考化学中常见的,理解它们的性质和应用对于高考化学的学习和应试非常重要。
除了上述提到的化合物,还有许多其他的配位化合物在高考中也有可能出现。
在学习高考化学时,要注重对配位化合物的分子结构、性质和配位基的影响等方面的理解。
此外,还需要掌握相关的实验操作和分析方法,以便在实际操作中可以正确使用配位化合物。


有机化学基础知识点配位化合物的结构和性质配位化合物是有机化学中一个重要的研究领域,它形成于配位键的形成和金属离子的配位,具有独特的结构和性质。
既然我们谈到了有机化学基础知识点,让我们来深入了解一下配位化合物的结构和性质。
一、配位化合物结构的基本特点配位化合物通常由一个中心金属离子和一些称为配体的分子或离子组成。
配体通常是有机化合物,具有不同的配位原子,如氮、氧、硫等。
它们通过配位键与中心金属离子结合。
1. 配位键的形成配位键是指配体的一个或多个配位原子与中心金属离子之间的共有电子对。
配位键的形成通常是由配位原子上的孤对电子(孤对电子是未参与共价键形成的电子对)与金属离子形成的。
例如,以水合铜离子Cu(H2O)6^2+为例,氧原子上的孤对电子直接与铜离子形成了配位键。
2. 配位数与配位体配位数是指配位原子或配体与中心金属离子之间的配位键数量。
根据配位数的不同,配位体可以分为双齿配体、三齿配体、四齿配体等。
例如,以乙二胺(NH2CH2CH2NH2)为配体的四氯合铜(II)配合物[CuCl2(NH2CH2CH2NH2)2]的配位数是六。
3. 配位化合物的空间构型配位化合物的空间构型由配位体的取向和排布所决定。
常见的空间构型有正方形平面型、八面体型等。
这些不同的空间构型会影响到化合物的性质和反应性。
二、配位化合物的性质配位化合物由于金属离子与配体之间的配位键的形成,使其具有一些独特的性质。
1. 形成稳定的络合化合物由于配位键的形成,配位化合物通常具有较高的稳定性。
这使得它们在催化、溶剂选择性和聚合物合成等方面具有广泛的应用。
2. 形成具有特定功能的配位聚合物配位化合物的结构可以通过合适的选择和设计配体,形成具有特定功能的配位聚合物。
这些聚合物在催化、传感、光电子等领域中有广泛的应用。
3. 光谱性质配位化合物常常具有丰富的光谱性质,如紫外可见吸收光谱、红外光谱、荧光光谱等。
这些光谱性质对于研究配位化合物的结构和反应机制具有重要意义。
