还原糖和总糖的测定
- 格式:doc
- 大小:164.50 KB
- 文档页数:5


实验一总糖和还原糖的测定(3,5-二硝基水杨酸法)171850044钱诗晨一、实验目的掌握还原糖和总糖的测定原理,学习用3,5-二硝基水杨酸法测定还原糖的方法。
二、实验原理单糖和某些寡糖含有游离的醛基或酮基,有还原性,属于还原糖;而多糖和蔗糖等属于非还原性糖。
利用多糖能被酸水解为单糖的性质可以通过测定水解后的单糖含量对总糖进行测定。
还原糖在碱性条件下被氧化成糖酸及其他产物,3,5-二硝基水杨酸(DNS)则被还原为红棕色的3-氨基-5-硝基水杨酸。
在过量的NaOH碱性溶液中此化合物呈橘红色,在540nm处一定浓度范围内还原糖的量与光吸收值呈线性关系,利用比色法可测定样品中的含糖量和总糖的含量。
三、实验器材1.面粉2.试管3.吸管4.水浴锅5.电炉6.紫外可见分光光度计7.PH试纸8.容量瓶9.量筒、研体、三角烧瓶、玻璃漏斗10.电子分析天平面粉里含多糖淀粉,遇碘变蓝四、实验试剂1.标准葡萄糖溶液(1.0mg/ml):准确称取干燥恒重的葡萄糖100mg,溶于蒸馏水并定容至100ml,混匀,4℃冰箱中保存备用。
2.3,5-二硝基水杨酸(DNS)试剂:将6.3gDNS和262ml2mol/L NaOH溶液,加到500ml含有185g酒石酸甲钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000ml贮于棕色瓶中备用。
3.6mol/L HCl:取250ml浓HCl(35%~38%),用蒸馏水稀释到500ml。
4.6mol/L NaOH:称取24g NaOH溶于蒸馏水并稀释至100ml。
5.碘—碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
五、实验操作1.葡萄糖标准溶液曲线的制作取干净试管6支,按表7进行操作。
以吸光度为纵坐标,各标准液浓度(mg/ml)为横坐标作图得标准曲线2.样品中还原糖的提取和测定准确称取1.0g红薯粉,加蒸馏水约10ml,在研体中磨成匀浆,转入三角烧瓶中,并用约30ml的蒸馏水冲洗研体2~3次,洗出液也转入三角烧瓶中。

第三章 基础实验(一)糖化学实验一 总糖和还原糖的测定(一)──费林试剂比色法目的要求掌握还原糖和总糖的测定原理,学习用直接滴定法测定还原糖的方法。
实验原理将一定量的碱性酒石酸铜甲液和乙液等体积混合时,硫酸铜与氢氧化钠反应,生成氢氧化铜沉淀:2NaOH + CuSO 4 = Cu(OH)2 + Na 2SO 4所生成的氢氧化铜沉淀与酒石酸钠反应,生成可溶性的酒石酸钾钠铜:在加热条件下,用样液滴定,样液中的还原糖与酒石酸钾钠铜反应,酒石酸钾钠铜被还原糖还原,产生红色氧化亚铜沉淀,还原糖则被氧化和降解,其反应如下:反应生成的氧化亚铜沉淀与费林试剂中的亚铁氰化钾(黄血盐)反应生成可溶性复盐,便于观察滴定终点。
Cu2O + K4Fe(CN)6 + H2O K2Cu2Fe(CN)6 + 2KOH(氧化亚铜)(淡黄色)滴定时以亚甲基蓝为氧化-还原指示剂。
因为亚甲基蓝氧化能力比二价铜弱,待二价铜离子全部被还原后,稍过量的还原糖可使蓝色的氧化型亚甲基蓝还原为无色的还原型的亚甲基蓝,即达滴定终点。
根据样液量可计算出还原糖含量。
试剂和器材一、试剂碱性酒石酸铜甲液:称取15g硫酸铜(CuSO4·5H2O)及0.05g亚甲基蓝,溶于蒸馏水中并稀释到1000ml。
碱性酒石酸铜乙液:称取50g酒石酸钾钠及75g NaOH,溶于蒸馏水中,再加入4g亚铁氰化钾[K4Fe(CN)6],完全溶解后,用蒸馏水稀释到1000ml,贮存于具橡皮塞玻璃瓶中。
0.1%葡萄糖标准溶液:准确称取1.000g经98~100℃干燥至恒重的无水葡萄糖,加蒸馏水溶解后移入1000ml容量瓶中,加入5ml浓HCl(防止微生物生长),用蒸馏水稀释到1000ml。
6mol/LHCl:取250ml浓HCl(35%~38%)用蒸馏水稀释到500ml。
碘-碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
6N NaOH:称取120gNaOH溶于500ml蒸馏水中。

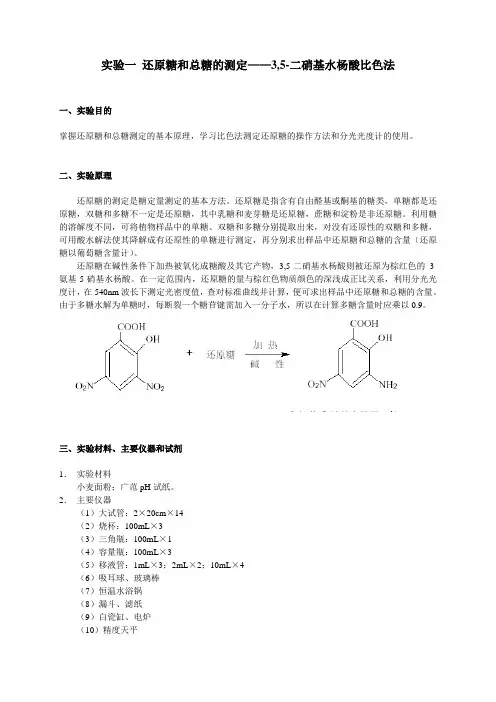
实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、实验目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1.实验材料小麦面粉;广范pH试纸。
2.主要仪器(1)大试管:2×20cm×14(2)烧杯:100mL×3(3)三角瓶:100mL×1(4)容量瓶:100mL×3(5)移液管:1mL×3;2mL×2;10mL×4(6)吸耳球、玻璃棒(7)恒温水浴锅(8)漏斗、滤纸(9)白瓷缸、电炉(10)精度天平(11)分光光度计3.试剂(已制备)(1)1mg/mL葡萄糖标准液准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3g 3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。


食品中转化糖(总糖)、还原糖的测定1安全性评估谨防试剂灼伤:加入碱性酒石酸铜甲乙液、20%氢氧化钠和2%盐酸试剂时,需佩戴一次性乳胶手套。
谨防玻璃割伤:使用前检查玻璃仪器外观完好无损,使用时注意轻拿轻放,清洗时,需佩戴防割手套。
谨防高温烫伤:滴定时,调节滴定管滴定速度的手需佩戴涂脂手套/一次性乳胶手套,且不裸露手腕皮肤,双手不碰及电陶炉表面。
2 目的规范食品中转化糖(总糖)、还原糖的检测流程,确保检测结果的准确性。
3 范围适用于各类食品中转化糖(总糖)、还原糖的测定。
4 依据参照GB 5009.7 - 2016食品安全国家标准食品中还原糖的测定、GB 5009.8 - 2016食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定。
5 检测原理还原糖(直接滴定法):试样经除去蛋白质后,在加热条件下,以亚甲基蓝作指示剂,滴定标定过的碱性酒石酸铜溶液(用葡萄糖标准溶液标定),根据样品液消耗体积计算还原糖含量。
转化糖(总糖)(酸水解-莱茵-埃农氏法):试样经除去蛋白质后,其中蔗糖经盐酸水解转化为还原糖,再按还原糖测定,根据样品液消耗体积计算转化糖(总糖)含量。
注:①为消除氧化亚铜沉淀对滴定终点观察的干扰,在碱性酒石酸铜乙液中加入少量亚铁氰化钾,使之与Cu2O生成可溶性的无色络合物,而不再析出红色沉淀,其反应如下:Cu2O↓+K4Fe(CN)6+H2O=K2Cu2Fe(CN)6+2KOH②碱性酒石酸铜甲液和乙液应分别贮存,用时才混合,否则酒石酸钾钠铜络合物长期在碱性条件下会慢慢分解析出氧化亚铜沉淀,使试剂有效浓度降低。
6 试剂和仪器:实验室三级用水6.1 试剂2 %盐酸溶液,20 %氢氧化钠溶液,碱性酒石酸铜溶液:碱性酒石酸铜甲液(以下简称A 液)(硫酸铜+亚甲基蓝)+碱性酒石酸铜乙液(以下简称B液)(酒石酸钾钠+氢氧化钠+亚铁氰化钾),乙酸锌溶液(219 g/L),亚铁氰化钾溶液(106 g/L),葡萄糖标准溶液。

实验一还原糖和总糖含量的测定一、实验目的1、了解还原糖和总糖含量的测定原理,熟悉实验步骤。
2、掌握还原糖和总糖含量的测定方法。
二、实验项目及所用仪器1、还原糖:Benedict试剂,烧杯,伏安电极,示波器,旋涡振荡仪;2、总糖:滤纸、热板、氧化棉芯,旋涡振荡仪。
三、实验原理1、还原糖:Benedict试剂由碳酸锰盐溶液、碳酸铵溶液、氯化钠溶液和抗上皮染料橙Ⅲ组成。
当还原糖作用于Benedict试剂时,会与其中的锰离子发生反应,生成蓝色配体,从而使抗上皮染料橙Ⅲ发生变色;2、总糖:将样品与氧化棉芯一起置于热板中,加热到900℃时,碳水化合物在此温度条件下完全分解为糖和水,糖与热板表面发生热反应而分解,引起氧化棉芯之上有显著黑色浓缩形成,即糖皿现象,根据糖皿质量来推算样品中碳水化合物的质量。
四、实验步骤1、还原糖测定:(1)将1ml Benedict溶液放至烧杯中;(2)向烧杯中加入1ml样品液体,根据不同液体不同加入2-3滴 (液体较稠时) 或1-2滴 (液体较洁时) 酸碱度调节液;(3)将伏安电极组件放入烧杯中,并选取示波器连接;(4)加热26℃下水浴加热,取示波器时加热过程中的电势;(5)检测峰面上的电势,来比较是否有变色;(6)如果有变色,就用旋涡振荡仪对发生变色的液体测定样品含有的还原糖含量。
(1)将样品5ml液体流入滤纸中,滤取液体;(2)将滤取的液体均匀的淋洒在氧化棉芯之上,并将其置于热板之上;(3)将热板加热,观察过程中糖皿现象的变化,双环现象表示反应完成;五、结果计算还原糖:检测变色后用旋涡振荡仪测定吸光度值,用标准曲线求出浓度;总糖:使用朱诺重量比法称取峰面上的焦灰,根据标准曲线求出浓度,以重量比计算样品中碳水合物的含量。
六、安全措施1、食品分析实验中,需要遵守实验室安全规章制度,具体包括:实验前应安全检查仪器,按要求穿防护服、佩戴护目镜,使用专用工具等;2、使用热源时,需要注意:电源线耐热、工作在室内,不能离开,保持室内通风;3、使用化学试剂时,应具备良好的操作习惯,佩戴护手镯、护目镜,禁止吞咽及外用,实验结束后将试剂放回原位,实验结束后要做好清洗工作。

总糖和还原糖的测定(3,5—二硝基水杨酸法)实验报告前言糖在我们日常生活中随处可见,我们吃的米饭、水果、零食中或多或少都含有一些糖类。
同时,糖也是我们维持机体运动所必不可少的物质,没有了它,就没有了能量的来源。
我们这次便走进实验室探索糖类的奥秘。
本次实验我们将用3,5—二硝基水杨酸法测定总糖和还原糖中的含糖量。
本次实验中,我们除了要掌握还原糖和总糖的测定基本原理还要学习比色法测定还原糖的操作方法以及分光度法测定的原理和方法。
首先,让我们一起来了解一下它们的测定方法吧。
还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
一、实验目的1、掌握还原糖和总糖的测定的基本原理2、学习比色法测定还原糖的操作方法3、学习分光光度法测定的原理和方法二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
基础生物化学实验-实验2 还原糖及总糖的测定实验2 还原糖及总糖的测定(3、5——二硝水杨酸比色法)目的和要求:掌握3、5-二硝基水杨酸比色法测定糖量的原理及方法。
熟悉722分光光度计基本工作原理和操作方法。
原理:各种单糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,再用酸水解法使没有还原性的双糖和多糖彻底水解成有还原性的单糖。
在碱性条件下,还原糖与3、5—二硝基水杨酸共热,3、5—二硝基水杨酸被还原为3-氨基-5-硝基水杨酸(棕红色物质),还原糖则被氧化成糖酸及其它物质。
在一定范围内,还原糖的量与棕红色物质颜色深浅的程度成一定的比例关系,可在722型分光光度计540nm波长测定棕红色物质的消光值。
查标准曲线计算,便可分别求出样品中还原糖和总糖的含量。
多糖水解时,在单糖残基上加了一分子水,因而在计算中须扣除已加入的水量,测得所得到的总糖量乘以0.9即为实际的总糖量。
该方法是半微量定糖法,操作简便,快速,杂质干扰较少。
试剂和材料:试剂(1)1mg/ml葡萄糖标准液:准确称取100ml分析纯葡萄糖(预先在105℃烘至恒重),置于小烧杯中,用少量蒸馏水溶解后,定量转移到100ml容量瓶中,以蒸馏水定容到刻度,摇匀,冰箱中保存备用。
(2)3、5—二硝基水杨酸试剂(又称DNS试剂);甲液——溶解6.9g结晶酚(苯酚)于15.2ml 10%NaOH中,并稀释至69ml,在此溶液中加入6.9g 亚硫酸氢钠。
乙液——称取22.5g酒石酸钾钠,加到300ml 10% NaOH中,再加入880ml 1%的3、5—二硝基水杨酸溶液。
将甲液和乙液相混合即得黄色试剂,贮于棕色试剂瓶中,放置7—10天使用。
(3)碘—碘化钾溶液(碘试剂):称取5g碘和10g碘化钾,研匀后溶于100ml蒸馏水中。
(4)酚酞指示剂:称取0.1g酚酞溶于70%乙醇中。
(5)6 mol·L-1 HCl(6)6 mol·L-1NaOH(7)面粉2、器材大试管、大离心管、量筒、三角瓶、容量瓶、刻度吸管、玻璃漏斗、滤纸、白瓷板、电热恒温水浴槽、低速台式离心机、天平、722型分光光度计。

实验二总糖和还原糖的测定1实验目的:通过化学反应,定量测定果汁、蜂蜜和其他实验样品中的总糖和还原糖含量。
实验原理:总糖是指以糖为主要成分的物质。
而还原糖是指那些具有还原性质,并能够将还原铜离子还原为沉淀的单糖和双糖类糖分。
还原糖在碱性溶液中容易还原铜离子,产生还原铜沉淀,这种化学反应叫做费林试剂反应。
2.费林试剂反应原理费林试剂是由铜离子(Cu2+)、草酰肼和钠碱组成的混合物。
在碱性条件下,草酰肼被还原成草酸,同时将 Cu2+ 还原为 Cu+ 并生成棕色的沉淀。
当样品中加入碱性费林试剂时,还原性糖分(如果糖、葡萄糖等)能够将 Cu2+ 还原为 Cu+,从而生成棕色的沉淀。
这个过程是一个可以定量的过程,衡量沉淀的多少就能够推算出溶液中还原性糖分的含量。
另外,总糖含量的计算是通过使用苏丹III试剂实现的。
实验器材:1.量筒2.移液管3.试管4.洗瓶5.恒温摇床6.温度计1.果汁2.蜂蜜3.标准葡萄糖溶液4.碳酸钠5.草酰肼6.苏丹III试剂7.浓硫酸实验步骤:1.总糖的测定:取一定量的果汁样品,用量筒量取 10 毫升到试管中,再加入 2 - 3 滴苏丹III 试剂,晃动均匀。
在搅拌下加入 5 - 10 滴浓硫酸,并再次使试管均匀地摇晃。
静止 5 分钟,颜色稳定后,在光谱计中读取样品的吸光度。
取一定量的果汁样品,用量筒量取 10 毫升入 50 毫升锥形瓶中,再加入 15 毫升碳酸钠。
轻轻振摇均匀后,再将 5 毫升草酰肼溶液滴入锥形瓶中。
接下来,用标准葡萄糖溶液调节光密度值,以达到与实验样品相同的吸光度比值。
从光谱计中记录每个样品反应的吸光度。
实验注意事项:1.实验操作要认真,保证实验片刻的稳定,确保实验数据的准确。
2.注意光源是光谱计的重要组成部分,因此要记得把光源打开,以确保性能。
总结:通过总糖和还原糖的测定,我们可以测定样品的果糖、葡萄糖等还原糖分的含量,以及样品中糖类总含量的含量。
这对于分析果汁和蜂蜜等样品非常有用,也为食品行业提供了重要的检测方法和标准。
实验二、总糖和还原糖的测定(一)──费林试剂热滴定法目的要求掌握还原糖和总糖的测定原理,学习用直接滴定法测定还原糖的方法。
实验原理还原糖是指含有自由醛基(如葡萄糖)或酮基(如果糖)的单糖和某些二糖(如乳糖和麦芽糖)。
在碱性溶液中,还原糖能将Cu2+、Hg2+、Fe3+、Ag+等金属离子还原,而糖本身被氧化成糖酸及其他产物。
糖类的这种性质常被用于糖的定性和定量测定。
本实验采用费林试剂热滴定法。
费林试剂由甲、乙两种溶液组成。
甲液含硫酸铜和亚甲基蓝(氧化还原指示剂);乙液含氢氧化钠,酒石酸钾钠和亚铁氰化钾。
将一定量的甲液和乙液等体积混合时,硫酸铜与氢氧化钠反应,生成氢氧化铜沉淀:2NaOH + CuSO4 = Cu(OH)2+ Na2SO4在碱性溶液中,所生成的氢氧化铜沉淀与酒石酸钠反应,生成可溶性的络合物酒石酸钾钠铜:在加热条件下,用样液滴定,样液中的还原糖与酒石酸钾钠铜反应,酒石酸钾钠铜被还原糖还原,产生红色氧化亚铜沉淀,其反应如下:反应生成的氧化亚铜沉淀与费林试剂中的亚铁氰化钾(黄血盐)反应生成可溶性复盐,便于观察滴定终点。
Cu2O + K4Fe(CN)6 + H2O K2Cu2Fe(CN)6 + 2KOH滴定时以亚甲基蓝为氧化-还原指示剂。
因为亚甲基蓝氧化能力比二价铜弱,待二价铜离子全部被还原后,稍过量的还原糖可使蓝色的氧化型亚甲基蓝还原为无色的还原型的亚甲基蓝,即达滴定终点。
根据样液量可计算出还原糖含量。
试剂和器材一、试剂费林试剂:甲液:称取15g硫酸铜(CuSO4·5H2O)及0.05g亚甲基蓝,溶于蒸馏水中并稀释到1000mL。
乙液:称取50g酒石酸钾钠及75g NaOH,溶于蒸馏水中,再加入4g亚铁氰化钾[K4Fe(CN)6],完全溶解后,用蒸馏水稀释到1000mL,贮存于具橡皮塞玻璃瓶中。
0.1%葡萄糖标准溶液:准确称取1.000g经98~100℃干燥至恒重的无水葡萄糖,加蒸馏水溶解后移入100 0mL容量瓶中,加入5mL浓HCl(防止微生物生长),用蒸馏水稀释到1000mL。
总糖和还原糖的测定──3,5-二硝基水杨酸法目的要求:掌握还原糖和总糖的测定原理,学习用比色法测定还原糖的方法。
实验原理:在NaOH和丙三醇存在下,3,5-二硝基水杨酸(DNS)与还原糖共热后被还原生成氨基化合物。
在过量的NaOH碱性溶液中此化合物呈桔红色,在540nm波长处有最大吸收,在一定的浓度范围内,还原糖的量与光吸收值呈线性关系,利用比色法可测定样品中的含糖量。
黄色桔红色试剂和器材一、试剂3,5-二硝基水杨酸(DNS)试剂:称取6.5g DNS溶于少量热蒸馏水中,溶解后移入1000ml容量瓶中,加入2mol/L氢氧化钠溶液325ml,再加入45g丙三醇,摇匀,冷却后定容至1000ml。
葡萄糖标准溶液:准确称取干燥恒重的葡萄糖200mg,加少量蒸馏水溶解后,以蒸馏水定容至100ml,即含葡萄糖为2.0mg/ml。
6mol/L HCl:取250ml浓HCl(35%~38%)用蒸馏水稀释到500ml。
碘-碘化钾溶液:称取5g碘,10g碘化钾溶于100ml蒸馏水中。
6N NaOH:称取120g NaOH溶于500ml蒸馏水中。
0.1% 酚酞指示剂。
二、材料藕粉,小麦淀粉或玉米淀粉。
三、器材723PC、S22型分光光度计,天平,水浴锅,电炉,试管若干等。
一、葡萄糖标准曲线制作取5支15mm×180mm试管,按下表加入2.0mg/ml葡萄糖标准液和蒸馏水。
管号葡萄糖标准液蒸馏水葡萄糖含量OD540 /ml /ml /mg0 1 00.210.80.42 0.4 0.6 0.83 0.6 0.4 1.24 0.8 0.2 1.65 1 0 2操作方法在上述试管中分别加入DNS试剂2.0ml,于沸水浴中加热2min进行显色,取出后用流动水迅速冷却,各加入蒸馏水9.0ml,摇匀,在540nm波长处测定光吸收值。
以1.0ml蒸馏水代替葡萄糖标准液按同样显色操作为空白调零点。
以葡萄糖含量(mg)为横坐标,光吸收值为纵坐标,绘制标准曲线。
还原糖和总糖的测定3,5-二硝基水杨酸比色法一、目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1. 实验材料小麦面粉;精密pH 试纸。
2. 主要仪器(1)具塞玻璃刻度试管:20mL×11(2)大离心管:50mL×2(3)烧杯:100mL×1(4)三角瓶:100mL×1(5)容量瓶:100mL×3(6)刻度吸管:1mL×1;2mL×2;10mL×1(7)恒温水浴锅(8)沸水浴(9)离心机(10)扭力天平(11)分光光度计3. 试剂(1)1mg/mL 葡萄糖标准液准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL 容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3gDNS 和262mL 2M NaOH 溶液,加到500mL含有185g 酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
生物化学综合实验报告
题目:3,5-二硝基水杨酸比色法测定还原糖和总糖
姓名:
学号:
同组成员:
分院(系):
专业班级:
指导教师:
完成日期:年
月日
1.实验目的
用比色法测定山芋中还原糖和总糖含量
2.实验原理
先用已知浓度的葡萄糖标准溶液与DNS反应测其分光度,制得标准曲线,在测山芋中糖与DNS反应后的分光度A从而得其总糖和还原糖含量。
3.实验仪器和试剂
试剂:1g/L葡萄糖标准液、3,5-二硝基水杨酸、6mol/L HCl,6mol/L NaOH
仪器:25,100ml容量瓶、1,5ml吸量管、50ml移液管、100ml 量筒、试管、滴管、离心管、玻璃棒、洗耳球、100ml容量瓶、比色皿离心机、分光光度计、恒温水箱
4.实验步骤
一、取六只比色管向其中加入葡萄糖标液0、0.2、0.4、0.6、
0.8、1.0毫升在加入蒸馏水2.0、1.8、1.6、1.4、1.2、1.0毫升,最后向其中各加入DNS试剂1.5毫升混合均匀后100摄恒温水浴5min,冷却后加入蒸馏水至25ml刻度线,用1号样调零,测其分光度,制得标准曲线。
二、还原糖提取:取3g山芋粉,加入30ml水,搅匀后在50摄水中保温20min,离心,取滤液,用100ml容量瓶定容得还原糖待测液。
总糖提取:取0.2克山芋粉,加入试管中吸取5ml HCL溶液,8ml蒸馏水搅匀,100摄下恒温水浴30min,冷却,NaOH调节PH至中性,离心,滤液用100ml容量瓶定容,得总糖待测液。
测定时取5支比色管分别加入还原糖0、1.0、1.0、0、0毫升,总糖0、0、0、0.5、0.5毫升,蒸馏水2.0、1.0、1.0、1.5、1.5毫升,DNS试剂1.5毫升100摄恒温水浴5min后冷却,稀释至25毫升用一号管调节分光度为0,测总糖和还原糖的分光度。
5数据处理
测量得还原糖和总糖:
m还原糖=0.4235*(A6+A6’)/2=0.0019mg
m总糖=0.4235*(A7+A7’)/2=0.1910mg
ω还原糖=m曲线葡萄糖*(V总/V测)/m样品*100% ω还原糖=0.0019*(100/1)/3000*100%=0.0063% ω总糖=m曲线葡萄糖*(V总/V测)/m样品*100% ω总糖=0.191*(100/0.5)/200*100%=19.1%
6.注意事项
⏹离心时中心对称的离心管质量要基本相等
⏹可以增加山芋粉的质量来使得还原糖易于测量
7.思考题
⏹DNS比色法是如何对总糖进行测定的?
用HCl水解总糖中的非还原性糖从而得到还原糖进而测其所含的量
⏹绘制标准曲线时所取得物质质量和体积必须精确,标准物
质浓度不能过高否则与分光度不成线性关系,在测分光度前必须用空白样调零等等。