总糖和还原糖的测定讲课稿
- 格式:doc
- 大小:49.50 KB
- 文档页数:5


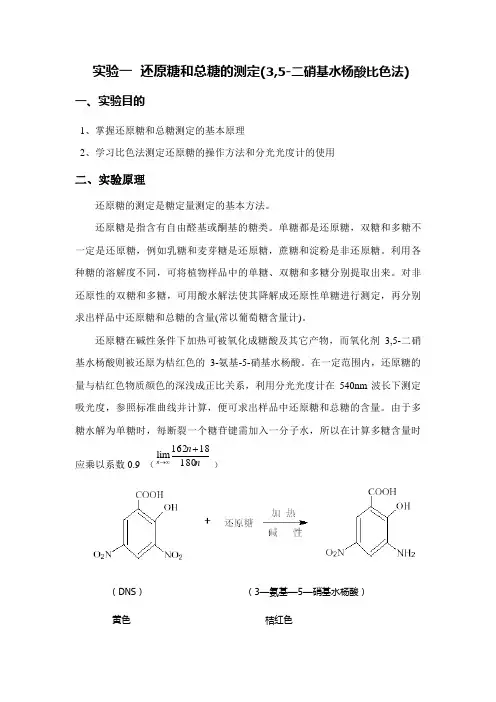
实验一 还原糖和总糖的测定(3,5-二硝基水杨酸比色法)一、实验目的1、掌握还原糖和总糖测定的基本原理2、学习比色法测定还原糖的操作方法和分光光度计的使用二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类。
单糖都是还原糖,双糖和多糖不一定是还原糖,例如乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用各种糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来。
对非还原性的双糖和多糖,可用酸水解法使其降解成还原性单糖进行测定,再分别求出样品中还原糖和总糖的含量(常以葡萄糖含量计)。
还原糖在碱性条件下加热可被氧化成糖酸及其它产物,而氧化剂3,5-二硝基水杨酸则被还原为桔红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与桔红色物质颜色的深浅成正比关系,利用分光光度计在540nm 波长下测定吸光度,参照标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以系数0.9 (n n n 18018162lim+∞→ )(DNS ) (3—氨基—5—硝基水杨酸) 黄色 桔红色三、实验材料和仪器1、实验材料面粉;1mg/mL葡萄糖标准液;3,5-二硝基水杨酸(DNS)试剂;碘-碘化钾溶液;酚酞指示剂;6mol/L HCl;6mol/L NaOH;2mol/L NaOH。
2、实验仪器试管:15mm×180mm×12;烧杯:100mL×6,500mL×1,锥形瓶:100mL×1;容量瓶:100mL×3 ,25mL×1;吸量管:10mL×3,2mL×3,1mL×3;恒温水浴锅;900mL烧杯(或不锈钢杯子)×1;载玻片;玻璃棒;胶头滴管;分光光度计;漏斗;滤纸;试管架;擦镜纸;电子天平等。
四、实验过程1.样品溶液制作(1)还原糖的提取用100mL烧杯准确称取0.65g面粉,先用少量蒸馏水调成糊状,然后加入15mL蒸馏水,搅匀,置50℃恒温水中保温20min,并不断搅拌,使还原糖浸出。


实验二还原糖及总糖的测定(3、5——二硝水杨酸比色法)目的和要求:1.掌握3、5-二硝基水杨酸比色法测定糖量的原理及方法。
2.熟悉722分光光度计基本工作原理和操作方法。
原理:各种单糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,再用酸水解法使没有还原性的双糖和多糖彻底水解成有还原性的单糖。
在碱性条件下,还原糖与3、5—二硝基水杨酸共热,3、5—二硝基水杨酸被还原为3-氨基-5-硝基水杨酸(棕红色物质),还原糖则被氧化成糖酸及其它物质。
在一定范围内,还原糖的量与棕红色物质颜色深浅的程度成一定的比例关系,可在分光光度计540nm波长测定棕红色物质的吸光值。
查标准曲线计算,便可分别求出样品中还原糖和总糖的含量。
多糖水解时,在单糖残基上加了一分子水,因而在计算中须扣除已加入的水量,测得所得到的总糖量乘以0.9即为实际的总糖量。
该方法是半微量定糖法,操作简便,快速,杂质干扰较少。
试剂和材料:1.试剂(1)1mg/ml葡萄糖标准液:准确称取100ml分析纯葡萄糖(预先在105℃烘至恒重),置于小烧杯中,用少量蒸馏水溶解后,定量转移到100ml容量瓶中,以蒸馏水定容到刻度,摇匀,冰箱中保存备用。
(2)3、5—二硝基水杨酸试剂(又称DNS试剂)甲液——溶解6.9g结晶酚(苯酚)于15.2ml 10%NaOH中,并稀释至69ml,在此溶液中加入6.9g亚硫酸氢钠。
乙液——称取22.5g酒石酸钾钠,加到300ml 10% NaOH中,再加入880ml 1%的3、5—二硝基水杨酸溶液。
将甲液和乙液相混合即得黄色试剂,贮于棕色试剂瓶中,放置7—10天使用。
(3)碘—碘化钾溶液(碘试剂):称取5g碘和10g碘化钾,研匀后溶于100ml蒸馏水中。
(4)酚酞指示剂:称取0.1g酚酞溶于70%乙醇中。
(5)6 mol·L-1 HCl(6)6 mol·L-1NaOH(7)面粉2.器材比色管、离心管、量筒、三角瓶、容量瓶、刻度吸管、玻璃漏斗、滤纸、白瓷板、电热恒温水浴槽、离心机、天平、分光光度计。



葡萄酒(汁)的总糖、还原糖测定1. 必要性监控糖含量对于葡萄酒生产来说至关重要!可以区分酒类型,反映酒风味,利于控制生产,决定工艺参数。
① 葡萄浆果:监测成熟度变化,确定最佳采收期;② 葡萄醪:了解葡萄酒可能的酒度,决定是否人为提高酒度及加糖量; ③ 葡萄酒:了解酒精发酵是否完全,区分酒的类型2. 基础葡萄汁和葡萄酒中的糖,按氧化还原性质分为还原性糖和非还原性糖,二者加和为总糖。
还原糖:能与碱性铜液,汞液发生还原作用的糖;如葡萄糖、果糖等发酵性糖,阿拉伯糖、木糖等非发酵性糖;非还原糖:如蔗糖、海藻糖;残糖(RS ):干型葡萄酒中的非发酵性糖和微量发酵性糖。
3. 测定方法① 比重计法:一般葡萄酒糖度(g/L )=(比重计读数一1000)×2+16先除酒精再恢复到取样体积的葡萄酒糖度(g/L )=(比重计读数一1000)×2-14② 糖量计法③ 光谱法:紫外可见(酶法)④ 色谱法:HPLC⑤ 费林试剂热滴定法:利用某些糖的还原性能,将某些重金属在碱性条 件下迅速还原,然后从被反应的重金属数量来求知糖分的数量。
4. 费林试剂热滴定法(1) 原理:天蓝色氢氧化铜、深蓝色酒石酸钾钠铜,Cu 2+将葡萄糖氧化为葡萄糖酸,Cu 2+被还原为Cu 2O 红色沉淀;酸解以测定总糖。
(2) 次甲基蓝:氧化态时蓝色,还原态时无色;(3) 样品制备① 总糖:将非还原糖酸解为还原糖;稀释酒样——5mL HCl——68℃15min——补水——200 g/L NaOH 中和;② 还原糖:稀释至浓度2~4 g/L.(4) 菲林试剂A 、B 液标定① 预备实验:初步确定费林氏A 、B 液各5mL 能与葡萄糖标液反应的体积; 5 mL A 液 + 5 mL B 液—— 50 mL 水——滴加葡标液致出现红色——次甲基蓝2滴——滴加葡标液致蓝色消失为无色,记录消耗葡标液体积V 0;② 正式试验:精确测定费林氏A 、B 液各5mL 能与葡萄糖标液反应的体积;5 mL A 液 + 5 mL B 液 + (V 0-1)葡标液—— 50 mL 水——沸腾2 min——出现红色加次甲基蓝2滴——1min 内,滴加葡标液致蓝色消失为无色,记录消耗葡标液体积V 1;重复得到V 2、V 3。

总糖和还原糖的测定──费林试剂热滴定法目的要求:掌握还原糖和总糖的测定原理,学习用直接滴定法测定还原糖的方法。
实验原理:还原糖是指含有自由醛基(如葡萄糖)或酮基(如果糖)的单糖和某些二糖(如乳糖和麦芽糖)。
在碱性溶液中,还原糖能将Cu2+、Hg2+、Fe3+、Ag+等金属离子还原,而糖本身被氧化成糖酸及其他产物。
糖类的这种性质常被用于糖的定性和定量测定。
本实验采用费林试剂热滴定法。
费林试剂由甲、乙两种溶液组成。
甲液含硫酸铜和亚甲基蓝(氧化还原指示剂);乙液含氢氧化钠,酒石酸钾钠和亚铁氰化钾。
将一定量的甲液和乙液等体积混合时,硫酸铜与氢氧化钠反应,生成氢氧化铜沉淀:2NaOH + CuSO4 = Cu(OH)2+ Na2SO4在碱性溶液中,所生成的氢氧化铜沉淀与酒石酸钠反应,生成可溶性的络合物酒石酸钾钠铜:反应生成的氧化亚铜沉淀与费林试剂中的亚铁氰化钾(黄血盐)反应生成可溶性复盐,便于观察滴定终点。
Cu2O + K4Fe(CN)6 + H2OCu2O + K4Fe(CN)6 + H2OK2Cu2Fe(CN)6 + 2KOH滴定时以亚甲基蓝为氧化-还原指示剂。
因为亚甲基蓝氧化能力比二价铜弱,待二价铜离子全部被还原后,稍过量的还原糖可使蓝色的氧化型亚甲基蓝还原为无色的还原型的亚甲基蓝,即达滴定终点。
根据样液量可计算出还原糖含量。
试剂和器材:一、试剂费林试剂:甲液:称取15g硫酸铜(CuSO4·5H2O)及0.05g亚甲基蓝,溶于蒸馏水中并稀释到1000mL。
乙液:称取50g酒石酸钾钠及75g NaOH,溶于蒸馏水中,再加入4g亚铁氰化钾[K4Fe (CN)6],完全溶解后,用蒸馏水稀释到1000mL,贮存于具橡皮塞玻璃瓶中。
0.1%葡萄糖标准溶液:准确称取1.000g经98~100℃干燥至恒重的无水葡萄糖,加蒸馏水溶解后移入1000mL容量瓶中,加入5mL浓HCl(防止微生物生长),用蒸馏水稀释到1000mL。


总糖和还原糖的测定(3,5—二硝基水杨酸法)实验报告
前言
糖在我们日常生活中随处可见,我们吃的米饭、水果、零食中或多或少都含有一些糖类。
同时,糖也是我们维持机体运动所必不可少的物质,没有了它,就没有了能量的来源。
我们这次便走进实验室探索糖类的奥秘。
本次实验我们将用3,5—二硝基水杨酸法测定总糖和还原糖中的含糖量。
本次实验中,我们除了要掌握还原糖和总糖的测定基本原理还要学习比色法测定还原糖的操作方法以及分光度法测定的原理和方法。
首先,让我们一起来了解一下它们的测定方法吧。
还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
一、实验目的
1、掌握还原糖和总糖的测定的基本原理
2、学习比色法测定还原糖的操作方法
3、学习分光光度法测定的原理和方法
二、实验原理
还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、材料与器具的准备。
实验材料:面粉。
实验试剂
(1)、1mg/mL葡萄糖标准液
准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)、3,5-二硝基水杨酸(DNS)试剂
将6.3g DNS和262mL 2M NaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
(3)、碘-碘化钾溶液:称取5g碘和10g碘化钾,溶于100mL蒸馏水中。
(4)、酚酞指示剂:称取0.1g酚酞,溶于250mL 70%乙醇中。
(5)、6M HCl和6M NaOH各100mL。
实验器材
(1)具塞玻璃刻度试管:20mL×11
(2)大离心管:50mL×2
(3)烧杯:100mL×1
(4)三角瓶:100mL×1
(5)容量瓶:100mL×3
(6)刻度吸管:1mL×1;2mL×2;10mL×1
(7)恒温水浴锅
(8)沸水浴
(9)分光光度计
分光光度计的基本原理是溶液中的物质在光的照射下,产生了对光吸收的效应,物质对光的吸收是具有选择性的。
各种不同的物质都具有其各自的吸收光谱,因此当某单色光通过溶液时,其能量就会被吸收而减弱,光能量减弱的程度和物质的浓度有一定的比例关系,也即符合比色原理——Lambert-Beer's law: 数学表达式:
A=lg(1/T)=KCL
A为吸光度 T为透射率,是投射光强度比上入射光强度
C为吸光物质的浓度L为吸收层厚度K为吸收系数物理意义是当一束平行单色光垂直通过某一均匀非散射的西光物质时,其吸光度A与吸光物质的浓度C及吸收层厚度L成正比.
四、实验步骤。
器材与材料准备完毕之后,便开始按照以下步骤进行实验。
首先,制作葡萄糖标准曲线。
取6支20mL 具塞刻度试管编号,按下表分别加入浓度为1mg/mL 的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
接下来,提取还原糖。
准确称取2.00g 食用面粉,放入100mL 烧杯中,先用少量蒸馏水调成糊状,然后加入50mL 蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。
过滤,将滤液收集在100ml容量瓶中,用蒸馏水定容至刻度,混匀,作为还原糖待测液。
紧接着,提取总糖。
准确称取1.00g食用面粉,放入100mL三角瓶中,加15mL蒸馏水及10mL 6M HCl,置沸水浴中加热水解30min(水解是否完全可用碘-碘化钾溶液检查)。
待三角瓶中的水解液冷却后,加入 1 滴酚酞指示剂,用6mol/LNaOH 中和至微红色,用蒸馏水定容在100mL容量瓶中,混匀。
将定容后的水解液过滤,取滤液10mL,移入另一100mL容量瓶中定容,混匀,作为总糖待测液。
然后,取4支20mL 具塞刻度试管,编号,6、7、8、9,按下表所示分别加入待测液和显色剂。
波长。
再按MODE键切换到T,将黑体放入光路中,合上盖,0键校零。
再按MODE 键切换到A,将倒入比色皿中的0号液体放入到光路中,合上盖,100键校零。
再将倒入比色皿中的各号液体放入到光路中即可测得光密度值。
五、注意事项:
1、每次测量前检查,检查波长是否所需值;
2、比色皿应拿磨砂面,不可用手接触透光面;
3、比色皿在盛装样品前,应用所盛样品冲洗两次,装样量为比色皿的2/3容积;
4、向比色皿加样时,若样品流到比色皿外壁时,应用滤纸点干,切忌用滤纸擦拭,以免比色皿出现划痕;
5、测量结束后应用蒸馏水清洗比色皿,清洗干净后放起.
六、数据处理。
y = 0.3557x - 0.0172
根据公式可以算得还原糖为0.27mg总糖为2.07mg.
则还原糖百分含量=毫克数×提取液总体积\测定时取用体积÷样品的质量=13.5%
总糖的百分含量=毫克数×稀释倍数÷样品质量×0.9=18.63%
总结:本实验测得还原糖的含量为13.5%,总糖含量为18.63%,R²为0.9739,实验数据还是略有偏差。
七、误差分析。
1、在配置制作葡萄糖标准曲线的溶液时,使用移液管移动液体,由于不够熟练,所以并没有准确移动相应的液体量,导致R²偏低。
2在提取还原糖时,由于我们采用的是最简单的棉花过滤方法,这个方法可能导致有许多还原糖被浪费,导致所测还原糖含量偏低。
此外,我们也需要注意,在标准的实验中,标准曲线的制定与样品含糖量必须同时进行,一起显色和比色。
八、体会。
这次试验我们学习了植物总糖、还原糖的提取鉴定及其含量测定,掌握了还原糖和总糖测定的基本原理,同时也对比色法测定还原糖有了一定了解并且还掌握了使用分光光度计测定还原糖和总糖的光密度值收获许多,试验中要求每只试
管同时进行水浴加热加热时间视实验原料而定,严格控制时间。
分光光度计是溶液中的物质在光的照射下产生了对光吸收的效应,物质对光的吸收是具有选择性的。
我们就利用了这个原理,测定了还原糖和总糖的含量,而且绘制了葡萄糖标准曲线。
实验很有意思,接触新的仪器也让我很开心,希望以后也会这么愉快。
九、参考文献
吴兰老师PPT
《生物化学实验》第三版
百度文库
十、感谢
吴兰老师指导
同组成员:朱帅、周洁、曹冲。