2017年抗菌药物备案文件.doc
- 格式:doc
- 大小:3.24 MB
- 文档页数:15
注:
1.本目录依据《抗菌药物临床应用管理办法》(卫生部第84号令)、《抗菌药物临床应用指导原则》(2015版)以及抗菌药物临床应用管理相关规定,并结合抗菌药物药理作用、安全性、有效性、对细菌耐药的影响及价格因素等综合考虑制定;
2.本目录所列抗菌药物是指治疗细菌、支原体、衣原体、立克次体、螺旋体、真菌等病原微生物所致感染性疾病病原的药物,不包括局部外用抗菌药物及治疗结核病、寄生虫病和各种病毒所致感染性疾病的药物以及具有抗菌作用的中药制剂;
3.标注“*”的抗菌药物品种,原则上仅限于二级综合医院使用。
特殊情况下,其他医疗机构因个案治疗需要使用此类抗菌药物,根据《抗菌药物临床应用管理办法》规定,可启动临床采购程序;
4.未收录的抗菌药物品种规格应参照特殊使用级管理,并报核发其《医疗机构许可证》的卫生计生行政部门备案。

农业部关于印发《全国遏制动物源细菌耐药行动计划(2017—2020年)》的通知文章属性•【制定机关】农业部(已撤销)•【公布日期】2017.06.22•【文号】农医发〔2017〕22号•【施行日期】2017.06.22•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】畜牧业正文农业部关于印发《全国遏制动物源细菌耐药行动计划(2017—2020年)》的通知农医发〔2017〕22号各省、自治区、直辖市畜牧兽医(农牧、农业、渔业)厅(局、委、办),新疆生产建设兵团畜牧兽医局(农业、水产)局:为应对动物源细菌耐药挑战,提高兽用抗菌药物科学管理水平,保障养殖业生产安全、食品安全、公共卫生安全和生态安全,维护人民群众身体健康,促进经济社会持续健康发展,我部制定了《全国遏制动物源细菌耐药行动计划(2017-2020年)》(以下简称《行动计划》)。
现印发你们,请结合实际认真组织实施,保证《行动计划》目标如期实现。
农业部2017年6月22日全国遏制动物源细菌耐药行动计划(2017—2020年)为加强兽用抗菌药物管理,遏制动物源细菌耐药,保障养殖业生产安全、食品安全、公共卫生安全和生态安全,根据《遏制细菌耐药国家行动计划(2016-2020年)》《“十三五”国家食品安全规划》和《“十三五”国家农产品质量安全提升规划》,制定本行动计划。
一、前言我国是畜禽、水产养殖大国,也是兽用抗菌药物生产和使用大国。
兽用抗菌药物在防治动物疾病、提高养殖效益、保障畜禽水产品有效供给中,发挥了重要作用。
但是,兽用抗菌药物市场秩序不够规范、养殖环节使用不尽合理、从业人员科学用药意识不强、公众对细菌耐药性认知度不高等问题依然存在,加之国家动物源细菌耐药性风险评估和防控体系薄弱,细菌耐药形势日趋严峻。
动物源细菌耐药率上升,导致兽用抗菌药物治疗效果降低,迫使养殖环节用药量增加,从而加剧兽用抗菌药物毒副作用和残留超标风险,严重威胁畜禽水产品质量安全和公共卫生安全,给人类和动物健康带来隐患。

抗菌药物临床应用管理办法2017版本
第一条:为了规范抗菌药物在临床上的应用,保护医疗资源及人民群众健康,制定本管理办法。
第二条:各医疗机构应当建立抗菌药物使用管理制度,明确抗菌药物使用的
管理责任部门和管理人员。
第三条:医疗机构应当建立抗菌药物使用审核机制,对抗菌药物的使用进行
审查,并建立有效的档案记录。
第四条:医疗机构应当根据患者的具体情况执行合理的抗菌药物使用方案,
遵循临床指南和规范。
第五条:医疗机构应当定期对抗菌药物使用情况进行统计分析,评估抗菌药
物使用的合理性和效果。
第六条:医疗机构应当开展抗菌药物使用的培训教育,提高医护人员对抗菌
药物使用的认识和管理水平。
第七条:医疗机构应当加强对患者的药物监测,掌握患者的用药情况,及时
调整抗菌药物使用方案。
第八条:医疗机构应当建立抗菌药物使用的不良反应监测机制,加强对抗菌
药物使用的风险评估和预防控制。
第九条:医疗机构应当建立抗菌药物使用的信息系统,实现抗菌药物使用数
据的信息化管理。
第十条:医疗机构应当建立抗菌药物使用的信用机制,对违反抗菌药物使用
规定的医护人员进行处理。
第十一条:医疗机构应当加强与药品监管部门的合作,定期开展抗菌药物使
用情况的核查和评估。
第十二条:对于患者合理使用抗菌药物的医护人员,应当给予表彰和奖励。
第十三条:本管理办法自颁布之日起实施,如有需要修改,应当按照程序进
行讨论和审批。
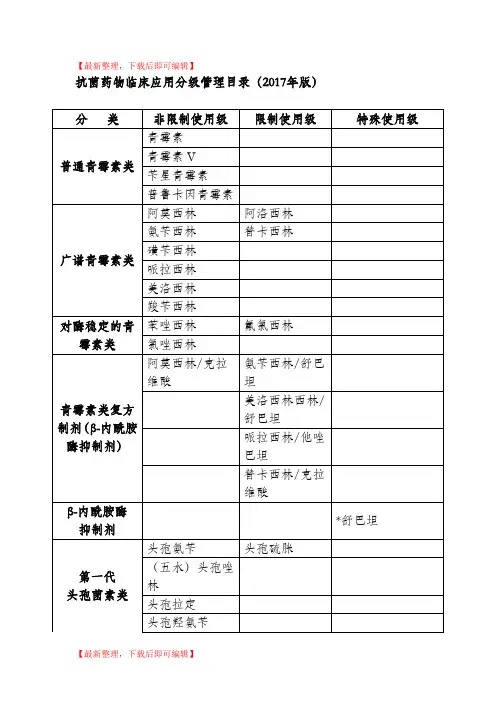
【最新整理,下载后即可编辑】
注:
1.本目录依据《抗菌药物临床应用管理办法》(卫生部第84号令)、《抗菌药物临床应用指导原则》(2015版)以及抗菌药物临床应用管理相关规定,并结合抗菌药物药理作用、安全性、有效性、对细菌耐药的影响及价格因素等综合考虑制定;
2.本目录所列抗菌药物是指治疗细菌、支原体、衣原体、立克次体、螺旋体、真菌等病原微生物所致感染性疾病病原的药物,不包括局部外用抗菌药物及治疗结核病、寄生虫病和各种病毒所致感染性疾病的药物以及具有抗菌作用的中药制剂;
3.标注“*”的抗菌药物品种,原则上仅限于二级综合医院使用。
特殊情况下,其他医疗机构因个案治疗需要使用此类抗菌药物,根据《抗菌药物临床应用管理办法》规定,可启动临床采购程序;
4.未收录的抗菌药物品种规格应参照特殊使用级管理。
![抗菌药物采购目录备案表[1]](https://uimg.taocdn.com/0e722e25cfc789eb172dc887.webp)

抗菌药物临床应用管理办法2017版最新一、引言抗菌药物是治疗感染病症的重要药物之一,然而不合理使用抗菌药物可能会引发抗药性问题。
2017年,卫生部发布了《抗菌药物临床应用管理办法》,旨在规范抗菌药物的临床应用,减少抗菌药物滥用和不当使用,提高抗菌药物的治疗效果,保护公众健康。
本文将详细介绍2017年最新版的《抗菌药物临床应用管理办法》。
二、基本原则1.抗菌药物使用应由具有相应资格的医师根据患者情况合理选用。
2.严格执行抗菌药物管理法律法规,不得非法生产、销售和使用抗菌药物。
3.加强监测和评估抗菌药物使用情况,提高管理水平。
三、抗菌药物使用范围根据临床需要,医师可以合理选用抗菌药物,但应该根据患者的细菌培养和药敏试验结果来确定具体的药物选择。
四、抗菌药物使用原则1.优先考虑使用敏感细菌对抗菌药物。
2.合理选择抗菌药物种类、剂量和疗程,避免滥用和不当使用。
3.避免不合理使用广谱抗生素。
4.对于特殊感染病情,需依据细菌培养和药敏试验结果及专家意见指导用药。
五、抗菌药物管理1.加强抗菌药物申报审批,建立使用记录并定期进行评估反馈。
2.对使用抗菌药物情况进行监测,发现滥用和不当使用情况及时制止。
3.开展抗菌药物合理使用宣传教育,提高医务人员和公众对抗菌药物的正确使用认识。
结论《抗菌药物临床应用管理办法》2017版的出台,为规范抗菌药物的应用提供了重要依据,有助于减少抗药性问题的发生,提高抗菌药物的疗效,保护公众健康。
医务人员和患者应该共同遵守相关规定,合理使用抗菌药物,共同维护公共卫生安全。

抗菌药物临床试验管理目录备案表一、研究概况- 试验编号:[填写试验编号]- 试验名称:[填写试验名称]- 试验单位:[填写试验单位]- 试验负责人姓名:[填写负责人姓名]- 试验负责人联系方式:[填写负责人联系方式]二、试验目的与背景[填写试验目的与背景]三、试验设计与计划1. 试验类型:[填写试验类型]2. 试验设计:[填写试验设计]3. 试验周期:[填写试验周期]4. 试验目标人数:[填写试验目标人数]5. 试验入选标准:[填写试验入选标准]6. 试验排除标准:[填写试验排除标准]7. 试验干预措施:[填写试验干预措施]8. 试验观测指标:[填写试验观测指标]9. 试验终点指标:[填写试验终点指标]10. 试验分组:[填写试验分组]11. 试验盲法:[填写试验盲法]12. 试验随访:[填写试验随访计划]13. 试验数据管理:[填写试验数据管理计划]四、试验伦理与安全性1. 伦理与法规:[填写试验遵守的伦理与法规]2. 患者知情同意:[填写患者知情同意流程]3. 患者权益保护:[填写患者权益保护措施]4. 安全性监测:[填写安全性监测计划]五、试验执行与管理1. 试验指导和培训:[填写试验指导和培训计划]2. 试验药物管理:[填写试验药物管理计划]3. 试验数据采集与记录:[填写试验数据采集与记录计划]4. 不良事件报告与处理:[填写不良事件报告与处理计划]5. 中止试验的条件与流程:[填写中止试验的条件与流程]6. 试验结束与结果分析:[填写试验结束和结果分析计划]7. 数据保密与解读:[填写数据保密与解读措施]六、试验费用与审计1. 试验费用预算:[填写试验费用预算]2. 费用支付与报销:[填写费用支付和报销流程]3. 相关审计和监管:[填写相关审计和监管措施]七、参考文献[列出参考文献]以上仅为目录备案表,具体内容请参照实际试验进行填写。

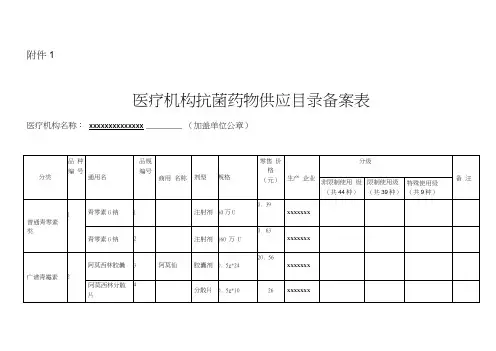
2017年抗菌药物备案附件1医疗机构抗菌药物供应目录备案表医疗机构名称:xxxxxxxxxxxxxx (加盖单位公章)分类品种编通用名品规编商用名称剂型规格零售价生产企业分级备注非限制使限制使用特殊使用级普通青霉素类1青霉素G钠 1注射80万U0.39xxxxxxx √青霉素G钠 2注射160万U0.63xxxxxxx √广谱青霉 2 阿莫西林胶囊 3阿莫仙胶囊0.5g*2420.56xxxxxxx √阿莫西 4 分0.5g*18.xxxx素 3 注射用美洛西林钠5 力扬注 2.0g 28.xxxx6 注 1.5g 22.xxxx√4 注射用阿洛西林钠7 注射1.0g 5.89xxxxxxx√8 注射1.5g 39.80xxxxxxx√5 注射用磺苄西林钠9 万普注 1.0g 33.xxxx√10 颇佳注 2.0g 51.xxxx√对酶稳定的青霉素6注射用氟氯西11 注射0.5g 38.00xxxxxxx√注射用12 伊芬注 1.0g 98.xxxx√氟氯西13 胶0.25g39.xxxx√青霉素类注射用阿莫西林克拉14 注0.6g 11.xxxx15 君尔注 1.2g 14.xxxx复方制剂(β-内酰胺酶抑制剂)7阿莫西林克拉16 君尔清片剂375mg*1545.74xxxxxxx√8注射用美洛西林/舒17 开林注 1.25g 32.xxxx√18 注 3.75g 80.xxxx√9注射用哌拉西19 注 1.25g 69.xxxx√20 凯伦注 2.25g 27.xxxx√1注射用21 注 2.25g 45.xxxx√第一代头孢菌素类11注射用22 注0.5g 0.8xxxx√注射用23 新泰注 1.0g 43.xxxx√12头孢羟24 胶0.25g16.xxxx√头孢羟25 片0.12579xxxx√13注射用头孢西26 注0.5g 143xxxx√27 注 1.0g 230xxxx√14 注射用头孢硫28 仙力注0.5g 27.xxxx√29 仙力注 1.0g 46.xxxx√第二代头孢菌素类15注射用30 明可注0.75g 25.xxxx√注射用31 安可注 1.5g 44.xxxx√头孢呋32 库欣片0.12527.xxxx√1头孢克33 胜寒胶0.25g13.xxxx√17注射用34 注0.25g 15.xxxx√注射用35 注 1.0g 35.xxxx√18头孢丙36 银力分0.25g30.xxxx√头孢丙37 亿代胶0.25g20.xxxx√第三、四代19 注射用38 罗氏注0.5g 33.xxxx√39 罗氏注 1.0 g 57.xxxx√头孢菌素类2注射用40 注0.5g 18.xxxx√21注射用头孢噻肟钠41 注0.5g 30.xxxx√欧42 立健注1g 51.xxxx√欧2注射用43 益保注1g 59.xxxx√日23注射用头孢他44 注0.5g 22.xxxx√45 注1g 37.xxxx√2注射用46 信力注0.5g 18.xxxx√头孢菌素复方25注射用头孢哌47 舒普深注射1.5g 69.30xxxxxxx√48 汕鮀注2g 17.xxxx√头霉素类26注射用50 噻欧注1g 17.xxxx√注射用51 注1g 36.xxxx√其他2法罗培52 君迪片0.25g129xxxx√β内酰胺类28 注射用拉氧头53 噻吗注1g 100xxxx√54 注0.5g 39.xxxx√碳青霉烯类29 注射用亚胺培55 联邦注0.25g51.xxxx√56 泰能注1g 135xxxx√3注射用57 天册注0.3g 130xxxx√大环内酯类31阿奇霉58 胶0.25g35.xxxx√阿奇霉59 肠0.25g21.xxxx√阿奇霉60 混0.1g*38.xxxx√注射用61 其仙注0.12519.xxxx√注射用62 其仙注0.25g 34.xxxx√32红霉素63 美红胶0.25g29.xxxx√注射用64 注0.25g 0.9xxxx√3罗红霉65 逻施胶0.15g37.xxxx√林可酰胺类34盐酸克66 莱美注4ml:022.xxxx√注射用67 注0.5g 33.xxxx√氨基糖苷类3硫酸阿68 注2ml: 1.0xxxx√36硫酸依69 硫酸注4ml:74.xxxx√硫酸依70 注2ml:38.xxxx√四环3注射用71 天解注50mg 518xxxx√喹诺酮类38盐酸环72 片0.5g*15.xxxx√注射用73 注0.2g 55xxxx√3吡哌酸74 片0.25g16.xxxx√4左氧氟75 可乐片0.1g*35.xxxx√乳酸左76 来立注0.3g 30.xxxx√盐酸左77 左克注0.1g:9.9xxxx√4 1 盐酸莫78 拜复注250ml253xxxx√盐酸莫79 注0.4g:198xxxx√糖肽4注射用80 注0.5g 78.xxxx√硝基咪唑衍生物43甲硝唑81 片0.2g*37.xxxx√甲硝唑82 注250ml 6.2xxxx√4替硝唑83 注200ml13.xxxx√45奥硝唑84 注100ml30.xxxx√注射用85 今达注0.25g 19.xxxx√奥硝唑86 固特分0.25g28.xxxx√奥硝唑87 潇然片0.25g16.xxxx√左奥硝88 优诺注100ml116xxxx√其它抗菌药物46利奈唑89 斯沃注300ml393xxxx√利奈唑90 天礼注100ml92xxxx√抗真菌药4氟康唑91 注100ml10.xxxx√4注射用92 注0.1g 173xxxx√4伊曲康93 斯皮胶0.1g*103xxxx√。
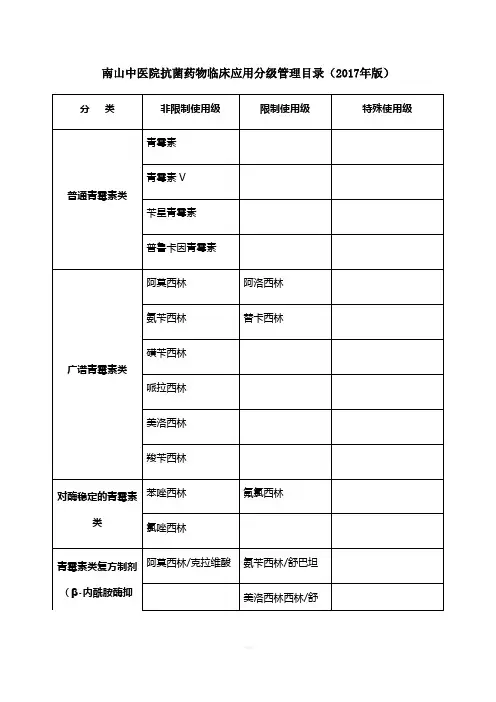
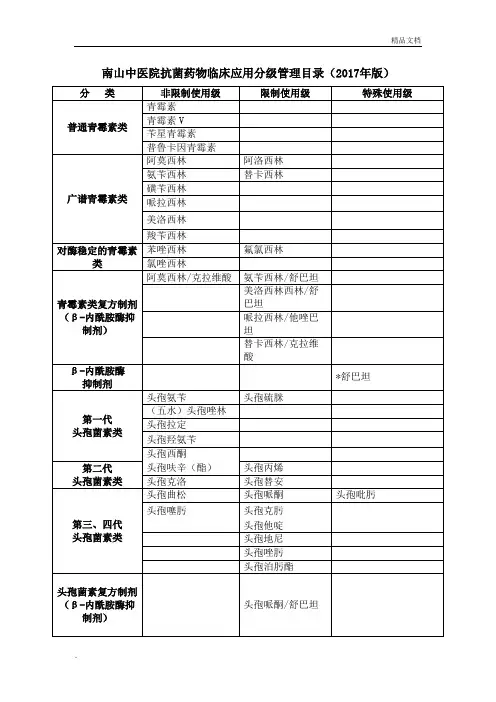
南山中医院抗菌药物临床应用分级管理目录(2017年版)
注:
1.本目录依据《抗菌药物临床应用管理办法》(卫生部第84号令)、《抗菌药物临床应用指导原则》(2015版)以及抗菌药物临床应用管理相关规定,并结合抗菌药物药理作用、安全性、有效性、对细菌耐药的影响及价格因素等综合考虑制定;
2.本目录所列抗菌药物是指治疗细菌、支原体、衣原体、立克次体、螺旋体、真
菌等病原微生物所致感染性疾病病原的药物,不包括局部外用抗菌药物及治疗结核病、寄生虫病和各种病毒所致感染性疾病的药物以及具有抗菌作用的中药制剂;
3.标注“*”的抗菌药物品种,原则上仅限于二级综合医院使用。
特殊情况下,其他医疗机构因个案治疗需要使用此类抗菌药物,根据《抗菌药物临床应用管理办法》规定,可启动临床采购程序;
4.未收录的抗菌药物品种规格应参照特殊使用级管理,并报核发其《医疗机构许可证》的卫生计生行政部门备案。
附件12017年抗菌药物临床合理应用督导工作表(医疗机构)省(市)自治区:医疗机构名称:-11 --12 -8.将抗菌药物临床应用管理和临床路径管理有效结合,发挥临床路径在规范诊疗行为、促进合理用药工作中的作用。
随机抽查10份已纳入临床路径病历,查看诊疗过程、药物应用9.制定加强医疗机构信患化建设方案,发挥信息、技术对抗菌药物临床应用管理的技术支撑药物临床应 科建设、人才 床位数40张,临床微生物实际从业人员数5人,抗感染临床药师1人。
用管理技术 培养6.制定涵盖感染性疾病诊疗、疑难疾病会诊、医院感染控制、抗菌药物应用管理等相关内支撑体系建 (三肮菌药容的诊疗体系的建设方案。
7.制定医师、药师、微生物检验人员和管理人员培训方案,提高合理使用抗菌药物的技术能力和管理能力。
医疗机构信 作用。
恵、化建设物临床应用 管理和临床 路径管理有是否合理。
效结合、加强-11 -三■加强抗菌 药监测与评药物临床应 用和细菌耐-12 -16.制定预防使用、联合使用和静脉输注抗菌药物管理文件。
17.制定碳青霉烯类以及替加环素等特殊使用级抗菌药物使用管理文件。
18•规定特殊使用级抗菌药物必须经具有相应处方权限的医师开具处方,并经具有抗感染临床经验的感染或相关专业专家会诊同意后,方可使用。
随机抽查10份特殊使用抗菌药物患 者病历,查看是否有会诊记录。
19. 检查门诊特殊使用级抗菌药物使用情况。
随机抽取110份门诊处方,按丿帧序查前100份(同一患者多份处方视为1份),查看是否使用特殊使用级抗菌药物。
20. 检查接受特殊使用级抗菌药物治疗的住院患者微生物送检情况。
随机抽查接受特殊使用级抗菌药物治疗的住院患者病历20份,计算特殊使用级抗菌药物使用前微生物送检率(按 规定送检率应不得低于80% )。
21. 对碳青霉烯类抗菌药物及替加环素等特殊使用级抗菌药物实施专档管理。
22. 临床科室按要求填报碳青霉烯类抗菌药物及替加环素等特殊使用级抗菌药物使用信恵。
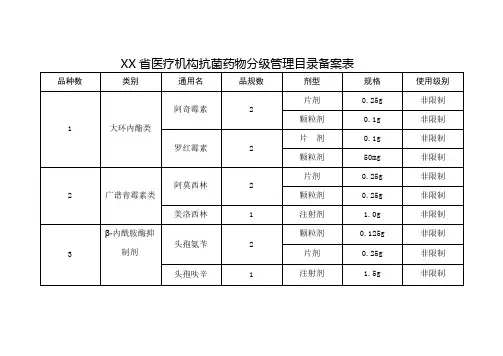
抗菌药物临床应用管理目录备案表
(1)各备案医疗机构在目录中选取药物作为本机构使用依据,医疗机构应当严格控制本机构抗菌药物供应目录的品种数量。
同一通用名称抗菌药物品种,注射剂型和口服剂型各不得超过2种。
具有相似或者相同药理学特征的抗菌药物不得重复列入供应目录。
(2)未经县级卫生行政部门备案的抗菌药物品种、品规,医疗机构不得采购和使用。
(3)需提供备案医疗机构内执业人员资质证书复印件一份。
(4)本表一式四份,备案医疗机构、县卫监大队、县卫计局医政股、机构档案存档各一份。
关于部分医师取得抗菌药物处方权的通知
为加强我院抗菌药物临床应用管理,规范抗菌药物临床应用行为,促进临床合理应用抗菌药物,控制细菌耐药,保障医疗质量和医疗安全,根据《抗菌药物临床应用管理办法》及《武侯区卫生局关于印发<武侯区抗菌药物临床应用管理实施方案>的通知》等相关规定,我院部分医师、药师参加了武侯区医学会组织的抗菌药物临床应用知识和规范化管理培训,经培训、考核合格后,结合抗菌药物分级管理原则,现将我院已取得区卫生局授予抗菌药物处方权和调剂资格的人员名单公布如下:
一、特殊使用级:魏家宾、高亮;
二、限制使用级:康春雨、卢尚兵、陈倩、崔诗悦、徐爽、唐桂茹;
三、非限制使用级:王鹏;
四:获得抗菌药物处方调剂资格人员:唐蓉、刘晨。
具有特殊使用级处方权的医师可开具限制使用级、非限制使用级抗菌药物,具有限制使用级处方权的医师可开具非限制使用级抗菌药物。
各级抗菌药物临床使用时必须按医师职称、授予的权限,分级使用,不得越级使用。
药房应履行职责,严格审方,对不合理处方拒绝发药,并做好记录。
医务部将定期组织专业人员对处方进行点评,并将点评结果作为医师定期考核、临床科室和医务人员绩效考核依据。
对违规滥用抗菌药物的科室及个人,医院将进行通报批评,情节严重者,将降低抗菌药物使用权限,直至停止处方权。
请各科室遵照执行。
附:我院抗菌药物目录及授权人员名单
医务办
2017年8月31日
附件1:
我院抗菌药物目录及处方权人员名单
备注:★代表非限制级、★★代表限制级、★★★代表特殊使用级抗菌药物。