无机及分析化学课后习题答案新整理
- 格式:docx
- 大小:1.33 MB
- 文档页数:315

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= 40.6kJ ·mol -1W=-p 外△V ≈-n R T =-8.314×373.15=-3.10 kJ ·mol -1 △U = Q + W= 40.6+(-3.10)=37.5 kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。

第一章 气体和溶液2. 解:根据理想气体状态方程:nRTV p =可得: RTpV M n ==m 则: mol /0.160.250L101.3kPa K 298K mol L kPa 315.8164.0-11g g pV mRT M ≈⨯⨯⋅⋅⋅⨯==-该的相对分子质量为16.04. 解:由题意可知,氮气为等温变化,氧气为等容变化 kPa 92.350.0mL2.00mL kPa 0.98211N 2=⨯==V V p p kPa 45.43333K 732kPa 0.53121O 2=⨯==K T T p p 根据道尔顿分压定律:kPa4.4792.345.4322O N ≈+=+=p p p 总7. 解: T =(273+15)K = 288K ; p 总 =100kPa ;V =1.20L 288K 时,p (H 2O)=1.71kPaM (Zn)=65.39则 p 氢气= (100-1.71)kPa = 98.29kPa mol 0493.0K288K mol L 8.315kPa L 20.18.29kPa 911-=⨯⋅⋅⋅⨯==-RT pV n 氢气根据: Zn(s) + 2HCl → ZnCl 2 + H 2(g)65.39g 1molm (Zn)=? 0.0493mol解得m (Zn)=3.22g则杂质的质量分数 w (杂质) = (3.45-3.22)/ 3.45 = 0.06714. 解:因溶液很稀,可设ρ ≈1 g·mL -1(1) 14113L mol 1054.1K293K mol L kPa 315.8kPa 10375-----⋅⨯=⋅⋅⋅⋅⨯=∏=RT c (2) mol g L L g cV m n m M /1069.6mol 1054.1010.50515.04143⨯=⋅⨯⨯⨯===--- 血红素的相对分子质量为41069.6⨯ (3) K1086.2kg mol 1054.1mol kg K 86.14141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T f f K1088.7kg mol 1054.1mol kg K 512.05141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T b b (4)由于沸点升高和凝固点下降的值太小,测量误差很大,所以这两种方法不适用。
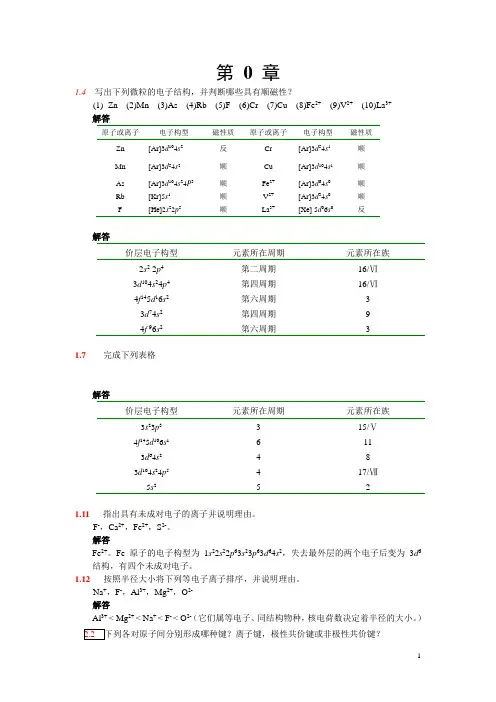
第0 章1.4写出下列微粒的电子结构,并判断哪些具有顺磁性?(1)Zn (2)Mn (3)As (4)Rb (5)F (6)Cr (7)Cu (8)Fe2+(9)V2+(10)La3+解答原子或离子电子构型磁性质原子或离子电子构型磁性质Zn [Ar]3d104s2 反Cr [Ar]3d54s1 顺Mn [Ar]3d54s2顺Cu [Ar]3d104s1 顺As [Ar]3d104s24P3 顺Fe2+ [Ar]3d64s0顺Rb [Kr]5s1 顺V2+ [Ar]3d34s0顺F [He]2s22p5 顺La3+ [Xe] 5d06s0反解答价层电子构型元素所在周期元素所在族2s2 2p4 3d104s24p4 4f145d16s2 3d74s2 4f 96s2第二周期第四周期第六周期第四周期第六周期16/Ⅵ16/Ⅵ3931.7完成下列表格解答价层电子构型元素所在周期元素所在族3s23p3 4f145d106s1 3d64s2 3d104s24p52364415/Ⅴ11817/Ⅶ1.11指出具有未成对电子的离子并说明理由。
F-,Ca2+,Fe2+,S2-。
解答Fe2+。
Fe原子的电子构型为1s22s22p63s23p63d64s2,失去最外层的两个电子后变为3d6结构,有四个未成对电子。
1.12按照半径大小将下列等电子离子排序,并说明理由。
Na+,F-,Al3+,Mg2+,O2-解答Al3+ < Mg2+ < Na+ < F- < O2-(它们属等电子、同结构物种,核电荷数决定着半径的大小。
)(a) Li, O; (b) Br, I; (c) Mg, H; (d) O, O; (e) H, O; (f) Si, O; (g) N, O; (h) Sr, F. 解答主要形成离子键的:(a), (c), (h); 主要形成极性共价键的:(b), (e), (f), (g);主要形成非极性共价键的:(d).3.10 为了增加C (s)和H 2O (g)反应中生成的H 2 (g)的产率,我们普遍应用了一个称为“水-气转换反应”的辅助反应,水-气转换反应如下: CO (g)+ H 2O (g) CO 2 (g)+ H 2 (g) 此反应在大约1100 K 时,K θ = 1.00。

一、选择题1.对反应 2SO 2(g)+O 2NO(g)3(g) 下列几种速率表达式之间关系正确的是( )。
A. dtdc dtc )O ()SO (d 22=B. tc tc d 2)SO (d d )SO (d 32=C. tc tc d )O (d d 2)SO (d 23= D. 32d (SO ) d (O )2d d c c tt=-解:选D 。
依据化学反应的瞬时速率的表达通式,对于一般化学反应,速率表达可写出通式如下:2.由实验测定,反应 H 2(g)+Cl 2(g)===2HCl(g) 的速率方程为v =kc (H 2)c 1/2(Cl 2) ,在其他条件不变的情况下,将每一反应物浓度加倍,此时反应速率为( )。
A. 2v B. 4v C. 2.8v D. 2.5v 解:选C 。
依据化学反应的速率方程υ=kc (H 2)c 1/2(Cl 2),H 2和Cl 2浓度增大都增大一倍时,速率应该增大22倍,即相当于2.8Υa。
3.测得某反应正反应的活化能E a.正=70 kJ·mol -1,逆反应的活化能E a.逆=20 kJ·mol -1,此反应的反应热为( )A. 50 kJ·mol -1B. -50 kJ·mol -1C. 90 kJ·mol -1D. -45 kJ·mol -1解:选A 。
依据过渡态理论,反应热可以这样计算:Q = E a,正- E a,逆 。
4.在298K 时,反应 2H 2O 2===2H 2O+O 2,未加催化剂前活化能E a =71 kJ·mol -1,加入Fe 3+作催化剂后,活化能降到42 kJ·mol -1,加入催化剂后反应速率为原来的( )。
A. 29倍 B. 1×103倍 C. 1.2×105倍 D.5×102倍解:选C 。
依据阿仑尼乌斯指数式k = A ·e RT E a-,可得5298314.82900012102.1ee 21⨯===⨯-RTE E a a k k5.某反应的速率常数为2.15 L 2·mol -2·min -1,该反应为( )。

第一章 物质构造根底1-1.简答题(1)不同之处为:原子轨道的角度分布一般都有正负号之分,而电子云角度分布图均为正值,因为Y 平方后便无正负号了;除s 轨道的电子云以外,电子云角度分布图比原子轨道的角度分布图要稍“瘦〞一些,这是因为︱Y ︱≤ 1,除1不变外,其平方后Y 2的其他值更小。
(2) 几率:电子在核外某一区域出现的时机。
几率密度:电子在原子核外空间某处单位体积内出现的几率,表示微粒波的强度,用电子云表示。
(3) 原子共价半径:同种元素的两个原子以共价单键连接时,它们核间距离的一半。
金属半径:金属晶体中相邻两个金属原子核间距离的一半。
范德华半径:分子晶体中相邻两个分子核间距离的一半。
(4) BF 3分子中B 原子采用等性sp 2杂化成键,是平面三角形;而NF 3分子中N 原子采用不等性sp 3杂化,是三角锥形。
〔5〕分子式,既说明物质的元素组成,又表示确实存在如式所示的分子,如CO 2、C 6H 6、H 2;化学式,只说明物质中各元素及其存在比例,并不说明确实存在如式所示的分子,如NaCl 、SiO 2等;分子构造式,不但说明了物质的分子式,而且给出了分子中各原子的具体联接次序和方式,像乙酸的构造式可写为C HH HC OO H其构造简式可记为CH 3COOH 。
1-2解 1错;2错;3对;4对;5对;6错。
7对;8错;9对 10错;11错;12错。
1-3波动性;微粒性1-4. 3s=3p=3d=4s ;3s< 3p< 4s <3d ;3s< 3p< 3d< 4s ; 1-5 32;E 4s < E 4p < E 4d < E 4f ; 第六周期;La 系;2;铈(Ce)1-6HF>HCl>HBr>HI ;HF>HCl>HBr>HI; HF<HCl<HBr<HI; HF>HI>HBr>HCl 。

无机及分析化学习题及答案精选xxx科技大学第十四章分析化学基础1.对某组分的含量进行测定时,若被分析样品的质量大于100mg,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析2.对某溶液中的铝进行测定时,若取分析试液25ml进行分析测定,则该分析方法属于( )A. 常量分析B. 半微量分析C. 微量分析D. 超微量分析3.由精密度好就可断定分析结果可靠的前提是( )A. 偶然误差小B. 系统误差小C. 标准偏差小D. 相对偏差小4.下列各种分析纯的化学试剂,其中不能用直接配制法配制标准溶液的是A. KHCO3B. KMnO4C. K2CrO7D. KCl5.下列各种措施中,可以减小偶然误差的是( )A. 进行空白试验B. 进行对照试验C. 进行仪器校准D. 增加平行测定次数6.下述情况引起的误差中,不属于系统误差的是( )A. 移液管转移溶液之后残留时稍有不同B. 称量时使用的砝码锈蚀C. 滴定管刻度未经校正D. 天平的两臂不等长7.下列叙述中错误的是()A.系统误差呈正态分布 B. 系统误差又称可测误差C. 方法误差属于系统误差D. 系统误差具有单向性8. 分析测定中出现下列情况,何者属于系统误差( )A. 滴定时有溶液溅出B. 试样未经充分混匀C. 滴定管未经校正D. 读错法码9. 下列计算式的计算结果(X)应有几位有效数字?( )X= [0.3120⨯48.12⨯(21.65-16.10)]÷(1.2845⨯1000)A. 二位B. 三位C. 四位D. 五位第 1 页10. 欲测某组分含量,由四人分别进行测定,试样称取量皆为2.2g,问下列结果中哪一个是合理的?( )A. 2.085%B. 2.08%C. 2.09%D. 2.1%11. 称取一定质量的邻苯二甲酸氢钾基准物质以标定NaOH溶液的浓度,下列何者将引起正误差( )A. 称取基准物重量时用的一只10mg法码,事后发现其较正后的值为9 .7mgB.滴定时滴定终点在等量点后到达。

无机及分析化学习题及解答无机及分析化学习题解答严新徐茂蓉葛成艳编第一章绪论1.1判断下列误差属于何种误差?①在分析过程中,读取滴定管读数时,最后一位数字n次读数不一致,对分析结果引起的误差。
②标定HCl溶液用的NaOH标准溶液中吸收了CO2,对分析结果所引起的误差。
③移液管、容量瓶相对体积未校准,由此对分析结果引起的误差。
④在称量试样时,吸收了少量水分,对结果引起的误差。
答:①偶然误差;②系统误差中的试剂误差;③系统误差中的仪器误差;④过失误差1.2测得Cu百分含量为41.64%、41.66%、41.58%、41.60%、41.62%、41.63%,计算测定结果的平均值、平均偏差、相对平均偏差。
(无须舍去数据)解:41.64%41.66%41.58%41.60%41.62%41.63%41.62%6x+++++==1id x xn=-∑=2.2×10-4 100%rddx=⨯=0.053%1.3测定某样品中铁的百分含量,结果如下:30.12%、30.05%、30.07%、30.05%、30.06%、30.03%、30.02%、30.03%根据Q检验法,置信度为90%时是否有可疑数要舍去,计算分析结果的平均值、标准偏差、变异系数和对应的置信区间。
解:排序:30.02%、30.03%、30.03%、30.05%、30.05%、30.06%、30.07%、30.12%先检验最大值30.12%:30.12%30.07%0.530.12%30.02%Q-==-Q0.9=0.47 < 0.5,所以舍去30.12%继续检验最大值30.07%,30.07%30.06%0.230.07%30.02%Q-==-,Q0.9=0.51>0.2,不应舍去,30.07%应该保留。
检验最小值30.02%,30.03%30.02%0.230.07%30.02%Q-==-Q 0.9=0.51>0.2,不应舍去,30.02%应该保留。

.选择题1.一化学反应系统在等温定容条件下发生一变化,可通过两条不同的途径完成:(1)放热10 kJ,做电功50 kJ;(2)放热Q, 不做功,则( )A. Q = -60kJB. Q = -10 kJC. Q = -40kJD. 反应的Q V =-10kJ解:选A。
θ2.在298 K,下列反应中r H mθ与r G mθ最接近的是( )A. CCl4 (g) +2H2O (g) =CO2 (g) + 4HCl (g)B. CaO (s) +CO2 (g) =CaCO3 (s)2+ 2+C. Cu2+ (aq) + Zn (s) =Cu (s) + Zn2+ (aq)D. Na (s) +H2O (l) =Na+(aq)+?H 2 (g)+OH-(aq)解:选C。
∵ Δr Gθm Δr H mθTΔr S mθ当Δr S mθ= 0 时, Δr G mθΔr H mθ∴反应 C 中反应物和生成物中无气体物质、物态也无变化,Δr S mθ值较小。
3.已知反应2H2 (g) O2 (g)= 2H2O (g) 的r H mΘ483.63 kJ m·ol –1,下列叙述正确的是( )A. f H mθ(H2O,g) 483.63 kJ m·ol–1B. r H mθ483.63 kJ m·ol –1表示Δξ = 1 mol 时系统的焓变C. r H mθ483.63 kJ m·ol–1表示生成1 mol H2O (g) 时系统的焓变D. r H mθ483.63 kJ m·ol–1表示该反应为吸热反应解:选B。
A 错,根据Δf H mθ定义,H2O (g)的系数应为1。
C 错,该方程为表示生成 2 mol H2O(g) 时系统的焓变。
D 错,ΔrH mθ > 0时表示该系统能量的增加,该反应为吸热反应,ΔrH mθ<0 时表示该系统能量的减少,该反应为放热反应。

无机及分析化学(Ⅰ)习题解答目录第1章分散体系 (1)第2章化学热力学基础 (8)第3章化学反应速率和化学平衡 (15)第4章物质结构 (22)第5章分析化学概述 (27)第6章酸碱平衡 (31)第7章酸碱滴定法 (36)第8章沉淀溶解平衡 (44)第9章重量分析法和沉淀滴定法 (49)第10章配位化合物 (53)第11章配位滴定法 (62)第12章氧化还原反应 (67)第13章氧化还原滴定法 (78)第14章电势分析法 (83)第15章吸光光度分析法 (86)第16章试样分析中常用的分离方法简介 (90)第17章重要生命元素简述 (93)第18章原子核化学简介 (96)第1章 分散体系1-1.人体注射用的生理盐水中,含有NaCl 0.900%,密度为1.01g·mL -1,若配制此溶液3.00×103g ,需NaCl 多少克?该溶液物质的量浓度是多少?解:配制该溶液需NaCl 的质量为:m (NaCl)=0.900%×3.00×103g=27.0g该溶液的物质的量浓度为:-1-13-1-327.0g/58.5g mol (NaCl)==0.155mol L (3.0010g/1.01g m L )10c ⋅⋅⨯⋅⨯ 1-2.把30.0g 乙醇(C 2H 5OH)溶于50.0g 四氯化碳(CCl 4)中所得溶液的密度为1.28g∙mL -1,计算:(1)乙醇的质量分数;(2)乙醇的物质的量浓度;(3)乙醇的质量摩尔浓度;(4)乙醇的摩尔分数。
解:(1)w (C 2H 5OH) =25254(C H OH)30.0g (C H OH)(CCl )30.0g 50.0gm m m =++=0.38 (2)-12525-1-3(C H OH)30.0g/46g mol (C H OH)[(30.0+50.0)g /1.28g mL ]10n c V ⋅=⋅⨯==10.4mol·L -1 (3)b (C 2H 5OH) =-125-3430.0g(C H OH)46g mol (CCl )50.010kgn m ⋅=⨯=13.0mol·kg -1 (4)x (C 2H 5OH) =-125254-1-130.0g(C H OH)46g mol =30.0g 50.0g (C H OH)+(CCl )+46g mol 153.6g mol n n n ⋅⋅⋅ =0.650.660.650.33=+ 1-3.将5.0g NaOH 、NaCl 、CaCl 2分别置于水中,配成500mL 溶液,试求c (NaOH)、c (NaCl)、c (12CaCl 2)。
1 《无机及分析化学》教材习题解答第一章 溶液和胶体1-1 一种或几种物质分散成微小的粒子散布在另一种物质中所构成的系统称为分散系;分散系按照分散质粒子大小可分为三类:分子离子分散系、胶体分散系和粗分散系;按照物质聚集状态分为:固液、液液、气液等。
1-2 不适用。
实验证明,引入校正系数,拉乌尔定律就可以用于电解质溶液依数性的计算。
阿仑尼乌斯提出电解质溶液的电离学说,用于解释电解质溶液对拉乌尔定律的偏离行为,如果进行计算须引入校正系数。
他认为电解质溶于水后可以电离成阴、阳离子,而使溶液中粒子总数增加导致了校正系数总是大于1,故不适用。
1-3 沸点不衡定,因为沸腾溶液的蒸气压必须等于外界大气压,由于溶剂的蒸发或外界气压的变化,所以沸点不衡定;凝聚温度不衡定,从水的相图气液平衡曲线可知,蒸气的凝聚温度是随蒸气的蒸气压下降而下降的。
1-4 不对,渗透现象停止,说明半透膜两边粒子的渗透速度相等,渗透达到了平衡。
1-5 溶胶稳定性因素有:胶粒带电、动力学和溶剂化膜;聚沉方法有:加入强电解质、加入带相反电荷的溶胶、加热;电解质对溶胶的聚沉作用取决于与胶粒所带相反电荷的离子,离子的电荷越高,对溶胶的聚沉能力越强。
1-6 溶于水后能显著降低水的表面自由能的物质称为表面活性剂;其分子中含有极性基团和非极性基团,极性基团亲水为亲水基,非极性基团亲油为疏水基。
当表面活性物质溶于水后,分子中亲水基进入水相,疏水基则进入气相成油相这样表面活性剂分子就浓集在两相界面上,形成定向排列的分子膜,使相界面上的分子受力不均匀的情况得到改善,从而降低了水的表面自由能。
1-7 一般说来亲水性乳化剂有利于形成O/W 型乳状液,亲油性乳化剂有利于形成W/O 型乳状液,亲水性乳化剂有钾、钠肥皂,蛋白质,动物胶等都形成O/W 型乳状液,亲油性乳化剂有高价金属离子肥皂、高级醇类、高级酸类等形成W/O 型乳状液。
1-8 ①ω=003.12173.3=0.2644;②b=()3443.58173.310173.3003.12-⨯-=6.149mol.kg -1;③c=3443.58173.31000.10-⨯=5.430mol.L -1;④x(NaCl)=015.18173.3003.12443.58173.3443.58173.3-+=0.099721-9 由题意可知:⊿t f (尿素)=⊿t f (未知) ∴K f b(尿素)= K f b(未知) , 即b(尿素)= b(未知)()100010008.42200100006.605.1⨯=⨯未M 则有M(未)=342.74g..mol -11-10 ⊿t f =K f b 1.30=6.8×0.20100000.1⨯M 则有M ≈262.54g..mol -1 即M(S x )=262.54 故其分子式近似为S 8。
无机及分析化学第三版课后练习题含答案1. 填空题1.一种元素的电子亲和能越大,它接受电子的倾向就越强。
2.氧、氮和氢原子中,氧原子具有最高的电子亲和能。
3.原子的核电荷数增大,相应的电离能也增大。
4.分子极性与分子中各个化学键之间电负性差异有关。
5.当分子尺寸增大,分子间的相互作用力增大。
6.溶液的浓度增加,则溶液的折射率增大。
2. 选择题1.下列有关氰化物化学性质的陈述最为准确的是:A. HC\#N和NH2C\#N是两种不同的氰化物B. 氰化物通常呈强还原剂C. 氢氰酸是一种很弱的酸性物质D. 氰化物通常是有毒的答案:D2.碘有多种同素异形体,其中一种重要的共价键形式是:A. I2*B. I3^-C. I^-3D. I+答案:B3.下面哪个物质是无机共价化合物?A. 液氯B. 氧气C. 铁磁性材料D. 氟气答案:B3. 计算题1.一缓冲液体系的pH为7.5,其中乙酸和乙酸钠的初始摩尔浓度分别为0.07mol/L和0.1mol/L。
计算该缓冲液体系的缓冲能力。
答案:pKa = 4.76,缓冲能力为1.454. 简答题1.何谓气相色谱法?简述其分离机理及应用环境。
答:气相色谱法是一种用气体作为稀相介质,在固定相床与流经其上的气体之间应用不同的物理化学交互作用来实现各种化合物之间的分离与定量分析的技术。
其根据分离介质透明度和挥发性等物化特性进行各自的分离操作并依据计算目标来制定相应的方法装置制备。
在本技术中,常用固定相为多孔稳定材料,液相色谱法则使用亲多性和亲疏水特性的柱子进行梯度色谱条件调节。
该方法广泛应用于工业生产和医药科学领域,其中重要性最为突出的领域是分析制备过程中的分离操作工序。
第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= 40.6kJ ·mol -1W=-p 外△V ≈-n R T =-8.314×373.15=-3.10 kJ ·mol -1 △U = Q + W= 40.6+(-3.10)=37.5 kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。
绪论一、选择题1、按任务分类的分析方法是 ( )A.无机分析与有机分析 B.定性分析、定量分析和结构分析C.常量分析与微量分析 D.化学分析与仪器分析2、常量分析的称样量是 ( )A.>1g B.>0.1g C.0.01~0.1g D.>10mg3、鉴定物质的化学组成是属于 ( )A.定性分析 B.定量分析 C.结构分析 D.化学分析二.无机及分析化学的任务是什么?三.请简单阐述无机及分析化学在精细化学品、药学、食品及农业科学中的应用。
四.如何区分化学分析和仪器分析?五. 结合自己的实际情况谈一下自己将如何学习该课程。
本章答案:一.1.B 2.B 3.A 二.略三.略四.略五.略第一章物质的结构一、选择题1. 基态钠原子的最外层电子的四个量子数可能是( )A.3,0,0,+1/2B.3,1,0,+1/2C.3,2,1,+1/2D.3,2,0,-1/22. 已知某元素+3价离子的核外电子排布式为:1s22s22p63s23p63d5, 该元素在周期表中属于( )A.VIII族B.IIIA族C. IIIB族D. VA族3. 有d电子的原子,其电子层数至少是( )A. 1B. 2C. 3D. 44.某元素的价电子构型为3d14s2, 则该元素的原子序数为( )A.20B.21C.30D. 255.在Mn(25)原子的基态电子排布中,未成对电子数为( )A.2B.5C.8D. 16.最外层为5s1,次外层d轨道全充满的元素在( )A.IAB.IBC.IIAD. IIB7. 下列分子中属于极性分子的是( )A.O2 B.CO2 C.BBr3 D.NF38. 下列分子中中心原子采取sp杂化的是 ( )A.NH3 B.CH4C.BF3 D.BeCl29.下列分子中,偶极距为零的是 ( )A.CH3Cl B.NH3 C.BCl3 D.H2O10.下列液体只需要克服色散力就能沸腾的是 ( ) A.CCl4 B.H2O C.NH3 D.C2H5OH11.下列说法正确的是( )A.sp2杂化轨道是指1s轨道与2p轨道混合而成的轨道。
第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
无机及分析化学(第四版)南京大学3-45^R = pl ; JOCMPa = L 处屮丄 1 x273K P ; _ p ;Ts 拓XKPo _ 化X29MK“ mRT 0J64«xS /?ISXPa7 ' K 1 x 298A^“ rM = --------- -- ---------------------------------------------- : ----------------- mPV101.3kPa x 250x MJ"化学犬H CH= (0.<«6 +0.957)x10 '/nn/x8 3l5kPtr^m0/ lK 0273K -50-0xl0^L= 4735kPa* P (V|=r*V- 0<» ^-5 63)xO5=(> 25xP *1913451 iP fn ()MmkRi)6 (1) HI 为空肌・0■不录* P?以对空T 有P.VHSVi1013x4-(101 3^l9 6)Xi X-7.8L(Q*屮注怖AS.U1为可以他 A 了间妙|的临抒基*甲詩価眦分了内氯H.tfiAMp 、= L53g-L 'PV ~lOJJtFtfXSOOxlO *L=30je4, HHRn = —MRTx £00 耳 KJ83l5JtPd £z»w/ ^JC 1X273K =0086mnxil 53X)4Fax5O.OxlO V &订禅m 山•-AT 'x333K=0.957niirial札 15七 HtHjQ 的>100-1.71*98.29^Z 川仆丿―呱2<"丫1警RT 8JI5JtP^7 K 'x288A r=0 04%讪< H ,土臥i?l PV-nRT7用 x 4竟3x11*5 S.3I5X513⑶ShHpPHiffiT書色Ifi力k(3) iCUHr;繭音*农定向力如诱导力⑷ MjO>NdiO Mg:<电荀稔.H: > M fi0 M rt k⑸SiO^^SO;'fi 3期瓯f晶悻/ i吿为仔『晶障i6>SrK'f:>SnCL Sn^ttft*丸于Sn;r. £nCL.问人忖逆过常比创直1训*~上也』人、”1十2“""册和一卜MI即-46.02/f? mol1• -X945JW 1+丄X43WC/册厂-3A.%_屮*- 亠行侏比..川=391K丿加"■狞2比n NH -NH、~ 九Hg科+ 2A卜H凋■} — 4A4H^ I—九町.、一对即^.26KJ mnl 1= 1+2K4J6^J WM?/ '-4x的iJC/ imJ '-亠"卜“褂%% M=I57KJW0.2«Ox»W>02920x180 H-101n=(ftr=O. 2920 x8314x310 = 753Jt?^13 n-b*RT>(0 5C6H)4#640055H).0^0011 ^OJI *0.002) X8 314x298 ■ 2TWW 14. r r = —= ——— = L53**X1O *^-L*fir 8315x291*册二0.51芍< V - 0.1539x50.0x10⑶byAZ = A ;7> = 0,5I2X L54X I0 1 =7.88X 10 * ATLX6xL54xlO * - 2.86x10 *K⑷ 卜給tA|^AT t ^IAT r A*b7-无法测笊・15 f(As 3S^m nS' 广 2nH*16A :K J K-i('hJu |>fckS< L>A 1( \iB:ACl^MESCu^KJlxlCNkln. 4电赫:当囲菠两扣坝牛扣对运动时.滞动的帝电体与博酒寧体之何的电够5f )0/22.4xl7 560/22.4x17-IKK> xKKr ; = 29.K f rO^OxlO 1!- L 1 X29.H■ LS»7&M W L 1CH.NinMK 比为恥尚.心CHN0.7W 00«7l> 0.1727 .._ , 12 I HL21X I03/M 243x10 1A/ =1・86卿&?员|)<匚2欢 CL5&KKX24.5 関=0 162烁册川 1 - 162 :/ nw>J甘汕的ttl^ VTffi* M=92E rnul *100x10 £2 (WK 7心皿討 xIOOxlO.86 K 蘇诉沏*(\H,<)..X HX <X>H>NX N.>( X :h呵 O.543K -- —■ -------K f 1,853 -4V9 誓皈!7 }聲;xh - A\ x抵民一聊特殊的“艄棒眾小中较体额諒威奇聚躺甘了耳和逢捲朋压闵优第勵蛤构空算充#i 了浪f*我社像《attt:皎体因折入隴第順血析出的过科\H»ik液剂彷了在压力ft用卜曲怖搐藏向編渚帧楼时过稈称为屁洽走. ia (1)II水的澳逢圧高十演水.鱼适应了海廉的潘逢医创不健适应播永的褂進医.(2)雄里落液的液度裔Jilt圧大于植債体的濤逢压・菌物孔盐就M L里会凶失倉血枯娄.0)出涪解到雷中使水的融周点ffffi.44)江河中的畋悽在入海赴週列电解质艾牛最锻*5 光加M]船时*朋舷时金旃龌育保护朮用.再1 如见加扛他讷.总化箱对带陀肴媲沉ft用*洛独i口聚贰啟不会址厭・二會5C SO S ; M u &>;t>z pl s urun心T —o 丄-*5芋 丄-飞養n $艮丄+{二倉 nNEAE —)*(二学n s H a亠・v <£13^s 3i M 0—^二當 n二公;)x P丄-12X -呂 —x :( -1 n g X 7站<-1 2® Z T I O I ~- 1-33T T -- 1-3^-^r -—-i =三肾丄二零工6窘*£m 6f >"a=d 0 —「工F:-l 3x rl X T R k **nu垄3H <r u r J:-H pk weI fs pa —*=■■. HC9-6ni £ + B X ^^-«x 7N 空“ 7 I-5^3>・*- ;5 i -A二二X里 F n三X N寧z x -N*- E u ** 兰亠左*r-i 样 J --f i c 3AC -S =i 6 r二X ^--I R s i e x *©- X S T ^-s -X Z A f x dL ^s 咧&o-h1HL-L A X x %A X \h二 「〔二菽町丁-壬 M三工交二=x £j二K x二!!.>;-X .K二二右£y JI _X T o M= ・l s l =才・£亠法*51 I s l #5=l莘毕JA"::+必诃 1)- 2 X (SOtiM rwl ')' I 1*-'} 岷般= 1253.7Mfl!fl/_,% 比收存打"['"“xl 节工了k/別凶1 =195KM.75M工 U) <1) Wi 2V ; + 2fl ; = 4Wj(3)A r ; = {-116&.8M /w>/■')-(-15304W^Hjr')=361 Wk/ mflj'1- 1 A H F ,= ' X36Ih=M0 4M OWJ J 'r ■* 斗 『* 目s均砒■£反应IM*能・£生-_rtl + A t w k A1+A*W|fl _wt + A*H (W J-[2A t nj -AA 丿怙 fyi + At^)/ »i r J=I.U.IkJ M * + %际/ 用川"+ 祗Xk 丿曲# ')-(2x-165kJ mr>/ * * 276U mji/ 1)= -3<)k/ BW / ' a u> ><2) >⑶>4 <⑸>⑹< 10 ⑴M⑵盾人 ⑶mk<5/ 悄 k…940.6x10* JJFW /'1rf =373A :U> AS ・込宀"曲_5IO77K275 A r也际KISMta273K = 22AJKIM A rAft if,弁r 旳況乱g 慟如补比曙化时期加怕队 鮎阳燈间KIJ. W=PAV == 8314J<-1'x373r = 3Jfc/[J W 「"k. J八\= 40.7k/Af/=^-W = 4O.7U-3Jk/ = 3T6My Q 4070UJ do =—=T 373ATM .利用左卫:|血竹養系・灿新反I 柱汁:刨,人f (M 僦既生*小于0可(U 发生(U“:=卜口站MJ 血广)* {jrrmij 册腐)][Cs9b.8KJ 时,「)]+(-39丄42佃川')=2SJkJ rnpZ 1 小于G 阿览引 ⑵注心:=卜 132192 w f J")+2x(- 237 2k/flw/■')!-(-1797V wL )=07JJ 加" 天于0不可投牛') [( 18SU W ')+(-l37/2L/ ntflJ )|= 69.2U mn/ 1小于0可发生15 (I )苫12)否(訂 fi(4)遺;刃昔A r G ; = (-S%W nW)— [(—5515kJww 厂)+2x(-157.317 ^-1 )|= -2U 7W W"1 小于0-此反应可以发牛17.巾址“讥-珞斗AfG.Cb 181—25TAH 打门尸&门十166亦Ar6…(J>= 20—43TAG = 0= 1(WJ A -AG = AW-7M 此憶極人于彼故此J 诅不可发生⑴亠屮:二id 成物的b 射卜no 討砌的t 成対=* 393 5U flin/ 'J+nx(- 283-83M^/11| 匸 2222U 预胡■卜・564£25k/w 」初 牡山 ffX 9 jy m * JTf 'x300ftffi = 19llU19llU, = 135>nol =46?g5644 25}J fnoi 12n, G J CO, =「“O + CO*)* (-3^3.5k/mn/ ' )|-{-12O6.9U>M ?/ 1 )= 178.3k> mr>/ 1A r S ; =(3M 77 AT ' 1+(213,6JJC ' )-92,97JC ' = 160 4MT ' fejSHIftfStl 时 = 0即= Ql7E3xlt>Jmpf 1I604J A r 1 ~ 21 UHQH Y 、2H 、0A r G* - |&K2k71+(-22S.6k/?W ')]-(-1e8.6U ftirt/ '卜8.2打*»「$//: _ 卜24MRJ 加",)+523kJ w*rj/ ')-(- 2353k/') - 45.HM mr?/ "A,S* =(2IWJT Jl8S/U K ')-2827-K 1 =126 l/ Af 1 2>VB1 AG)0 '■卷不握4 36(吃时 AC ;-45,SkJ/W 1 -(3W +273)x126.1x10 \J - -34.Q2U rtrfl/小于"JiJfi 可皈览宅21虚川:・(-235如如「)-(-277血』誠")・42”37财/ **iMU :.r =I26JJ X 1SV ■HV-紀r m o &T -X『60-7-呂「9V Z1+・ ¥『伫$卩-f kPOMT l n m弗T m r m亠—【T H披-}*I m z n -j w v < 9 u p er F c-¥f n w -d -f oo £v ;f ,£-^*X A ><M H ^<-飞E r芒o tl丄二層s *m "丄丄二富7W«W丄菽丄二¥s *二A 丄 H v <Nxwy■£■?」l<一二z y —-u 巷、-hs H a —一电£/■工-hot"「工<A G?n"匸工\久*1生更物}工心心「1反庙拗-*197.15 + (-228.59)・(39436)-2x(-1 氐 4B) = L6KJ1UU =,KM3K fl xKPl N T O.* ^ij|.yi < i dPN)IO(Hi+2x=ll6 k=l6KPjjr* ■色心戶厶.血-■。
第1章 思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是( )A. 蔗糖(C 12H 22O 11)溶液B. 葡萄糖(C 6H 12O 6)溶液C. 丙三醇(C 3H 8O 3)溶液D. 尿素( (NH 2)2 CO )溶液解:选D 。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D 中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg -1下列水溶液中凝固点最低的是( )A. NaCl 溶液B. C 12H 22O 11溶液C. HAc 溶液D. H 2SO 4溶液解:选D 。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H 2SO 4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是( )A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
5.有浓度同为0.01 mol·L-1的电解质①NaNO3②Na2SO4③Na3PO4④MgCl2,它们对Fe(OH)3溶胶的聚沉能力大小顺序为()A. ①②③④B. ②④③① C ③②①④ D.③②④①解:选D。
根据哈迪-叔尔采规则:起聚沉作用的主要是与胶粒带相反电荷的离子。
相反电荷离子的价态愈高,聚沉能力愈大。
Fe(OH)3溶胶中胶粒带正电荷,起聚沉作用的应是电解质中的阴离子,且价态愈高,聚沉能力愈大。
所以聚沉能力由大到小的顺序为③②④①,其中由于④中氯离子数目大于①中硝酸根数目,参与聚沉溶胶的粒子数目多,所以④聚沉能力比①强。
二、填空题1.1 mol H,1 mol H2SO4,1 mol21H2SO4所表示的基本单元分别是 H 、 H2SO4、21H2SO4。
2.丁铎尔效应能够证明溶胶具有光学性质,其动力学性质可以由布朗运动实验证明,电泳和电渗实验证明溶胶具有电学性质。
3.将等体积的0.003mol·L-1AgNO3溶液和0.008mol·L -1KCl溶液混合所得的AgCl 溶胶的胶团结构式为 [(AgCl) m . n Cl-. (n–x) K+ ]x- . x K+,该溶胶在电场中向正极移动。
三、简答题1.什么叫分散系? 分散系是如何分类的?答:分散系:一种或几种物质分散到另一种物质中形成的混合物叫分散系。
被分散的物质叫分散质,分散其他物质的物质叫分散剂。
(1)按分散质或分散剂的状态分:九种,包括气-气分散系、液-气分散系、固-气分散系和气-液分散系、液-液分散系、固-液分散系及气-固分散系、液-固分散系、固-固分散系。
(2)按分散质粒子的大小分:三种。
分子离子分散系(d<1 nm)、胶体分散系(1 nm <d<100 nm)、粗分散系(d>100 nm)2.对稀溶液依数性进行计算的公式是否适用于电解质稀溶液和易挥发溶质的稀溶液?为什么?答:不适用。
当溶质是电解质的时候,拉乌尔定律发生偏离,主要原因电解质溶液由于溶质发生解离,使溶液中溶质粒子数增加,计算时应考虑其解离的因素,否则会使计算得到的Δp、ΔT b、ΔT f 、Π值比实验测得值小;另一方面,电解质溶液由于离子间的静电引力比非电解质之间的作用力大得多,因此用离子浓度来计算强电解质溶液的Δp、ΔT b、ΔT f 、Π时,其计算结果与实际值偏离较大,应该用活度代替浓度进行计算。
对易挥发溶质的稀溶液,由于其溶质不断挥发,溶液浓度不断变化,所以也无法进行依数性计算。
3.难挥发溶质的溶液,在不断的沸腾过程中,它的沸点是否恒定?其蒸气在冷却过程中的凝聚温度是否恒定?为什么?答:由于溶剂的挥发,溶液浓度逐渐增大,其沸点是逐渐升高的, 至溶液达到饱和后,沸点恒定;在蒸气冷却过程中,由于溶剂是纯净的,其凝聚温度是恒定的,等于溶剂的沸点。
4.若渗透现象停止了,是否意味着半透膜两端溶液的浓度也相等了?答:据范特霍夫的渗透压定律,若渗透现象停止了,说明渗透压相等,但其浓度不一定相等。
5.溶胶稳定的因素有哪些? 促使溶胶聚沉的办法有哪些? 用电解质聚沉溶胶时有何规律?答:溶胶稳定的因素有两个,一是溶胶具有动力学稳定性,另一个是聚结稳定性。
溶胶的动力学稳定性系指在重力的作用下,分散质粒子不会从分散剂中沉淀出来,从而保持系统的相对稳定的性质。
溶胶的聚结稳定性是指溶胶在放置过程中不发生分散质粒子的相互聚结,从而保持系统一定的分散度的性质。
促使溶胶聚沉的办法有加入电解质、将两种带相反电荷的胶体按一定的比例混合及加热等。
电解质对溶胶的聚沉作用取决于与胶粒所带电荷符号相反的离子,而且与其所带电荷的多少有关,一般来说,离子电荷越高,对溶胶的聚沉能力就越强,这个规律称为哈迪—叔尔采规则。
6.什么叫表面活性剂? 其分子结构有何特点?答:溶于水后能显着降低水的表面自由能的物质称为表面活性物质或表面活性剂。
表面活性剂的特性取决于其分子结构。
它的分子都是由极性基团和非极性基团两部分组成,极性基团如--OH,-COOH,-NH:,-SO:H等对水的亲和力很3强,称为亲水基;非极性基因如脂肪烃基-R,芳香基-Ar等对油的亲和力较强,称为亲油基或疏水基。
在表面活性剂溶于水后,分子中的亲水基进入水相,疏水基则进入油相,这样表面活性剂分子就浓集在两相界面上,形成了定向排列的分子膜,使相界面上的分子受力不均匀情况得到改善,从而降低了水的表面自由能。
7.乳浊液的类型与所选用的乳化剂的类型有何关系? 举例说明。
答:乳化剂不仅能提高乳浊液的稳定性,还能决定乳浊液的类型。
一般来说,亲水性乳化剂有利于形成O/W型乳浊液,亲油性乳化剂有利于形成W/O型乳浊液。
8.解释如下现象:(1)为何江河入海处常会形成三角洲?答:三角洲的形成过程体现了胶体的性质:当河水和海水混合时,由于它们所含的胶体微粒所带电荷的性质不同,由于静电作用,异性电荷相互吸引,导致胶体的颗粒变大,最终沉淀了出来,日积月累的堆积,就形成了三角洲。
(2)加明矾为什么能够净水?答:由于天然水中含有带负电荷的悬浮物(黏土等),使天然水比较浑浊,而明矾胶粒却带正电荷,当将明矾加入天然水中时,两种电性相反的水解产物Al(OH)3的胶体相互吸引而聚沉,从而达到净水的效果。
(3)不慎发生重金属离子中毒,为什么服用大量牛奶可以减轻病状?答:由于可溶性重金属离子(强电解质)可使胶体聚沉,人体组织中的蛋白质作为一种胶体,遇到可溶性重金属盐会凝结而变性,误服重金属盐会使人中毒。
如果立即服用大量鲜牛奶这类胶体溶液,可促使重金属与牛奶中的蛋白质发生聚沉作用,从而减轻重金属离子对机体的危害。
(4)肉食品加工厂排出的含血浆蛋白的污水,为什么加入高分子絮凝剂可起净化作用?答:因为含有血浆蛋白的污水具有胶体溶液的性质,加入高分子絮凝剂会对胶体溶液起到敏化作用,促进胶体的凝聚,从而净化了污水。
四、计算题1.10.00 mL 饱和 NaCl 溶液质量为 12.003 g ,将其蒸干后得到 NaCl 3.173 g ,求:(1)NaCl 的质量分数 ;(2)NaCl 的质量摩尔浓度 ; (3)NaCl 的物质的量浓度 ;(4)各组分的摩尔分数。
解:(1)2644.0g 003.12g 173.3)NaCl ()NaCl (===总m m w (2)1kg mol 149.6kg1000/)173.3003.12(mol )443.58/173.3()NaCl ()NaCl (/)NaCl ()NaCl ()NaCl ()NaCl (-⋅ =-=-=-=m m M m m m n b 总总 (3)1L mol 429.51000/00.10443.58/173.3)NaCl (/)NaCl ()NaCl ()NaCl (-⋅ ====V M m V n c (4) )O H (/)NaCl (/)NaCl ()NaCl (/)NaCl ()O H ()NaCl ()NaCl ()NaCl (2O H 22M m M m M m n n n x +=+= 2.今有两种溶液,其一为1.50g 尿素(NH 2)2CO 溶于200g 水中;另一为42.8g 未知物溶于1000g 水中,这两种溶液在同一温度开始沸腾,计算这种未知物的摩尔质量。
解:由于都是水溶液,所以溶剂的沸点升高常数K b 相同,又知, 未知尿素t t ∆=∆,由稀溶液的依数性公式:B b b b K t ⋅=∆ ,可得两种溶液的质量摩尔浓度相等:设未知物的摩尔质量为)B (M ,代入上式得解之得: )B (M =342.7 g·mol -13.将1.00 g 硫溶于20.0 g 萘中,使萘的凝固点降低1.30℃,萘的K f 为6.8℃·kg · mol -1,求硫的摩尔质量和分子式。
解:设未知物的摩尔质量为)B (M ,根据溶液的凝固点降低公式: B f f b K t ⋅=∆,将数据代入得:解之得 )B (M =261.5 g · mol -1由于单个硫元素的摩尔质量为M (S) = 32.065g ·mol -1, 则M (B) / M (S)= 261.5/32.065 =8.155,即约8个S 原子形成一个硫分子。
所以该单质硫的分子式为:S 84.从某种植物中分离出一种未知结构的有特殊功能的生物碱,为了测定其相对分子质量,将19g 该物质溶于100g 水中,测得溶液的沸点升高了0.060K ,凝固点降低了0.220K 。
计算该生物碱的相对分子质量。
解:利用沸点升高和凝固点降低都能够测量未知物的摩尔质量,但一般选取相对较大的数据来计算较准确,这里我们选取凝固点降低来计算。