常见金属的性质实验报告
- 格式:doc
- 大小:15.00 KB
- 文档页数:3

实验活动4:金属的化学性质和某些物理性质学生实验报告单1. 实验目的本实验旨在探究金属的化学性质和某些物理性质,并通过实验结果分析金属的特性和变化过程。
2. 实验原理金属是一类常见的物质,具有一些独特的化学性质和物理性质。
在本实验中,我们将通过以下实验方法来研究金属的特性:- 实验一:金属的化学反应。
通过观察金属与酸、氧化剂等物质的反应,了解金属与不同物质的化学反应性。
- 实验二:金属的燃烧性质。
通过观察金属在氧气中的燃烧现象,了解金属的燃烧性质。
- 实验三:金属的电导性能。
通过使用电流表和电池将金属接入电路,测量金属的电导性能。
3. 实验步骤实验一:金属的化学反应1. 取少量金属样品,将其分别与酸、氧化剂等物质接触。
2. 观察金属与不同物质的反应过程和产物生成情况。
3. 记录下实验结果。
实验二:金属的燃烧性质1. 取少量金属样品,放置在装有氧气的实验器皿中。
2. 使用火柴点燃金属样品。
3. 观察金属在氧气中的燃烧现象。
4. 记录下实验结果。
实验三:金属的电导性能1. 准备一个电路,包括一个电流表和一个电池。
2. 将金属样品与电路连接,并关闭电路开关。
3. 测量电流表上的电流数值。
4. 记录下实验结果。
4. 实验结果根据实验步骤,记录下实验过程中的观察结果和数据。
5. 结果分析根据实验结果,分析金属的化学性质和某些物理性质。
结合实验过程中观察到的现象和数据,对金属的特性和变化过程进行解释和分析。
6. 实验结论根据实验结果和分析,总结金属的化学性质和某些物理性质。
提出对实验的改进和进一步研究的建议。
7. 参考文献列出本实验中使用到的参考文献。
8. 附录附上实验中使用到的数据表格、图表等相关材料。

金属材料的物理性质实验
实验目的
本实验旨在通过对不同金属材料的物理性质进行实验研究,以探究金属材料的性质差异以及其应用。
实验材料
- 不同金属材料(铁、铜、铝等)
- 导线、电池、电流表
- 木板、弹簧等辅助材料
实验步骤
1. 将不同金属材料分别制成相同的形状和尺寸,称其质量并记录。
2. 将导线接在电池正负极上,形成电路。
3. 将电流表置于电路中,记录电路中的电流强度。
4. 依次将不同金属材料放入电路中,再次记录电路中的电流强度。
5. 将实验结果进行归纳、总结,分析不同金属材料的导电性能差异以及对应的应用情况。
实验注意事项
- 在实验过程中应该注意电路的连通性以及操作的安全性,避免产生电击等不良影响。
- 实验前应检查实验器材的完整性并认真了解实验步骤,保障实验数据的准确性。
- 实验完成后,应当及时清洗实验器材并完善实验报告。
实验价值
本实验对于深入了解金属材料的物理性质、提高实验技能,具有重要的意义。
同时,通过对实验结果的分析与总结,亦可为工程技术及材料科学领域的相关研究提供参考价值。

一、实验目的1. 了解铬和锰的物理性质、化学性质及反应特点;2. 掌握铬和锰在酸、碱、盐溶液中的反应规律;3. 分析铬和锰在工业生产中的应用。
二、实验原理1. 铬(Cr):铬是一种银白色金属,具有光泽,熔点高,硬度大。
铬在常温下不与氧气、水反应,但在高温下能与氧气反应生成Cr2O3。
铬具有多种氧化态,其中+3价和+6价较为稳定。
铬的氧化还原反应如下:(1)氧化反应:Cr + 2H2O2 + 4H+ = Cr2O72- + 4H2O(2)还原反应:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O2. 锰(Mn):锰是一种银白色金属,具有光泽,熔点高,硬度大。
锰在常温下不与氧气、水反应,但在高温下能与氧气反应生成MnO2。
锰具有多种氧化态,其中+2价和+4价较为稳定。
锰的氧化还原反应如下:(1)氧化反应:Mn + 2H2O2 + 2H+ = MnO2 + 2H2O(2)还原反应:MnO2 + 4H+ + 2e- = Mn2+ + 2H2O三、实验仪器与药品1. 仪器:试管、烧杯、酒精灯、滴管、试管夹、铁架台、滤纸、蒸馏水等。
2. 药品:铬粉、锰粉、硫酸、盐酸、氢氧化钠、氯化钠、氯化钾、硫酸铜、硫酸铁、硫酸亚铁、硫酸锰、硫酸钾等。
四、实验步骤1. 铬的氧化还原反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸,搅拌至铬粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
2. 锰的氧化还原反应实验:(1)取一支试管,加入少量锰粉;(2)加入少量硫酸,搅拌至锰粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
3. 铬和锰的置换反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸铜溶液,观察溶液颜色变化;(3)取一支试管,加入少量锰粉;(4)加入少量硫酸铜溶液,观察溶液颜色变化。

实验报告金属的性质金属的性质引言金属是一类常见的物质,其在自然界中广泛存在,并且在人类的生活中起着重要的作用。
本实验旨在探究金属的性质,包括导电性、导热性、延展性和强度等方面,并通过实验结果来进一步了解金属的特性。
导电性金属的导电性是其最显著的性质之一。
在实验中,我们可以通过简单的电路实验来验证金属的导电性。
首先,我们选取了几种常见的金属,如铜、铁和铝,制作了相应的导线。
然后,将这些导线连接到电池和电灯泡上,观察电灯泡是否发光。
实验结果显示,无论是铜、铁还是铝导线,电灯泡都能够正常发光,说明金属具有良好的导电性能。
导热性金属的导热性也是其重要的性质之一。
为了验证金属的导热性,我们进行了一个简单的实验。
首先,我们选取了几种金属,如铜、铁和铝,并将它们分别加热到相同的温度。
然后,将这些金属块分别放置在冷却水中,观察金属块的冷却速度。
实验结果显示,铜块的冷却速度最快,铁次之,而铝块的冷却速度最慢。
这表明金属的导热性能与其热传导能力有关,而铜的导热性能最好。
延展性金属的延展性是指金属在外力作用下能够延展变形的能力。
为了验证金属的延展性,我们进行了一个拉伸实验。
首先,我们选取了几种金属丝,如铜丝、铁丝和铝丝,并将它们固定在拉力计上。
然后,逐渐增加拉力,观察金属丝的变形情况。
实验结果显示,铜丝和铁丝在受力时能够较大程度地延展,而铝丝的延展性相对较差。
这说明金属的延展性与其晶粒结构和原子间的结合方式有关。
强度金属的强度是指金属材料能够承受的外力大小。
为了验证金属的强度,我们进行了一个压缩实验。
首先,我们选取了几种金属块,如铜块、铁块和铝块,并将它们分别放置在压力机上。
然后,逐渐增加压力,观察金属块的变形情况。
实验结果显示,铜块和铁块在受力时能够较好地保持形状,而铝块的强度相对较低,容易发生塑性变形。
这表明金属的强度与其晶粒结构和原子间的结合方式有关。
结论通过以上实验,我们可以得出以下结论:金属具有良好的导电性、导热性、延展性和强度。

化学实验报告铝化学实验报告:铝引言:铝是一种常见的金属元素,具有轻、强、耐腐蚀等特性,广泛应用于工业和日常生活中。
本实验旨在通过一系列化学实验,探究铝的性质和应用。
实验一:铝的制备实验目的:制备纯度较高的铝样品,用于后续实验。
实验步骤:1. 将铝矿石研磨成粉末,并与氢氧化钠混合,加入适量的水。
2. 在恒温搅拌下,加入稀硫酸,反应生成氢气和铝氢氧化物。
3. 将铝氢氧化物加入氢氧化钠溶液中,生成氢氧化铝。
4. 在高温下,将氢氧化铝还原为纯度较高的铝。
实验二:铝的物理性质实验目的:研究铝的物理性质,如密度、熔点等。
实验步骤:1. 测量铝的质量和体积,计算密度。
2. 使用熔点仪测定铝的熔点。
3. 使用电子显微镜观察铝的微观结构。
实验三:铝的化学性质实验目的:研究铝与其他物质的反应性。
实验步骤:1. 将铝与氧气反应,观察铝的燃烧现象。
2. 将铝与酸反应,观察气体的产生和反应速率。
3. 将铝与水反应,观察氢气的产生和反应速率。
4. 将铝与盐酸反应,观察气体的产生和反应速率。
实验四:铝的应用实验目的:探究铝在工业和日常生活中的应用。
实验步骤:1. 研究铝的导电性能,制作铝导线并测试其导电效果。
2. 研究铝的轻质特性,制作铝合金并测试其强度和耐腐蚀性。
3. 研究铝的反射性能,制作铝镜并测试其反射效果。
4. 研究铝的耐高温性能,将铝制品加热至高温并观察其变化。
实验五:铝的环境影响实验目的:研究铝对环境的影响。
实验步骤:1. 将铝与不同的环境因素接触,如水、空气、土壤等。
2. 测定不同条件下铝的腐蚀速率。
3. 研究铝对植物生长的影响。
结论:通过一系列实验,我们深入了解了铝的制备方法、物理性质、化学性质、应用和环境影响。
铝作为一种重要的金属元素,在工业和日常生活中发挥着重要的作用。
然而,我们也要注意铝对环境的影响,合理使用和处理铝制品,以保护环境和人类健康。

实验一金属钠的性质实验实验报告实验一:金属钠的性质实验报告一、实验目的:通过实验探究金属钠的性质,了解其在水中的反应、燃烧以及与酸的反应。
二、实验原理:金属钠是一种活泼的金属,其在与水反应时能够迅速释放氢气和产生碱性溶液;在空气中易于燃烧产生火焰;与酸反应可以产生氢气和相应的盐。
三、实验步骤:1.准备工作:戴好实验室必备的个人防护装备,包括实验服、手套和护目镜。
2.将一小块金属钠放入砂盘中,加入适量的水。
3.观察水中的反应,观察金属钠与水的反应速度以及是否有气体产生。
4.用蜡烛点燃金属钠,观察其燃烧现象。
5.在试管中加入适量的盐酸,然后加入少量的金属钠,观察反应情况。
四、实验结果及数据分析:1.金属钠与水反应的观察:金属钠与水接触后剧烈活动,放出氢气,并且产生了碱性溶液,溶液呈现碱性。
金属钠+水→氢气+氢氧化钠2.金属钠燃烧的观察:点燃金属钠后,钠迅速燃烧产生明亮的橙黄色火焰,并伴有剧烈的爆炸声。
金属钠+氧气→金属氧化物3.金属钠与盐酸反应的观察:金属钠与盐酸反应迅速,产生大量氢气,并生成相应的氯化钠。
金属钠+盐酸→氢气+氯化钠五、实验讨论:1.金属钠与水的反应速度非常快,钠能够迅速与水分子反应生成氢气和氢氧化钠。
这是因为金属钠是一种活泼的金属,具有较低的电负性,易于失去电子,与水中的氢离子反应形成氢气。
2.金属钠的燃烧能力很强,它在空气中与氧气反应产生高温的火焰,并且有剧烈的爆炸声。
这是因为钠在点燃后,与氧气反应生成金属氧化物,释放大量的能量,形成明亮的火焰。
3.金属钠与酸反应会产生大量的氢气,并生成相应的盐。
这是因为钠可以与酸中的氢离子反应生成氢气,同时形成相应的盐。
六、实验结论:金属钠具有活泼的化学性质,与水反应生成氢气和碱性溶液;在空气中燃烧产生火焰;与酸反应生成氢气和相应的盐。
七、实验安全注意事项:1.戴上个人防护装备,包括实验服、手套和护目镜。
2.实验操作时要小心谨慎,避免金属钠的溅射。

主族金属实验报告引言主族金属是周期表中的一类金属元素,包括氢、锂、钠、钾等元素。
这些金属具有许多重要的特性,如导电性、热导性和反应性等。
本实验旨在通过实验方法研究主族金属的一些基本性质,以加深对这些金属的认识。
实验目的1. 探究主族金属的导电性能;2. 研究主族金属与水反应的特点;3. 分析主族金属的物理性质。
实验材料与仪器1. 主族金属样品:氢气、锂片、钠块、钾块;2. 试管、试管夹、酒精灯、电源、导线等。
实验步骤1. 测量主族金属的导电性:分别取一小块锂片、钠块、钾块,用导线连接到电源上,观察电流表的读数;2. 主族金属与水的反应:将一小块锂片、钠块、钾块分别投入烧杯中的水中,观察反应过程;3. 主族金属的物理性质:观察主族金属的颜色、质地等物理性质。
实验结果与分析1. 导电性实验结果表明,钠和钾的导电性较好,电流较大,而锂的导电性相对较弱;2. 主族金属与水的反应:锂与水反应较激烈,产生氢气并放出大量热量;钠与水反应也较为激烈,产生氢气和氢氧化钠溶液;钾与水反应最为剧烈,产生氢气和氢氧化钾溶液;3. 主族金属的物理性质:锂为银白色软金属,钠为银白色软金属,钾为银白色软金属。
结论通过实验,我们了解到主族金属具有良好的导电性能和较强的反应性。
在与水反应时,主族金属会产生氢气,并放出大量热量。
此外,主族金属的物理性质也有所不同,但都具有银白色的外观和软金属的质地。
展望未来可以进一步研究主族金属的其他性质,如熔点、沸点等,以更全面地了解这些金属的特性。
同时,也可探讨主族金属在工业生产中的应用,为相关领域的发展提供参考。
总结主族金属实验为我们提供了一个深入了解金属元素的机会,通过实际操作,我们能够更加直观地感受到这些金属的性质和特点。
希望通过这次实验,能够激发学生对主族金属的兴趣,进一步拓展他们的化学知识。
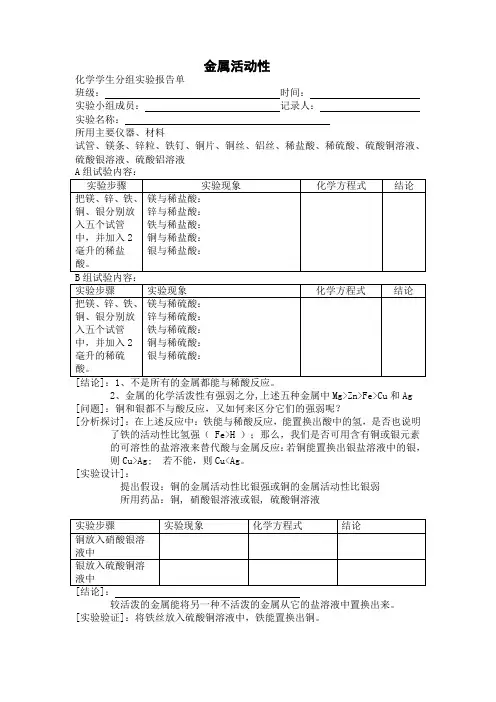
金属活动性
化学学生分组实验报告单
班级:时间:
实验小组成员:记录人:
实验名称:
所用主要仪器、材料
试管、镁条、锌粒、铁钉、铜片、铜丝、铝丝、稀盐酸、稀硫酸、硫酸铜溶液、硫酸银溶液、硫酸铝溶液
2、金属的化学活泼性有强弱之分,上述五种金属中Mg>Zn>Fe>Cu和Ag [问题]:铜和银都不与酸反应,又如何来区分它们的强弱呢?
[分析探讨]:在上述反应中:铁能与稀酸反应,能置换出酸中的氢,是否也说明了铁的活动性比氢强( Fe>H );那么,我们是否可用含有铜或银元素
的可溶性的盐溶液来替代酸与金属反应:若铜能置换出银盐溶液中的银,则Cu>Ag; 若不能,则Cu<Ag。
[实验设计]:
提出假设:铜的金属活动性比银强或铜的金属活动性比银弱
所用药品:铜, 硝酸银溶液或银, 硫酸铜溶液
:
较活泼的金属能将另一种不活泼的金属从它的盐溶液中置换出来。
[实验验证]:将铁丝放入硫酸铜溶液中,铁能置换出铜。

大学实验金属的实验报告大学实验金属的实验报告引言:金属是一种常见的材料,在生活和工业中都有广泛应用。
为了更深入地了解金属的性质和特点,我们进行了一项实验,旨在研究金属的导电性、热传导性和强度等方面的特性。
本报告将详细介绍我们的实验设计、实验步骤、结果分析以及实验中遇到的问题和解决方法。
实验设计:我们选择了三种常见的金属材料进行实验,分别是铜、铁和铝。
这三种金属具有不同的导电性和热传导性能,我们希望通过实验来验证这些性质。
实验设备包括电流表、电压表、热导仪和材料测试机等。
实验步骤:1. 导电性实验:首先,我们将三种金属材料分别连接到电源电路中,然后在电路中加入电流表和电压表。
通过改变电源电压,我们测量了金属导体中的电流和电压,并计算出每种金属的电阻值。
实验中,我们还测试了不同截面积的导体,以探究导体截面积对电阻的影响。
2. 热传导性实验:在这个实验中,我们使用了热导仪来测量金属材料的热传导性能。
我们将一个端口加热,另一个端口冷却,并测量两个端口之间的温度差。
通过改变加热功率和测量时间,我们得到了金属材料的热传导系数。
3. 强度测试:为了研究金属材料的强度,我们使用了材料测试机。
我们将金属样品放入测试机中,逐渐施加力量,直到金属样品发生断裂。
通过测量金属样品断裂前的最大承载力,我们可以得到金属材料的强度。
结果分析:根据我们的实验结果,我们得出了以下结论:1. 铜具有最好的导电性能,其电阻值较小,适用于需要高导电性的应用。
2. 铝具有较好的热传导性能,适用于需要快速散热的场合。
3. 铁具有较高的强度,适用于需要承受较大力量的工程结构。
问题与解决:在实验过程中,我们遇到了一些问题,但通过合理的解决方法,我们成功地完成了实验。
1. 在导电性实验中,我们发现电流表和电压表的读数有时会波动。
为了解决这个问题,我们重新检查了电路连接,并保证电源电压稳定。
2. 在热传导性实验中,我们发现热导仪的测量结果受到环境温度的影响。

金属元素实验报告引言金属元素是化学中非常重要的一部分,它们广泛存在于我们周围的世界中并担负着重要的功能与作用。
通过实验,我们可以更深入地了解金属元素的性质与特点,并且探索它们在不同条件下的变化。
本报告将重点介绍我们进行的实验及其结果,旨在进一步认识金属元素。
实验一:金属元素的物理性质我们首先进行的实验是测量金属元素的物理性质,包括密度、熔点和导电性。
我们选取了四种常见的金属元素进行测试,分别是铁、铜、铝和锌。
1.1 密度我们使用称重仪测量了每种金属元素的质量,并通过体积计算出它们的密度。
结果显示,铁的密度最高,铜次之,铝最低。
这与我们平时对金属的认识相符,表明密度与金属元素的原子结构密切相关。
1.2 熔点我们对四种金属元素进行了熔点测试,并发现它们的熔点依次升高。
这与金属元素的周期表位置、原子半径和相互作用有关。
铁的熔点最高,铜次之,铝最低。
1.3 导电性我们使用导电仪测试了四种金属元素的导电性。
结果显示,铜和铁具有良好的导电性,而铝和锌导电性较差。
这与我们常见的金属导电性的认识一致,也说明金属元素的电子结构对其导电性有重要影响。
实验二:金属元素的化学反应在第二个实验中,我们研究了金属元素的化学反应。
我们选择了铁和铝进行了两个实验。
2.1 铁与氧气的反应我们将一小块铁置于华氏管中,并加热到红热状态。
然后我们引入氧气,观察了反应的现象。
我们发现,铁与氧气在高温下发生了化学反应,产生了铁氧化物。
这与我们常见的氧化反应相符,也进一步加深了我们对金属元素与氧气相互作用的认识。
2.2 铝与酸的反应我们将片状铝放入稀硫酸中,并观察了反应的过程与结果。
我们发现,铝与酸反应生成了氢气和硫酸盐,同时产生了化学反应的温度变化。
这表明,铝能与酸发生化学反应,生成新的物质,这与我们平时观察到的铝腐蚀现象相符。
结论通过对金属元素的实验研究,我们更加深入地了解了金属元素的物理和化学性质。
实验结果显示,金属元素的性质受到多种因素的影响,包括其原子结构、周期表位置和与其他物质的相互作用。

一、实验目的1. 掌握铁、镍、钴三种过渡金属的基本化学性质。
2. 了解这三种金属在不同条件下的反应规律。
3. 通过实验,加深对金属腐蚀与防护知识的理解。
二、实验原理铁(Fe)、镍(Ni)、钴(Co)是周期表中的过渡金属元素,它们在化学反应中表现出不同的性质。
本实验通过一系列的化学反应,观察和分析这三种金属的化学性质。
三、实验材料与仪器1. 实验材料:铁片、镍片、钴片、稀盐酸、硫酸铜溶液、硫酸亚铁溶液、硫酸镍溶液、硫酸钴溶液、氢氧化钠溶液、蒸馏水。
2. 实验仪器:试管、烧杯、酒精灯、滴管、玻璃棒、试管夹。
四、实验步骤1. 铁的化学性质- 将铁片放入盛有稀盐酸的试管中,观察现象。
- 将铁片放入硫酸铜溶液中,观察现象。
- 将铁片放入硫酸亚铁溶液中,观察现象。
2. 镍的化学性质- 将镍片放入盛有稀盐酸的试管中,观察现象。
- 将镍片放入硫酸铜溶液中,观察现象。
- 将镍片放入硫酸亚铁溶液中,观察现象。
3. 钴的化学性质- 将钴片放入盛有稀盐酸的试管中,观察现象。
- 将钴片放入硫酸铜溶液中,观察现象。
- 将钴片放入硫酸亚铁溶液中,观察现象。
4. 金属腐蚀与防护- 将铁片、镍片、钴片分别放入氢氧化钠溶液中,观察现象。
- 将铁片、镍片、钴片分别放入蒸馏水中,观察现象。
五、实验现象1. 铁的化学性质- 铁片与稀盐酸反应:产生气泡,溶液变浅绿色。
- 铁片与硫酸铜溶液反应:铁片表面有红色物质析出,溶液由蓝色变为浅绿色。
- 铁片与硫酸亚铁溶液反应:无明显现象。
2. 镍的化学性质- 镍片与稀盐酸反应:无明显现象。
- 镍片与硫酸铜溶液反应:无明显现象。
- 镍片与硫酸亚铁溶液反应:无明显现象。
3. 钴的化学性质- 钴片与稀盐酸反应:无明显现象。
- 钴片与硫酸铜溶液反应:无明显现象。
- 钴片与硫酸亚铁溶液反应:无明显现象。
4. 金属腐蚀与防护- 铁片、镍片、钴片在氢氧化钠溶液中均无明显现象。
- 铁片、镍片、钴片在蒸馏水中均无明显现象。
一、实验目的1. 掌握铁、钴、镍三种金属的物理性质和化学性质。
2. 了解铁、钴、镍在空气中氧化和水溶液中反应的特性。
3. 研究铁、钴、镍的还原性和氧化性。
4. 探究铁、钴、镍的配合物生成及其在离子鉴定中的作用。
二、实验原理铁、钴、镍是过渡金属,具有丰富的化学性质。
在空气中,铁、钴、镍容易被氧化生成相应的氧化物;在水溶液中,它们可以与酸、碱反应,表现出还原性和氧化性。
铁、钴、镍的配合物在离子鉴定中具有重要作用。
三、实验仪器与试剂1. 仪器:试管、烧杯、酒精灯、镊子、滴管、玻璃棒、电子天平、pH计等。
2. 试剂:铁粉、钴粉、镍粉、硫酸、盐酸、氢氧化钠、氨水、氯水、溴水等。
四、实验步骤1. 物理性质观察(1)观察铁、钴、镍的颜色、硬度、磁性等物理性质。
(2)分别将铁、钴、镍放入试管中,用酒精灯加热,观察其燃烧现象。
2. 化学性质实验(1)氧化性实验①将铁、钴、镍分别放入试管中,加入少量硫酸,观察反应现象。
②将铁、钴、镍分别放入试管中,加入少量盐酸,观察反应现象。
③将铁、钴、镍分别放入试管中,加入少量氢氧化钠,观察反应现象。
(2)还原性实验①在酸性介质中,往盛有1毫升溴水的试管中加入3滴1:1H2SO4的溶液,然后滴加0.2mol/L(NH4)2Fe(SO4)2溶液,观察现象。
②在碱性介质中,在一试管中加入2毫升蒸馏水和5滴3mol/LH2SO4,煮沸以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体。
在另一试管中注入3mL6mol/LNaOH溶液,煮沸。
冷却后,用一长滴管吸约0.5mL氢氧化钠溶液,插入硫酸亚铁铵溶液内,慢慢放出氢氧化钠溶液。
(3)配合物生成实验①将Fe2+、Co2+、Ni2+分别与氨水反应,观察沉淀现象。
②将过量的氨水加入Co2+或Ni2+离子的水溶液中,观察沉淀溶解现象。
3. 离子鉴定实验根据实验现象,鉴定Fe2+、Co2+、Ni2+的存在。
五、实验结果与分析1. 物理性质观察结果铁、钴、镍均为银白色金属,具有磁性。
一、实验目的1. 掌握金属的物理性质,如熔点、沸点、硬度、密度等。
2. 研究金属的化学性质,如金属与酸、碱的反应,金属的腐蚀与防护等。
3. 了解金属在工业生产中的应用。
二、实验原理金属是一类具有良好导电性、导热性、延展性的元素,具有独特的物理和化学性质。
本实验通过一系列实验验证金属的物理性质和化学性质,并探讨金属在工业生产中的应用。
三、实验仪器与材料1. 仪器:熔点仪、沸点仪、硬度计、密度计、试管、烧杯、酒精灯、滴定管、pH计等。
2. 材料:金属样品(铁、铜、铝、锌等)、稀盐酸、稀硫酸、氢氧化钠、氢氧化钾、氯离子、硫酸铜、氯化钠等。
四、实验步骤1. 金属的物理性质实验(1)熔点测定:将金属样品放入熔点仪中,记录熔点。
(2)沸点测定:将金属样品放入沸点仪中,记录沸点。
(3)硬度测定:用硬度计测定金属样品的硬度。
(4)密度测定:将金属样品放入烧杯中,加入已知体积的水,记录水的体积变化,计算密度。
2. 金属的化学性质实验(1)金属与酸的反应:将金属样品放入试管中,加入稀盐酸,观察反应现象。
(2)金属与碱的反应:将金属样品放入试管中,加入氢氧化钠溶液,观察反应现象。
(3)金属的腐蚀与防护:将金属样品分别暴露在空气、酸、碱等环境中,观察腐蚀现象。
(4)金属的氧化还原反应:将金属样品与氯离子、硫酸铜等反应,观察反应现象。
3. 金属在工业生产中的应用实验(1)金属导电性实验:将金属样品接入电路,观察电路通断。
(2)金属导热性实验:将金属样品加热,观察温度变化。
(3)金属延展性实验:将金属样品拉伸、弯曲,观察形状变化。
五、实验结果与分析1. 金属的物理性质实验结果(1)熔点:铁熔点为1538℃,铜熔点为1084℃,铝熔点为660.3℃。
(2)沸点:铁沸点为2862℃,铜沸点为2567℃,铝沸点为2467℃。
(3)硬度:铁硬度为HRC 55-60,铜硬度为HB 100-110,铝硬度为HB 60-80。
(4)密度:铁密度为7.87g/cm³,铜密度为8.96g/cm³,铝密度为2.70g/cm³。
第1篇一、实验目的1. 探究铁在不同环境条件下的生锈速率。
2. 分析铁的氧化还原性质。
3. 了解铁及其化合物的性质和应用。
二、实验原理铁是一种具有较强还原性的金属,在潮湿的空气中易发生氧化反应,生成铁锈(Fe2O3·nH2O)。
通过改变实验条件,可以观察到铁生锈速率的变化,并进一步了解铁的氧化还原性质。
三、实验用品1. 实验材料:铁片、铁钉、铜片、锌片、碳棒、硫酸亚铁溶液、硫酸铜溶液、硫酸铁溶液、硫酸锌溶液、硫酸铝溶液、硫酸镁溶液、氯化钠溶液、食盐水、氢氧化钠溶液、蒸馏水、稀硫酸、稀盐酸、稀氢氧化钠溶液、干燥剂、pH试纸、玻璃棒、试管、烧杯、漏斗、滤纸、电子天平、温度计、移液管、滴定管、分光光度计等。
2. 实验仪器:电子天平、温度计、移液管、滴定管、分光光度计、试管、烧杯、漏斗、滤纸、玻璃棒、pH试纸等。
四、实验步骤1. 铁生锈速率实验(1)取三片铁片,分别放入三个装有食盐水的烧杯中,观察并记录铁片生锈情况。
(2)将一片铁片放入装有蒸馏水的烧杯中,另一片铁片放入装有食盐水并加热至沸腾的烧杯中,观察并记录铁片生锈情况。
(3)将一片铁片放入装有食盐水并加入少量氢氧化钠溶液的烧杯中,观察并记录铁片生锈情况。
2. 铁的氧化还原性质实验(1)取少量硫酸亚铁溶液,加入少量铜片,观察溶液颜色变化。
(2)取少量硫酸铁溶液,加入少量锌片,观察溶液颜色变化。
(3)取少量硫酸铜溶液,加入少量铁粉,观察溶液颜色变化。
3. 铁及其化合物的性质实验(1)取少量硫酸亚铁溶液,加入少量氢氧化钠溶液,观察沉淀生成情况。
(2)取少量硫酸铁溶液,加入少量氢氧化钠溶液,观察沉淀生成情况。
(3)取少量硫酸铜溶液,加入少量氢氧化钠溶液,观察沉淀生成情况。
五、实验结果与分析1. 铁生锈速率实验(1)食盐水中铁片生锈速度较快,加热后生锈速度加快,加入氢氧化钠溶液后生锈速度减慢。
(2)蒸馏水中铁片生锈速度较慢,加热后生锈速度加快。
(3)食盐水并加入氢氧化钠溶液中,铁片生锈速度减慢。
第1篇一、实验目的1. 了解金属单质的物理性质和化学性质。
2. 掌握金属活动性顺序及其应用。
3. 通过实验验证金属单质与酸、盐溶液的反应规律。
二、实验原理金属活动性顺序是指金属元素在化学反应中置换氢气或金属离子的能力由强到弱的排列顺序。
金属活动性顺序的应用主要体现在以下两个方面:1. 只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气。
2. 只有排在前面的金属才能把后面的金属从它的盐溶液中置换出来。
三、实验用品1. 金属单质:铁、铜、锌、铝、镁、银等。
2. 酸:稀盐酸、稀硫酸等。
3. 盐溶液:硫酸铜溶液、硝酸银溶液等。
4. 其他用品:试管、烧杯、酒精灯、镊子、玻璃棒等。
四、实验步骤1. 观察金属单质的物理性质,如颜色、硬度、密度等。
2. 将金属单质分别与稀盐酸反应,观察是否有气泡产生,记录反应现象。
3. 将金属单质分别与硫酸铜溶液反应,观察是否有红色固体析出,记录反应现象。
4. 将金属单质分别与硝酸银溶液反应,观察是否有银白色固体析出,记录反应现象。
5. 对比实验结果,分析金属单质的活动性顺序。
五、实验现象1. 铁与稀盐酸反应,产生气泡,溶液由无色变为浅绿色。
2. 铜与稀盐酸反应,无明显现象。
3. 铝与稀盐酸反应,产生气泡,溶液由无色变为无色。
4. 镁与稀盐酸反应,产生气泡,溶液由无色变为无色。
5. 银与稀盐酸反应,无明显现象。
6. 铁与硫酸铜溶液反应,产生红色固体,溶液由蓝色变为浅绿色。
7. 铜与硫酸铜溶液反应,无明显现象。
8. 铝与硫酸铜溶液反应,产生红色固体,溶液由蓝色变为无色。
9. 银与硫酸铜溶液反应,无明显现象。
10. 铁与硝酸银溶液反应,产生银白色固体,溶液由无色变为无色。
11. 铜与硝酸银溶液反应,产生银白色固体,溶液由无色变为蓝色。
12. 铝与硝酸银溶液反应,产生银白色固体,溶液由无色变为无色。
六、实验结论1. 金属活动性顺序为:镁 > 铝 > 锌 > 铁 > 铜 > 银。
常见金属的性质实验报告实验报告:常见金属的性质一、实验目的1. 了解常见金属的性质,如密度、熔点、导电性等;2. 掌握金属的简易鉴别方法;3. 培养实验操作能力和观察能力。
二、实验原理1. 金属的密度:单位体积内金属的质量,不同金属密度不同;2. 金属的熔点:金属从固态转变为液态的温度,不同金属熔点不同;3. 金属的导电性:金属内部自由电子的移动能力,不同金属导电性不同。
三、实验器材与试剂1. 实验器材:铁架台、酒精灯、镊子、坩埚钳、测密度仪、导电仪等;2. 试剂:盐酸、硫酸铜溶液等。
四、实验步骤1. 金属密度测试:(1)取适量金属样品,用测密度仪测其质量m1;(2)将金属样品放入量筒中,加水至刻度线附近,记录体积V1;(3)计算金属样品的密度ρ1 = m1 / V1。
2. 金属熔点测试:(1)将金属样品放置在铁架台上,用酒精灯加热;(2)观察金属样品从固态转变为液态的温度,记录为金属的熔点Tm。
3. 金属导电性测试:(1)将金属样品连接到导电仪的两个电极上;(2)调节导电仪的电流,观察金属样品导电性的大小,记录为导电系数σ。
4. 金属简易鉴别:(1)将金属样品分别放入盐酸中,观察是否有气体产生;(2)将金属样品分别放入硫酸铜溶液中,观察是否有红色沉淀生成。
五、实验结果与分析1. 金属密度测试结果:金属1:密度ρ1 = (填入实验结果数据)g/cm³;金属2:密度ρ2 = (填入实验结果数据)g/cm³;金属3:密度ρ3 = (填入实验结果数据)g/cm³。
2. 金属熔点测试结果:金属1:熔点Tm1 = (填入实验结果数据)℃;金属2:熔点Tm2 = (填入实验结果数据)℃;金属3:熔点Tm3 = (填入实验结果数据)℃。
3. 金属导电性测试结果:金属1:导电系数σ1 = (填入实验结果数据)S/m;金属2:导电系数σ2 = (填入实验结果数据)S/m;金属3:导电系数σ3 = (填入实验结果数据)S/m。
金属实验报告一、实验目的本次金属实验的主要目的是深入了解几种常见金属的物理性质、化学性质以及它们在不同条件下的反应情况,通过实验观察和数据记录,分析金属的特性,为后续的学习和实际应用提供基础依据。
二、实验材料与设备1、实验材料镁条(Mg)铝片(Al)铁钉(Fe)铜片(Cu)稀盐酸(HCl,浓度约为 2mol/L)稀硫酸(H₂SO₄,浓度约为 2mol/L)硫酸铜溶液(CuSO₄)硝酸银溶液(AgNO₃)2、实验设备试管若干镊子砂纸酒精灯火柴托盘天平量筒三、实验步骤1、金属的物理性质观察用肉眼观察镁条、铝片、铁钉和铜片的颜色和光泽。
用手触摸感受这几种金属的硬度。
用天平分别称量相同体积的镁条、铝片、铁钉和铜片的质量,计算它们的密度。
2、金属与酸的反应分别取四支洁净的试管,标记为 A、B、C、D。
用镊子分别夹取一小段镁条、一小片铝片、一枚铁钉和一小片铜片,放入对应的试管中。
向 A 试管中加入约 5mL 稀盐酸,向 B 试管中加入约 5mL 稀硫酸,观察反应现象。
记录产生气泡的快慢和溶液颜色的变化。
同样的方法,向 C 试管和 D 试管中分别加入稀盐酸和稀硫酸,观察并记录反应现象。
3、金属与盐溶液的反应取两支洁净的试管,标记为 E 和 F。
向 E 试管中加入约 5mL 硫酸铜溶液,然后用镊子将一枚铁钉放入其中,观察反应现象。
向 F 试管中加入约 5mL 硝酸银溶液,将一小片铜片放入其中,观察反应现象。
4、金属的加热实验用镊子夹取一段镁条,在酒精灯上点燃,观察燃烧现象。
用镊子夹取一小片铝片,在酒精灯上加热至红热,观察其变化。
四、实验现象及记录1、金属的物理性质镁条:银白色,有光泽,质地较软,密度较小。
铝片:银白色,有光泽,质地较软,密度较小。
铁钉:银白色(表面有锈迹时为红褐色),有光泽,质地较硬,密度较大。
铜片:紫红色,有光泽,质地较硬,密度较大。
2、金属与酸的反应镁条与稀盐酸反应:剧烈反应,产生大量气泡,试管外壁发热,溶液颜色不变。
常见金属的性质实验报告
实验报告:常见金属的性质
一、实验目的
1. 了解常见金属的性质,如密度、熔点、导电性等;
2. 掌握金属的简易鉴别方法;
3. 培养实验操作能力和观察能力。
二、实验原理
1. 金属的密度:单位体积内金属的质量,不同金属密度不同;
2. 金属的熔点:金属从固态转变为液态的温度,不同金属熔点不同;
3. 金属的导电性:金属内部自由电子的移动能力,不同金属导电性不同。
三、实验器材与试剂
1. 实验器材:铁架台、酒精灯、镊子、坩埚钳、测密度仪、导电仪等;
2. 试剂:盐酸、硫酸铜溶液等。
四、实验步骤
1. 金属密度测试:
(1)取适量金属样品,用测密度仪测其质量m1;
(2)将金属样品放入量筒中,加水至刻度线附近,记录体积V1;
(3)计算金属样品的密度ρ1 = m1 / V1。
2. 金属熔点测试:
(1)将金属样品放置在铁架台上,用酒精灯加热;
(2)观察金属样品从固态转变为液态的温度,记录为金属的熔点Tm。
3. 金属导电性测试:
(1)将金属样品连接到导电仪的两个电极上;
(2)调节导电仪的电流,观察金属样品导电性的大小,记录为导电系数σ。
4. 金属简易鉴别:
(1)将金属样品分别放入盐酸中,观察是否有气体产生;
(2)将金属样品分别放入硫酸铜溶液中,观察是否有红色沉淀生成。
五、实验结果与分析
1. 金属密度测试结果:
金属1:密度ρ1 = (填入实验结果数据)g/cm³;
金属2:密度ρ2 = (填入实验结果数据)g/cm³;
金属3:密度ρ3 = (填入实验结果数据)g/cm³。
2. 金属熔点测试结果:
金属1:熔点Tm1 = (填入实验结果数据)℃;
金属2:熔点Tm2 = (填入实验结果数据)℃;
金属3:熔点Tm3 = (填入实验结果数据)℃。
3. 金属导电性测试结果:
金属1:导电系数σ1 = (填入实验结果数据)S/m;
金属2:导电系数σ2 = (填入实验结果数据)S/m;
金属3:导电系数σ3 = (填入实验结果数据)S/m。
4. 金属简易鉴别结果:
金属1:与盐酸反应产生气体,与硫酸铜溶液无反应;
金属2:与盐酸反应产生气体,与硫酸铜溶液无反应;
金属3:与盐酸无反应,与硫酸铜溶液反应生成红色沉淀。
六、实验结论
1. 不同金属的密度、熔点、导电性存在差异,可以用来鉴别金属;
2. 金属的密度、熔点、导电性与其化学性质有关,可作为金属性质研究的依据。
七、实验注意事项
1. 实验过程中要注意安全,防止烫伤、腐蚀等事故发生;
2. 测量密度时,要确保金属样品完全浸没在水中;
3. 测量熔点时,要观察金属样品熔化的整个过程;
4. 测量导电性时,要确保金属样品与电极接触良好。
八、实验报告撰写日期:XXXX年X月X日。