实验数据(表格)型计算题
- 格式:doc
- 大小:68.00 KB
- 文档页数:4


初中化学七类计算题典型例题初中化学计算题的类型有多种,其中包括化学式计算、化合价计算、化学方程式计算、溶液计算、化学方程式和溶液简单综合计算、应用质量守恒定律计算等,下面简单进行一下归类:(一)有关化学式计算题类型:第一种类型:标签型化学式计算题:1、锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下。
市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效。
下图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:(1)葡萄糖酸锌中各元素的质量比 ;(2)葡萄糖酸锌中锌元素的质量分数 。
(精确到0.01%)(3)某患者除正常饮食吸锌元素外,还需服用该品牌葡萄糖酸锌口服液。
若治疗一个疗程需补充104mg 锌元素,而这些锌有75%来自该口服液,则患者共需服用 支葡萄糖酸锌口服液?(简写出解题过程)2、在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐"包装袋上的部分说明。
请回答下列问题:(1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的化学性质之一是 ;(2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比 ;(3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少? ;(计算结果精确到0.01,下同)(4)计算1kg 这样的食盐中,应加入 g 碘酸钾(用最高含碘量计算)第二种类型:叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH3CH(NH2)COOH等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比 .(2)丙氨酸的相对分子质量 .(3)丙氨酸中碳、氢、氧、氮元素的质量比 .2、抗震救灾,众志成城。
用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C3O3N3Cl3),又称高氯精。


有关溶液的溶质质量分数计算题一、利用溶质质量分数的定义式及变形式的有关计算题1.在农业上,有时用 10%~ 20%的食盐溶液来选种。
现配制 15%的食盐溶液 200kg 需要食盐和水各多少千克2.将 60g20%的食盐溶液和 30g5%的食盐溶液相混淆,求所得混淆溶液的溶质的质量分数。
3.向 100g溶质的质量分数为 10%的 KNO3溶液中加入 10g水后,所得溶液的溶质质量分数为;若加入 10g KNO3后,溶质的质量分数为4.200C 时,将一溶质质量分数为20%的氯化钠溶液蒸干,获得20g 固体,求该溶液质量。
5.实验室要配制 50g 溶质质量分数为 20%的硝酸钾溶液。
现有 25g 溶质的质量分数为 40% 的硝酸钾溶液、 20g 溶质的质量分数为 15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请采用上述药品,设计三种配制方案填以下表 :方案配制时所需药品及用量方案一方案二方案三二、饱和溶液中溶质质量分数的有关计算1.已知 T 0C 时,硝酸钠的溶解度为80g,求这温度时硝酸钠饱和溶液的溶质的质量分数。
2.某种物质的水溶液,加热蒸发掉 10g 水,冷却到 20℃,有晶体析出。
此时溶液中溶质的质量分数为 26%,求 20℃时该物质的溶解度。
3.在 60℃时, 50g 水中最多能溶解 55g 硝酸钾把 60℃时 210g 水中的硝酸钾饱和溶液蒸发掉 50g 水,再降到 60℃,求析出晶体后溶液的溶质的质量分数。
三、溶液的稀释浓缩有关计算:(一)不波及体积的计算:1.将 200g 含水 99%的 NaOH溶液的含水量变成98%,应蒸发掉多少克水2.欲配制 50g3%的氯化钠溶液,需6%的氯化钠溶液和水各多少克,(二)波及体积的计算1.用 98%的浓硫酸(密度为 1.84g/cm3)配制成 25%的稀硫酸 500g,需浓硫酸和水多少毫升2.把 5mL 溶质的质量分数为 62%的浓硝酸(密度为 l.38g/cm3 )和 20mL 水混淆,计算稀释后硝酸的溶质的质量分数。

初中化学反应计算题计算题型一:文字叙述型1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量分数?2.把7g含杂质的锌片(杂质不与硫酸反应)放在盛有100g足量的稀硫酸的烧杯里,反应停止后称得烧杯里物质的总质量为106.8g。
(1)计算反应后生成的氢气的质量;(2)计算不纯的锌片中单质锌的质量分数。
3、用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g固体物质,计算原混合物中二氧化锰的质量?4、取34克过氧化氢溶液再加入0.5克二氧化锰后至质量不减小时,所得剩余物的质量33.7克。
求:(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。
5.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。
试计算:(1)硫酸中氢、硫、氧元素的质量比为:_______________(2)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?(3)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?计算题型二:图像呈上升趋势型1.在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。
向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。
请根据题意回答问题:(1)当滴加了73 g稀盐酸时,放出气体的总质量为___________g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是___________。
(3)当滴加了73 g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2.现取13.4g含氯化钙的氯化钠固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。

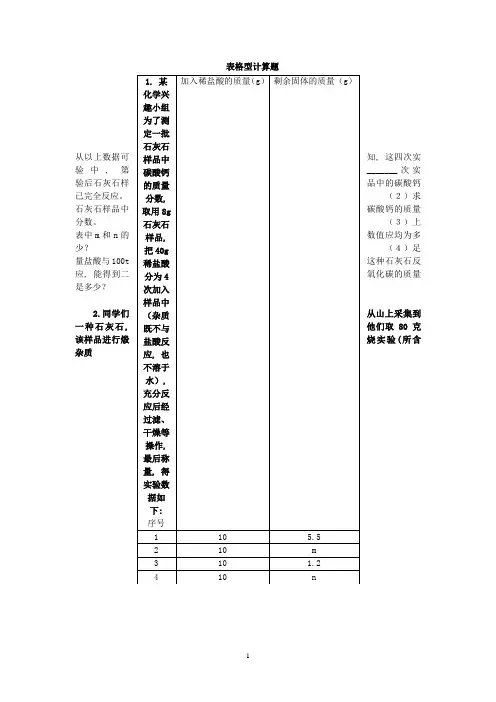
表格型计算题从以上数据可知, 这四次实验中, 第_______次实验后石灰石样品中的碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
(3)上表中m和n的数值应均为多少?(4)足量盐酸与100t这种石灰石反应, 能得到二氧化碳的质量是多少?2.同学们从山上采集到一种石灰石, 他们取80克该样品进行煅烧实验(所含杂质t0t1t2t3t4t5t6在煅烧过程中不发生变化), 测得反应后固体的质量(m)与反应时间(t)的关系如下表:反应时间t∕s反应后固体的质量m∕g 80 75 70 66 62 58 58 请回答下列问题:(1)当石灰石完全反应后, 生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数, 写出计算过程。
(3)请在下面坐标图中, 画出煅烧时生成气体的质量(m)随时间(t)变化的曲线。
样品的质量/g 滤渣的质量/g3.某课外活动小组为了测定一批石灰石中碳酸钙的质量分数, 将石灰石样品研成粉末, 然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应, 也不溶于水), 过滤、洗涤、干燥后称量滤渣质量的数据如下表:实验序号第一次 3.4 0.3第二次 3.6 0.4第三次 5.0 0.5(1)该样品中碳酸钙质量分数的平均值为: (结果精确到0. 1%)。
(2)引起三次实验数据差异的操作原因可能是: 。
(3)若利用题(1)的结果, 煅烧100t这种石灰石, 理论上最多能得到氧化钙多少吨?(结果精确到0.1t)请分析表中数据回答并计算[(4)要求写计算过程 ](1)生成的沉淀是(填写化学式)。
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应, 最多生成沉淀质量为 g。
(3)m= g。
(4)原固体混合物中Na2CO3的质量分数是多少?(1)表中X的值为;(2)求样品中碳酸钙的质量分数;(3)烧杯④中物质充分反应后所得溶液的质量为 g。
试问答:(1)10.0g样品与45g盐酸充分反应后, 盐酸是否还剩余_____ _____ (填“是”或“否”), 样品中碳酸钙的质量分数是_______________。

中考特训10 化学反应的计算10.1 表格型计算重难点集训目录一、表格型计算与解答1、已知反应前与反应后几个物理量,求待测量、反应性质与组成元素等2、固体样品与某溶液反应(金属或大理石样品等)与酸的反应3、求反应中某段的溶质种类与溶液中的溶质质量分数重难点习题集训实验小组在实验室找到一瓶含有铜和铁的均匀混合物。
为测定该混合物中铁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:请分析数据,回答下列问题:(1)该混合物中铁的质量分数为多少?(2)表中的W=________(填数值)。
(3)第1组实验中所得滤液中的溶质是________(用化学式表示)。
(4)计算第4组实验中所得溶液溶质的质量分数。
(写出计算过程,结果精确到0.1%)在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为 0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与 pH 值,记录数据如下表:(1)观察上表发现,当反应时间在________s 时,氢氧化钠与盐酸恰好中和。
(2)分析上表数据发现,在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低,请分析原因_____ 。
(3)结合上表中滴入稀盐酸体积与 pH 值的变化数据,试计算氢氧化钠稀溶液中溶质的质量。
(稀盐酸的密度取 1.0 g/mL ;化学方程式为 NaOH +HCl=NaCl +H 2O )、大理石(主要成分是碳酸钙)是重要的建筑材料。
天安门前的华表、人民大会堂的不少柱子都是用大理石做的。
某大理石厂为了测定一批大理石中碳酸钙的质量分数,取用5g大理石样品,把25g稀盐酸分5次(每次5g)加入到样品中(样品中的杂质与盐酸不反应,也不溶于水),充分反应后,经过滤、洗涤、干燥等操作(无物质损失),最后称量,得到的实验数据如下表:⑴第________次实验中稀盐酸肯定过量。
⑵该大理石中碳酸钙的质量分数为____________。
⑶计算 5g 该大理石样品中的碳酸钙完全反应后生成二氧化碳的质量。
化学计算四大主流题型解题点拨江苏省大丰市草堰中学朱世友文章来源:2008年下半年度《试题与研究》化学计算是初中化学的重要内容,也是中考的必考知识点。
随着新课标的实施,化学计算打破了原有命题模式,以灵活多样的形式呈现出来。
其中,与实验探究、生产生活紧密相连的表格型、图象型、标签型、自编自解型计算成了化学计算的四大主流题型,出现的频率相当高,尤其是前三种题型占到整个化学计算的八成左右。
这些类型计算题能够考查分析问题、学科融合以及自主创新等能力。
现就四大主流题型,精选典型试题作一分析。
一、表格型计算题表格型计算题的特点是,计算与实验探究相结合,以表格的形式呈现实验数据,且数据之间具有一定的关联。
表格型计算题提供的数据通常较多,若不加分析就轻易代入,易出现错误解答。
例题1.(2008年山东潍坊市中考题)某化学研究小组对当地的石灰石样品进行了研究。
称取石灰石样品8 g ,把40 g 稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石(1)第4次剩余物质的质量m =_________g ;(2)石灰石样品中CaCO 3的质量分数为__________;(3)计算稀盐酸的溶质质量分数。
解析 (1)第1次加入10 g 稀盐酸,参加反应的CaCO 3的质量为:8 g -5.5 g =2.5 g ;第2次加入10 g 稀盐酸,参加反应的CaCO 3的质量为:5.5 g -3 g =2.5 g ;第3次加入10 g 稀盐酸,参加反应的CaCO 3的质量为:3 g -1.6 g =1.4 g 。
分析上述计算结果可知:第1、2次所加稀盐酸完全反应;第3次所加稀盐酸有剩余,样品中CaCO 3已完全反应,剩余固体为不与盐酸反应的杂质,显然,m =1.6 g 。
(2)8 g 石灰石样品中含CaCO 3的质量为:8 g -1.6 g =6.4 g样品中CaCO 3的质量分数为:%80%10084.6=⨯gg (3)以第1次加入稀盐酸的数据计算。

初中化学计算题一、根据化学式的计算1、计算相对分子质量相对分子质量=化学式中各原子的相对原子质量的总和。
点拨:①计算物质的相对分子质量时,同种元素的相对原子质量与其原子个数是相乘的关系,不同种元素相对质量是相加的关系。
②计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
③化学式中原子团(或根)右下角的数字表示的是原子团(或根)的个数。
计算时先求一个原子团或根的总相对原子质量,再乘以原子团(或根)的个数,即得出几个原子团的总相对原子质量。
2、计算物质中各元素的质量比组成化合物的各元素的质量比=化合物中各元素的相对原子质量总和(即相对原子质量与原子个数乘积)之比。
点拨:①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数5、求化学式点拨:求物质化学式的主要类型:①由元素的相对原子质量和化合物的相对分子质量,确定化学式。
②根据化合物中某元素质量分数确定化合物的化学式。
③已知化合物中元素的质量比和相对原子质量,确定化学式。
原子个数比=元素的质量比:相对原子质量比④根据质量守恒定律确定化学式。
6、计算不纯物中某元素(或某纯净物)的质量分数计算公式:不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
实际上某元素的质量分数÷化学式中该元素的质量分数×100%二、根据化学方程式的计算根据化学方程式的计算就是从量的方面来研究物质变化的一种重要的方法,其计算步骤和方法,一般分为以下几步:①设未知量,未知量不带单位,常用X表示.②根据题意确定反应物与生成物,写出并配平反应的化学方程式.③在有关物质化学式下面写出相对分子质量并代入已知量和所设未知量. ④列比例式求解,写出答案.在初中阶段,根据化学方程式的计算,主要有以下几种基本类型.(1)根据化学方程式计算反应物、生成物间的质量比反应物、生成物间的质量比,就是各反应物、生成物相对分子质量×计量数之比. (2)根据化学方程式计算反应物或生成物的质量反应物或生成物质量的计算,一般是根据化学方程式中各反应物、生成物间的质量比来求算的,对某些反应,可直接依据质量守恒定律进行计算.(3)根据化学方程式进行含有一定且杂质的反应物或生成物的计算根据化学方程式的计算,其反应物或生成物的质量必须是纯物质的质量.含有一定量杂质的反应物或生成物的质量,必须换算成纯物质的质量,才能按根据化学方程式的计算步骤和方法进行计算.纯物质质量=含有一定量杂质的物质质量×该物质质量分数三、有要溶液组成的计算1.用溶质所占溶液的质量分数表示溶液的组成,其关系如下:溶质的质量分数= 溶质质量溶质+溶剂× 100%=溶液质量溶质质量× 100%在饱和溶液中: 溶质的质量分数=+溶解度溶解度g 100× 100%2、有关溶液加水稀释的计算在溶液加水稀释过程中,溶质的质量分数将随溶液的稀释而改变,溶质质量分数一定的溶液加水稀释,稀释前后溶质的总质量不会发生改变.溶液加水稀释的计算,根据的就是这个道理.M 浓溶液×浓溶液的溶质质量分数=M 稀溶液×稀溶液的溶质质量分数 =(M 浓溶液+M 水)×稀溶液的溶质质量分数 3、溶质的质量分数在化学方程式的应用反应后溶液的质量=反应物的总质量(包含溶液的质量)-生成气体或沉淀的质量 四、综合计算题分类解析从近几年全国各地的中考化学试题来看,化学计算已经走出了“为计算而计算”的考查误区,考题所涉及的内容更加注重与日常生活、工农业生产的联系;更加注重对同学们图表、数据、信息、实验综合分析能力的考查。

nt h初中化学表格计算题答案:75% 1g/4g=75% 14.6%(1)75% 1g/4g=75%(2)解:由表中数据可知第三次加入5 g 稀盐酸后,3 g 碳酸钙与15 g 稀盐酸刚好完全反应。
设稀盐酸中溶质的质量为xCaC03 + 2HCl === CaCl 2 + H 20 + C02↑ 100 733g x73/100 =" x" / 3 x="2.19" g 稀盐酸的溶质质量分数为: 2.19/15×100%=14.6%2、现将石灰石样品15 g 与105.4 g 稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:反应时间/s 202020202020质量/g119.52118.64117.76116.88116116(1)样品中碳酸钙的质量分数。
(计算结果保留1位小数)答案:(1)0.96 (2)81.7%试题分析:(1)此题是数据分析、处理题,因为随着反应的进行,氧气不断产生,故剩余固体质量不断减少,直至不再发生变化,说明 结束,故直接根据质量守恒定律,生成氧气的质量=3g-2.04g=0.96g (2)根据化学反应:2KClO 32KCl + 3O 2↑中氧气和氯酸钾的质量关系,即可求出氯酸钾的质量,进an dAn ga re 而计算原混合物中氯酸钾的质量分数解:原混合物中氯酸钾的质量为x 2KClO 32KCl + 3O 2↑ 245 96 x 0.96g答:原混合物中氯酸钾的质量分数为81.7%。
4、某样品为Cu 和CuO 的混合物。
为测定样品中CuO 的含量,甲、乙、丙、丁四位学生用同一样品分别进行实验,测定的数据如下:物 质 质 量学生甲学生乙学生丙学生丁所取固体样品的质量 /g 30252020加入硫酸溶液的质量 /g 100100100120反应后剩余固体的质量 /g22171212分析实验数据,回答下列问题:(1)求混合物中氧化铜的质量分数(2)求硫酸溶液的质量分数(3)反应后所得溶液中溶质的质量分数。
中考特训10 化学反应的计算10.1 表格型计算重难点集训目录一、表格型计算与解答1、已知反应前与反应后几个物理量,求待测量、反应性质与组成元素等2、固体样品与某溶液反应(金属或大理石样品等)与酸的反应3、求反应中某段的溶质种类与溶液中的溶质质量分数实验小组在实验室找到一瓶含有铜和铁的均匀混合物。
为测定该混合物中铁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:请分析数据,回答下列问题:(1)该混合物中铁的质量分数为多少?(2)表中的W=________(填数值)。
(3)第1组实验中所得滤液中的溶质是________(用化学式表示)。
重难点习题集训(4)计算第4组实验中所得溶液溶质的质量分数。
(写出计算过程,结果精确到0.1%)在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为 0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与 pH 值,记录数据如下表:(1)观察上表发现,当反应时间在________s 时,氢氧化钠与盐酸恰好中和。
(2)分析上表数据发现,在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低,请分析原因_____ 。
(3)结合上表中滴入稀盐酸体积与 pH 值的变化数据,试计算氢氧化钠稀溶液中溶质的质量。
(稀盐酸的密度取 1.0 g/mL ;化学方程式为 NaOH +HCl=NaCl +H 2O ) 【答案】(1)125(2)氢氧化钠与盐酸反应会放出热量,导致温度上升,反应结束产热停止,还要向外散热,所以温度下降。
(3)设氢氧化钠稀溶液中溶质的质量为 xNaOH+HCl=NaCl+H2O40 36.5X 0.14640∶x=36.5∶0.146 g x=0.16 g、大理石(主要成分是碳酸钙)是重要的建筑材料。
天安门前的华表、人民大会堂的不少柱子都是用大理石做的。
某大理石厂为了测定一批大理石中碳酸钙的质量分数,取用5g大理石样品,把25g稀盐酸分5次(每次5g)加入到样品中(样品中的杂质与盐酸不反应,也不溶于水),充分反应后,经过滤、洗涤、干燥等操作(无物质损失),最后称量,得到的实验数据如下表:⑴第________次实验中稀盐酸肯定过量。
表格型计算题1、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用 4 g石灰石样品,把20 g 稀盐酸分4次加人样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:(1)该石灰石样品中碳酸钙的质量分数是;(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
2、某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:请计算:(1)2.0g石灰石样品中碳酸钙的质量为,石灰石中碳酸钙的质量分数为。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
3、某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用8g石灰石样品,把40g稀盐酸分为4次加入样品中(杂质既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:(1)从以上数据可知,这四次实验中,第_______次实验后石灰石样品中的碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
(3)上表中m和n的数值应均为多少?(4)足量盐酸与100t这种石灰石反应,能得到二氧化碳的质量是多少?4、某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:(1)测定过程中发生反应的化学方程式为;(2)从以上数据可知,最后剩余的0.6g固体的成分是;第六次实验中,第次加入稀硫酸时样品中的镁已经完全反应;表格中m= .(3)计算合金样品镁的质量分数。
(4)计算所用稀硫酸中H2SO4的质量分数。
5、某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成。
计算题提高训练班级__________ 座号_____ 姓名__________ 分数__________一、表格类计算1. (2023年南浦绣山温二外等校二模)实验室制取二氧化碳时,选择合适溶质质量分数的盐酸,有利于减少盐酸的浪费。
小博分别取100克溶质质量分数为7.3%、14.6%、21.9%的盐酸与足量的石灰石进行了三组实验,实验中每2分钟用电子天平测量生成的二氧化碳质量,数据记录见表。
请根据上述信息回答问题:(1)小博推测表中a 的值小于2.58,结合以上数据,分析原因 。
(2)小博用100克溶质质量分数为21.9%的盐酸进行实验,充分实验后,请计算盐酸溶液的实际用量(保留2位小时)。
(3)小博猜想盐酸的浪费可能跟盐酸的性质有关,为进一步验证自己的猜想,他设计了如下装置加以检验,并记录下表数据。
比较m1,m2,m3的大小。
2. (2023年温州外国语一模)用沉淀法可测定食用碱样品中碳酸钠的质量分数。
取11g 食用碱样品(有少量的杂质氯化钠)加水完全溶解制成100g 溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:(1)实验前,向食用碱样品溶液中滴入紫色石蕊试液,溶液呈 色。
(2)表中数据M 的值为 。
(3)计算该食用碱样品碳酸钠的质量分数。
(结果保留到0.1%)3. (2023年温州二中一模)烧杯中装有50克盐酸和氯化镁的混合溶液。
小科同学为测定该混合溶液中氯化镁溶液的质量分数,将200克10%的氢氧化钠溶液分5次加入烧杯中,得到沉淀的质量记录如下表,反应中的化学方程式为:(1)若小科在称量沉淀前,没有将沉淀上吸附的溶质清晰掉直接干燥,则会造成所测定的氯化镁质量 (选填“偏大”或“偏小”或“无影响”)(2)反应前混合溶液中氯化镁的质量分数为多少?(要求具体计算过程)(3)试计算第三次加入氢氧化钠溶液后,得到的沉淀质量M 为 克4. (2023年丽水中考)小科在某次家庭劳动实践时发现厕所污垢通常用洁厕灵进行清洗,他对家里某品牌洁厕灵的有效成分及其含量进行实验研究。
为测定某石灰石样品中CaCO3的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应,也不溶于水)有关实验数据如下表:反应前反应后实验数据烧杯和稀盐酸的质量石灰石样品的质量烧杯及剩余物的质量150 克12克157.6克(1)根据质量守恒定律计算,反应中生成二氧化碳的质量.(2)求该石灰石中含CaCO3的质量分数.考点:根据化学反应方程式的计算.专题:综合计算(图像型、表格型、情景型计算题).分析:在本题中,分析表格数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.解答:解:(1)根据质量守恒定律,二氧化碳的质量=150g+12g-157.6g=4.4g.故答案为:4.4克;(2)设碳酸钙的质量为xCaCO3+2HCl=CaCl2+CO2↑+H2O100 44x 4.4g100x=444.4gx=10g10g12g×100%≈83.3% 答:该石灰石中含CaCO3的质量分数是83.3%.故答案为:83.3%实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20g,完全溶于水中.然后取用了一定溶质质量分数的氢氧化钠溶液100 g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:次数物质的质量1 2 3 4加入氢氧化钠溶液的质量/g 25 25 25 25生成沉淀的质量/g 2.9 X 8.7 8.7(1)上表中X的数值为5.8;(2)计算原固体混合物样品中氯化镁的质量分数是多少?考点:根据化学反应方程式的计算.专题:有关化学方程式的计算.分析:(1)对比表中前三组的数据可以得出X的值.(2)由生成沉淀的总质量根据氯化镁与氢氧化钠反应的化学方程式可以计算出氯化镁的质量,进而计算出样品中氯化镁的质量分数.解答:解:(1)由表中1、3两次的数据可知,25g氢氧化钠溶液与氯化镁反应能生成2.9g沉淀,因此50g 氢氧化钠溶液能生成5.8g沉淀.(2)设样品中氯化镁的质量分数为x.MgCl2+2NaOH=Mg(OH)2↓+2NaCl95 5820g×x 8.7g9558=20g×x8.7g,x=71.25%答:(1)5.8;(2)原固体混合物样品中氯化镁的质量分数为71.25%为了测定某铜锌合金中铜的质量分数,取合金样品跟稀盐酸反应.三次实验的有关数据如下表:(1)根据上表中的数据分析,当铜锌合金中的锌与稀盐酸中的HCl恰好完全反应时,合金样品的质量与稀盐酸的质量之比为20:73.(2)计算该铜锌合金中铜的质量分数.67.5%.考点:根据化学反应方程式的计算.专题:有关化学方程式的计算;金属与金属材料.分析:(1)从三次实验数据可知,第一、第二次反应中稀盐酸过量,锌完全反应生成氢气为0.1g,第三次反应中锌过量,又因为第三次稀盐酸完全反应产生的氢气恰好也为0.1g,所以第一、二次反应中合金的质量与第三次稀盐酸的质量恰好完全反应,从而得出它们的质量比.(2)由于铜与稀盐酸不反应,故铜锌合金与稀盐酸的反应,为锌与稀盐酸的反应,根据生成的氢气的质量和化学方程式可求得10g铜锌合金中锌的质量,进一步可求出铜锌合金中铜的质量分数;解答:解:(1)第一、二次反应中合金的质量为10g;第三次稀盐酸的质量为36.5g;由于合金中的锌与稀盐酸恰好完全反应所取合金与所用稀盐酸分别为10g,36.5g,故其质量比为20:73故答案为:20:73.(3)设合金中锌的质量为xZn+2HCl═ZnCl2+H2↑65 2x 0.1g65x=20.1g解之得:x=3.25g合金中铜的质量为:10g-3.25g═6.75g该铜锌合金中铜的质量分数为:6.75g10g×100%=67.5%故答案为:67.5%(2010•钦州)实验室中某瓶浓盐酸的标签如图所示.请根据有关信息计算:(1)该瓶盐酸溶液的质量是595g.(2)欲配制148g溶质质量分数为5%的稀盐酸,需这种浓盐酸20g.(3)40g氢氧化钠溶液跟73g溶质质量分数为5%的稀盐酸恰好完全反应.计算氢氧化钠溶液中溶质的质量分数.考点:根据化学反应方程式的计算;一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算.专题:溶液的组成及溶质质量分数的计算;溶质质量分数与化学方程式相结合的计算.分析:(1)从标签中的所标注的盐酸的体积和密度可以求出盐酸的质量;(2)根据溶液稀释前后溶质的质量不变结合溶质的质量分数来解答;(3)氢氧化钠和盐酸反应生成了氯化钠和水,由于它们是恰好完全反应,所以可以根据盐酸的质量进行求算.解答:解:(1)从标签中可以知道盐酸的体积为500mL,密度为1.19g/cm3,可以据此求出盐酸的质量为:1.19g/cm3×500mL=595g;(2)设需要这种浓盐酸的质量为x,根据稀释前后溶质的质量不变可知:148g×5%=x•37%解得:x=20g(3)根据题意可以知道氢氧化钠和盐酸恰好完全反应,所以盐酸中溶质的质量为:73g×5%=3.65g;设氢氧化钠溶液中溶质的质量为xNaOH+HCl═NaCl+H2O40 36.5x 3.65g4036.5=x3.65g解得:x=4g氢氧化钠溶液中溶质的质量分数为:4g40g×100%=10%;答:氢氧化钠溶液中溶质的质量分数为10%.(1)595;(2)20;(3)10%.实验室中浓盐酸的商标如图所示.欲配制730g溶质质量分数为10%的稀盐酸,请根据有关信息计算,需这种浓盐酸多少g?体积为多少?盐酸化学纯试剂500mL约500g化学式HCl相对分子质量:36.46密度1.18g/mL质量分数为36.5%考点:一定溶质质量分数的溶液的配制;有关溶质质量分数的简单计算.专题:标签图示型;溶液的组成及溶质质量分数的计算.分析:可以根据溶质的质量分数来解答该题,需要特别注意的是溶液在加水稀释前后溶质的质量不变.解答:解:要将36.5%的浓盐酸稀释为10%的稀盐酸要向浓盐酸中加入水,解答本题的关键是在加水后溶质的质量不变,可以据此列出等式进行求算,求体积可根据物理所学的密度公式进行变形,即可完成解答;设需要浓盐酸的质量为x,其体积为y730g×10%=36.5%×x解得:x=200gy=200g÷1.18g/mL=169.5mL答:需这种浓盐酸200g,体积为169.5mL.故答案为:200g;169.5mL.在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品.要求该兴趣小组的同学测定样品中氧化铜的质量分数.同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应.有关实验数据如下表:实验次数 1 2 3 4加入稀硫酸的质量/g 5 5 5 5烧杯中剩余固体的质量/g 4.2 3.4 3.0 3.0计算:(1)样品中氧化铜的质量分数.(2)所用稀硫酸中溶质的质量分数.考点:有关溶质质量分数的简单计算;根据化学反应方程式的计算.专题:溶质质量分数与化学方程式相结合的计算;综合计算(图像型、表格型、情景型计算题).分析:(1)根据表中实验数据,第4次加入稀硫酸后,烧杯中剩余固体的质量不再改变,则剩余固体全部为不与硫酸反应铜的质量,则样品质量-铜的质量样品质量×100%即样品中氧化铜的质量分数;(2)计算所用稀硫酸中溶质的质量分数时需要使用硫酸完全反应时所得实验数据,由数据表,第1、2次加入的稀硫酸完全反应,因此可根据第1次反应所消耗的氧化铜的质量计算所加5g稀硫酸中硫酸的质量,而计算出所用稀硫酸中溶质的质量分数.解答:解:(1)样品中氧化铜的质量分数:5g-3g5g×100%=40%(2)设所用稀硫酸中溶质的质量x,H2SO4+CuO═CuSO4+H2O98 80x (5-4.2)g=0.8g800.8g=98x x=0.98g所用稀硫酸中溶质的质量分数:0.98g5g×100%=19.6%答:(1)样品中氧化铜的质量分数40%;(2)所用稀硫酸中溶质的质量分数19.6%甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如表:4位同学的实验甲乙丙丁加入氢氧化钠溶液质量(g)29.0 34.5 40.0 45.0反应得到沉淀的质量(g) 2.1 2.5 2.9 2.9反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题:(1)恰好完全反应的是丙同学的实验.(2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同).(3)计算丙同学实验后所得溶液中的氯化钠的质量分数.考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算;物质组成的综合计算;质量守恒定律及其应用.专题:溶液的组成及溶质质量分数的计算;有关化学方程式的计算.分析:(1)根据甲、乙、丙、丁四位同学所加氢氧化钠溶液依次递增的质量关系和生成沉淀的质量关系进行分析.(2)根据氢氧化钠的质量求出氯化镁的质量,再根据氯化镁的质量样品的质量×100%求出样品中氯化镁的质量分数.(3)所得溶液中氯化钠的质量分数=氯化钠的质量所得溶液的质量×100%,所得溶液中氯化钠的质量包括样品中氯化钠的质量(样品的质量-氯化镁的质量)和反应生成的氯化钠的质量(根据氢氧化钠的质量求出),所得溶液的质量=所加的所有物质的总质量-沉淀的质量.解答:解:(1)根据甲、乙、丙三位同学的实验数据分析可知,这三位同学所加的氢氧化钠已反应完,根据丙、丁两同学的实验数据分析可知,这两个实验中的氯化镁已反应完,则丙同学所做的实验中氯化镁和氢氧化钠恰好完全反应.故答案为:丙(2)设样品中所含氯化镁的质量为x,生成氯化钠的质量为y,生成氢氧化镁的质量为z.MgCl2+2NaOH═Mg(OH)2↓+2NaCl95 80 58 117x 40g×10% z y=4g95x=804g 804g=117y 804g=58zx=4.75g y=5.85g z=2.9g4.75g5g×100%=95%答:样品中氯化镁的质量分数为95%.(3)5g-4.75g+5.85g25g+40g-2.9g×100%=9.8%答:所得溶液中氯化钠的质量分数为9.8%.2008•邵阳)鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g 样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为30.2g.(有关反应的化学方程式为CaCO3高温¯CaO+CO2↑假设鸡蛋壳样品中杂质不参加反应)据此计算:(1)生成二氧化碳气体的质量;(2)此鸡蛋壳样品中碳酸钙的质量分数.考点:根据化学反应方程式的计算.专题:有关化学方程式的计算.分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.在本题中,分析题目信息和数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.解答:解:(1)生成CO2的质量:50g-30.2g=19.8g答:生成二氧化碳气体的质量为19.8g.(2)设50g样品中含CaC03的质量为xCaCO3高温¯CaO+CO2↑100 44x 19.8g100x=4419.8gx=45g45g50g×100%=90%答:鸡蛋壳样品中碳酸钙的质量分数90)碳酸钙是牙膏中一种常用的磨擦剂,可用石灰石作原料来制备.宜昌市某牙膏厂现有一批石灰石样品,小丽为探究所含碳酸钙的质量分数,称取500g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为302g.(有关反应的化学方程式为:CaCO3高温¯CaO+CO2↑,假设石灰石样品中杂质不参加反应.)据此我能计算:(1)生成二氧化碳的质量;(2)此石灰石样品中碳酸钙的质量分数a.实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:次数物质的质量 1 2 3 4加入氢氧化钠溶液的质量/g 25 25 25 25生成沉淀的质量/g 2.9 X 8.7 8.7(1)上表中X的数值为5.8;(2)计算20g固体混合物样品中氯化镁的质量;(3)计算上述实验中所用到的氢氧化钠溶液的溶质质量分数.b.在烧杯中加入氯化钠和碳酸氢钠的固体混合物10.0g后,再加入68.9g稀盐酸恰好完全反应.反应过程中用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始总质量为165.0g.反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑.试求:(1)完全反应时产生二氧化碳的质量是4.4克;(2)计算原混合物中氯化钠的质量;(3)计算稀盐酸的溶质质量分数.考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.专题:综合计算(图像型、表格型、情景型计算题).分析:a:分析表格可以发现,当生成8.7克沉淀时,氯化镁全部参加反应;从第一次可以看出,加入25克氢氧化钠生成2.9克沉淀,因此当加入50克氢氧化钠,生成5.8克沉淀.b:根据图象可以看出,反应开始时总质量是165克,反应结束时总质量是160.6克,质量的变化值等于二氧化碳气体的质量.解答:解:a:(1)从第一次可以看出,加入25克氢氧化钠生成2.9克沉淀,因此当加入50克氢氧化钠,生成5.8克沉淀.故答案为:5.8.(2)分析表格可以发现,当生成8.7克沉淀时,氯化镁全部参加反应,设氯化镁的质量是X.MgCl2+2NaOH═2NaCl+Mg(OH)2↓95 58X 8.7克9558═X8.7克得:X=14.25克(3)在第一次反应中,氢氧化钠完全反应,设参加反应的氢氧化钠的质量是Y.MgCl2+2NaOH═2NaCl+Mg(OH)2↓80 58Y 2.9克8058═Y2.9克得:Y=4克∴氢氧化钠溶液的溶质质量分数=4克25克×100%═16%.答:20g固体混合物样品中氯化镁的质量为14.25克;上述实验中所用到的氢氧化钠溶液的溶质质量分数为16%.b:(1)根据图象可以看出,反应开始时总质量是165克,反应结束时总质量是160.6克,质量的变化值等于二氧化碳气体的质量,所以二氧化碳的质量=165克-160.6克=4.4克,故答案为:4.4克.(2)生成4.4克二氧化碳,设需要碳酸氢钠的质量是M,需要盐酸(溶质)的质量是N.NaHCO3+HCl═NaCl+H2O+CO2↑84 36.5 44M N 4.4克8444═M4.4克得:M=8.4克36.544═N4.4克得:N=3.65克∴原混合物中氯化钠的质量=10克-8.4克=1.6克.(3)根据(2)计算得出盐酸的溶质的质量为3.65克,稀盐酸的溶质质量分数=3.65克68.9克×100%═5.3%.答:原混合物中氯化钠的质量为1.6克;稀盐酸的溶质质量分数为5.3%实验室中浓硫酸的商标如图所示,根据有关信息计算:(精确到0.1)(1)该试剂瓶中硫酸溶液的质量是920g.(2)欲配制100g溶质质量分数为19.6%的稀硫酸,需这种浓硫酸的体积是多少?(3)取足量所配制的稀硫酸与13g锌充分反应,可制得氢气的质量是多少?考点:一定溶质质量分数的溶液的配制.专题:溶液的组成及溶质质量分数的计算.分析:溶质质量分数的计算中一定注意液体体积和密度与质量之间的相互转化,在转化过程中一定注意单位的统一.解答:解:(1)由密度公式可知硫酸溶液的质量为500ml×1.84g/cm3=920g故答案为920(2)设需浓硫酸的体积为X100g×19.6%=1.84g/cm3×98%XX=10.9mL故答案为10.9ml(3)设可制得氢气的质量为yZn+H2SO4=ZnSO4+H2↑65 213g y65y=13g×2y=0.4g答:制的氢气的质量为0.4g生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入146.6g稀硫酸,恰好完全反应(杂质不参与反应).测得的实验数据如下:烧杯、反应前所加样品及稀硫酸质量之和反应后烧杯及其中物质质量之和质量172.6g 172.4g请你完成有关计算:(1)反应放出的氢气的质量是多少?(2)生铁样品中铁的质量分数是多少?(3)反应后所得溶液中溶质的质量分数是多少?考点:含杂质物质的化学反应的有关计算;有关溶质质量分数的简单计算;金属的化学性质.专题:有关溶液溶质质量分数的计算;综合计算(图像型、表格型、情景型计算题).分析:(1)根据质量守恒定律,反应前后所加样品及稀硫酸质量和的差值即反应放出氢气的质量;(2)根据反应的化学方程式,由放出氢气质量计算生铁样品中铁的质量,该质量与样品质量比可计算生铁样品中铁的质量分数;(3)反应后所得硫酸亚铁溶液的质量可由质量守恒定律求得,而硫酸亚铁的质量可通过化学方程式,由氢气质量求得,二者质量比可计算反应后所得溶液中溶质的质量分数.解答:解:(1)根据质量守恒定律,氢气的质量:172.6g-172.4g=0.2g(2)设生铁样品中铁的质量为xFe+H2SO4═FeSO4+H2↑56 2x 0.2g56x=20.2gx=5.6g5.6g6g×100%≈93.3%(3)设反应后生成硫酸亚铁的质量为yFe+H2SO4═FeSO4+H2↑152 2y 0.2g152y=20.2gy=15.2g15.2g5.6g+146.6g-0.2g×100%=10%答:(1)反应放出的氢气的质量是0.2g;(2)生铁样品中铁的质量分数是93.3%;(3)反应后所得溶液中溶质的质量分数是10%.点评:根据质量守恒定律,反应后溶液的质量=参加反应铁的质量+所加入稀硫酸的质量-反应放出氢气的质量.)实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:次数物质的质量 1 2 3 4加入氢氧化钠溶液的质量/g 25 25 25 25生成沉淀的质量/g 2.9 X 8.7 8.7(1)上表中X的数值为5.8;(2)计算原固体混合物样品中氯化镁的质量分数是多少?(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算. 专题:图表分析,寻找有效数据;溶液的组成及溶质质量分数的计算;有关化学方程式的计算;溶质质量 守恒. 分析: (1)每加入25g 氢氧化钠溶液完全反应可生成沉淀2.9g,因此,第2次加入的25g 氢氧化钠溶液完全 反应,又生成沉淀2.9g; (2)由氯化镁与过量的氢氧化钠完全反应后生成沉淀氢氧化镁8.7g,根据反应的化学方程式,计算出样品 中氯化镁的质量,然后与样品质量相比可得混合物样品中氯化镁的质量分数; (3)由氢氧化钠完全反应时生成沉淀的质量计算出所加氢氧化钠溶液的溶质质量分数;利用80g 溶质质量 分数为30%的氢氧化钠溶液,根据稀释前后溶质氢氧化钠的质量不变,计算出稀释时所加入水的质量. 解答:解: (1)每加入25g 氢氧化钠溶液完全反应可生成沉淀2.9g,因此,第2次加入25g 氢氧化钠溶液完 全反应后,所得沉淀的总质量=2.9g×2=5.8g 故答案为:5.8; (2)设混合物的样品中氯化镁的质量为 x MgCl2+2NaOH═Mg(OH)2↓+2NaCl 95 x 95x=588.7g 58 8.7g x=14.25g原固体混合物样品中氯化镁的质量分数=14.25g20g×100%=71.25% 答:原固体混合物样品中氯化镁的质量分数为71.25%; (3)设第1次反应中消耗氢氧化钠的质量为 y MgCl2+2NaOH═Mg(OH)2↓+2NaCl 80 y 80y=582.9g 58 2.9g y=4g则所加入的氢氧化钠溶液的溶质质量分数=4g25g×100%=16% 设需要加入水的质量为 m 80g×30%=(80g+m)×16% 解得 m=70g 答:需加入70克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液. 点评:在计算所加入的100g 氢氧化钠溶液的溶质质量分数时,不能直接使用100g 氢氧化钠溶液进行计算, 因为100g 溶液中的氢氧化钠并未全部参加反应;根据溶液的均一性,可根据前三次实验氢氧化钠完全反应 时的数据进行计算小苏打(主要成分为 NaHC03)中常含有少量氯化钠.小明同学为了测定某品牌小苏打中 NaHC03的质量分数, 查阅资料:NaHC03+HCl═NaCl+H20+C02↑,然后进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀 盐酸,至不再产生气泡为止,测得有关数据如下表所示.试计算: (计算结果保留一位小数) 物质 质量(g) (1)生成的二氧化碳的质量为 样品 9 消耗稀盐酸质量 75.4 反应后溶液质量 804.4g.(2)样品中的 NaHC03质量分数. 考点:根据化学反应方程式的计算. 专题:综合计算(图像型、表格型、情景型计算题) . 分析:根据小苏打(主要成分为 NaHCO3)中含有少量氯化钠且 NaHCO3能与稀盐酸反应而氯化钠不与稀盐酸 反应, 结合题意及表格中数据, 由质量守恒定律得出 CO2的质量, 然后根据化学方程式可求得碳酸钠的质量, 进一步可求得 NaHC03质量分数. 解答:解:根据质量守恒定律得 CO2的质量═9 g+75.4 g-80 g=4.4 g 设样品中的 NaHC03的质量为 x NaHCO3+HCl═NaCl+H2O+CO2↑ 84 x 8444=x4.4g x═8.4 g 样品中 NaHCO3的质量分数为:8.4g9g×100%═93.3% 答:样品中的 NaHC03质量分数为93.3% 点评:利用质量守恒定律分析反应前后质量变化,获得反应生成二氧化碳的质量,由此体现运用基础知识 对问题的分析能力.然后根据相关的化学方程式进行计算,求样品中的某物质质量分数 44 4.4 g2011•包头)为了测定某种石灰石中碳酸钙的质量分数,取5g 石灰石样品放入烧杯中,将60g 稀盐酸分成四 次加入烧杯中,充分反应后,测得实验数据如下表(样品中的杂质不与盐酸反应也不溶于水) 次 数 加入稀盐酸质量/g 烧杯内剩余物质量/g 请你分析并进行有关计算: (1)哪几次反应后,盐酸有剩余 第一次 15 19.34 第二次 15 33.68 第三次 15 48.24 第四次 15 63.24三、四. (2)石灰石样品中碳酸钙的质量分数. (3) 上述实验结束后, 向烧杯内的物质中加入石灰石至不再产生气泡, 过滤. 求滤液中溶质的质量分数. (结 果精确到0.1%) 考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算. 专题:综合计算(图像型、表格型、情景型计算题) . 分析: (1)根据质量守恒定律可知,第一次放出二氧化碳的质量=15克+5克-19.34克=0.66克,说明每加入 15克盐酸,放出二氧化碳的质量为0.66克.第二次加入15克盐酸后剩余物质的质量=30克+5克-0.66克 ×2═33.68克, 说明符合题目信息, 因此此时盐酸无剩余. 而第三次加入15g 盐酸, 生成二氧化碳只有0.44g 说明碳酸钙此时完全反应,盐酸有剩余,则第四次的盐酸一点也不反应.所以第三、四次盐酸剩余. (2)以前三次实验数据为标准先求出反应产生的二氧化碳的质量是1.76g,写出化学方程式并计算出碳酸 钙的质量,然后计算出样品中碳酸钙的质量分数. (3)四次加入盐酸的总质量为60克,然后析出化学方程式并计算出氯化钙的质量,最后计算出溶质的质量分数. 解答:解: (1)根据质量守恒定律可知,第一次放出二氧化碳的质量=15克+5克-19.34克=0.66克,说明每 加入15克盐酸,放出二氧化碳的质量为0.66克.第二次加入15克盐酸后剩余物质的质量=30克+5克-0.66克 ×2═33.68克, 说明符合题目信息, 因此此时盐酸物剩余. 而第三次加入15g 盐酸, 生成二氧化碳只有0.44g 说明碳酸钙此时完全反应,盐酸有剩余,则第四次的盐酸一点也不反应.所以第三、四次盐酸剩余.故答 案为:三、四. (2)根据(1)的分析可知,前二次30克盐酸和碳酸钙完全反应,二氧化碳的质量=30克+5克-33.68克=1.32 克,第三次15g 盐酸和碳酸钙反应,碳酸钙有剩余产生的二氧化碳的质量=0.44g.所以该反应中产生的二 氧化碳的总量是1.32g+0.44g=1.76g. 设碳酸钙的质量为 x. CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 x 10044═x1.76克 得:x=4克 ∴样品中碳酸钙的质量分数=4g5g×100%=80%. (3)由(1)分析可知,每加入15克盐酸放出二氧化碳的质量为0.66克,所以加入60克盐酸放出二氧化碳 的质量=0.66克×4═2.64克,设需要碳酸钙的质量为 Y,生成氯化钙的质量为 Z. CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 Y 111 Z 44 2.64g 44 1.76克10044═Y2.64克 得:Y=6克 11144═Z2.64克 得:Z=6.66克 ∴反应后溶液(滤液)的质量=60克+6克-2.64克=63.36克. ∴滤液中溶质的质量分数=6.66g63.36g×100%≈10.5% 答: (2)样品中碳酸钙的质量分数为80%; (3)滤液中溶质的质量分数为10.5%. 点评:掌握化学方程式的计算格式和规范性,学会分析表格并从中得到一些信息的方法.为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所 得相关的实验数据记录如下: 第一次 所取合金的质量/g 所用稀硫酸的质量/g 生成氢气的质量/g (1)写出有关反应的化学方程式; (2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 10 50 0.2 第二次 10 80 0.2 第三次 20 50 0.21:5时,表明合金中的锌与稀硫酸恰好完全反应. (提示:铜与稀硫酸不反应)。
计算题1.有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。
现将一定量的石灰石样品放入烧杯中,再将100g稀盐酸分4次加入烧杯中,每次均充分反应。
实验数据记录如下:求:(1)上述表格中M的值为__________ (2)该石灰石样品中碳酸钙的质量分数。
(3)生成二氧化碳的总质量。
2.镁条在空气中易被氧化。
有一根在空气中放置一段时间的镁条样品,其质量为2.8 g,将该样品放入107.8 g稀硫酸中,两者恰好完全反应,反应过程中测得数据如下:请计算(写出计算过程):(1)反应前后减少的质量是__________g,原因是______________________________。
(2)2.8 g样品中含氧化镁的质量是多少?(3)稀硫酸中溶质的质量分数是多少?3.工业上侯氏制碱法制得的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验。
在实验室中取27g纯碱样品,平均分成五份依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表:(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是g。
(2)第次加入纯碱样品后恰好与100g稀盐酸完全反应,此时共反应纯碱样品g。
(3)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0.1%)4有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合图所示的质量关系.(不计损耗)(1)样品完全反应后,共放出二氧化碳气体的物质的量为g。
(2)计算样品中氯化钠的质量分数。
(根据化学方程式列式计算)6.有一种石灰石样品,其中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2 g这种石灰石样品,把20 g稀盐酸分四次加入,充分反应后剩余固体的质量如下(1)2 g 石灰石样品中的杂质质量是g ;(2)石灰石样品的纯度为; (3)100 kg 这种纯度的石灰石充分煅烧后,可得到固体多少千克?7.老师要求同学们将30g NaCl 样品中的杂质2CuCl 除去,同时测出其中所含2CuCl 的质量分数。
2015初三化学实验数据计算题精选
1.现有某铜粉和镁粉的混合物样品。
为了测定样品中铜的百分含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表:
甲乙丙丁
学生
物质质量
所取固体样品的质量(g) 20 15 10 10
加入硫酸溶液的质量(g) 100 100 100 120
反应后剩余固体的质量(g)17.6 12.6 7.6 7.6
分析实验数据,回答下列问题:
(1 混合物中铜的质量分数是多少?
(2)反应后溶液的质量是多少?
(3)若将生成的溶液在t摄氏度时,配成饱和溶液,还需蒸发掉多少克水?(t摄氏度MgSO4的溶解度:S=20克/100克水)
2.学校研究性学习小组测定某铜锌合金中锌的质量分数,取一定量该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:(实验中的误差忽略不计)
第一次第二次第三次
所取合金的质量(g)20 20 20
所加稀硫酸的质量(g)100 200 250
反应后烧杯中剩余固体质量(g)13.5 8 m
根据以上数据分析
(1)该合金中锌的质量分数。
(2)该稀硫酸的质量百分比浓度。
(3)第三次实验中烧杯内剩余固体质量m=______克。
3.某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
实验次数
第一次第二次第三次
项目
所取合金的质量/g 20 20 40
所加稀硫酸的质量/g 100 120 100
生成氢气的质量/g 0.4 0.4 0.4
根据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_____g。
(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为____________(结果保留至0.1%)。
4.有一种石灰石样品,其中含有的杂质是二氧化硅(二氧化硅是一种不溶于水,不与盐酸反应,耐高温的固体)。
某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见表
稀盐酸的用量第一次加入5g 第二次加入5g 第三次加入5g 第四次加入5g
剩余固体的质量1.315 0.63 0.3 0.3
(1)石灰石样品的纯度是多少?
(2)20g稀盐酸的质量分数是多少?
(3)100kg这种纯度的石灰石充分煅烧后,可得到固体多少kg?
5.某学校对实验室中的大理石样品进行纯度测定,他们分成4个小组分别进行实验(假设杂质不参加反应)数据记录如下:
组别
1 2 3 4
实验
加入稀盐酸质量(g) 50 50 50 70
加入样品质量(g) 6 12 14 12
生成CO2质量(g) m 5.0 5.0 5.0
(1) 写出发生反应的化学方程式。
(2) 表中m的数值为_______克。
(3) 实验后大理石有剩余的小组为第_______小组。
(4) 计算该样品中碳酸钙的纯度。
(5) 计算盐酸溶液的质量分数。
6、甲、乙、丙三位同学分别取某石灰石样品与50g盐酸进行实验,所得结果如下:
实验甲乙丙
加入样品的质量/g 5 10 15
生成CO2的质量/g 1.76 3.52 4.4
求:⑴该石灰石样品中碳酸钙的质量分数。
⑵盐酸中溶质的质量分数。
7、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量第一次加入5 g 第二次加入5 g 第三次加入5 g 第四次加人5 g
剩余固体的质
3 g 2 g l g 1 g
量
(1)该石灰石样品中碳酸钙的质量分数是;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
8、(北京市)人工养殖海产品需要大量的海水,1kg海水中含钠离子的质量约为10.76g,镁离子的质量约为1.29g,还含有大量氯离子和硫酸根离子等。
请根据计算,从下表中选择两种盐,配制一种最简单、最便宜的“人工海水”,使该“人工海水”中的钠元素、镁元素的含量和海水基本相同。
物质Na2SO4 MgCl2 NaCl MgSO4
价格(元/500g)7 8 4 12
(1)选择的两种盐是。
(2)计算配制1t“人工海水”所需盐的成本(写出计算式即可)。
9..现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
取该混合物粉末8.0g 放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
实验次数 1 2 3 4 加入稀硫酸的质量/g
35.0 35.0 35.0 35.0 剩余固体的质量/g
6.8
5.6
4.4
4.2
通过计算回答下列问题:(要求写出计算过程)
(1)该混合物粉末中铜的质量分数是多少? (2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
10.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。
实验数据如下表:
甲 乙 丙 烧杯+稀硫酸 250g 200g 200g 加入的铁样品
9g 9g 14g 充分反应后,烧杯+剩余物
258.7g
208.7g
213.7g
请你认真分析数据,回答下列问题:(烧杯的质量为75.4g ;计算结果精确到1%) (1) 同学所取用的稀硫酸与铁样品恰好完全反应; (2)计算样品中铁的质量分数; (3)所用稀硫酸的溶质质量分数。
11.课外活动小组的同学在测定由NaCl 和Na 2CO 3形成的固体混合物组成时,进行了以下实验:取40 g 固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl 2溶液,实验数据见下表:
请分析表中数据回答并计算[(4)要求写计算过程 ] (1)生成的沉淀是(填写化学式) 。
(2)10g 原固体混合物配成的溶液和足量CaCl 2溶液反应,最多生成沉淀质量为 g 。
(3)m= g 。
实验一 实验二 实验三 实验四 原固体混合物质量 10g 10g 10g 10g 加入CaCl 2溶液质量 10g 20g 30g 40g 生成的沉淀的质量
2g
m
5g
5g
(4)原固体混合物中Na
2CO
3
的质量分数是多少?。