第9章 晶体结构
- 格式:pdf
- 大小:750.10 KB
- 文档页数:7







晶体结构的基本结构单元
晶体结构的基本结构单元主要有三种:原子、分子和离子。
这些基本结构单元在空间中按照一定的规律排列,形成了具有周期性的三维结构。
1.原子:原子是构成物质的基本粒子,它们按照一定的顺序排列在晶体中,形
成一种重复的模式。
原子的排列方式直接决定了晶体的物理和化学性质。
例如,金属原子按照一种被称为“金属键”的强力键合排列,这使得金属具有良好的导电性和导热性。
2.分子:分子是由两个或更多原子通过共价键结合在一起的。
在晶体中,分子
可以是链状、网状或者层状排列。
分子的排列方式会影响分子的化学性质和物理性质。
例如,在石墨中,碳原子以层状排列,每层之间的相互作用很弱,因此石墨可以轻易地在层之间滑动。
3.离子:离子是带有电荷的原子或分子。
在晶体中,离子通常通过离子键或者
共价键结合在一起。
离子的排列方式会影响晶体的离子导电性和耐压性。
例如,在食盐(NaCl)中,钠离子和氯离子通过离子键结合,这种键合方式使得食盐具有良好的导电性和耐压性。


晶体的结构及性质基础知识一.晶体和非晶体1.定义:内部粒子(原子、分子或离子)在空间按一定规律做周期性重复排列的固体物质称为晶体。
例如:高锰酸钾、金刚石、干冰、金属铜、石墨等。
绝大多数常见固体都是晶体。
非晶体:内部原子或分子的排列呈现杂乱无章的分布状态的固体称为非晶体。
例如:玻璃、沥青、石蜡等。
非晶体又称为无定形体。
2.晶体的重要特征(1)具有规则的几何外形(2)具有各向异性(3)有固定的熔点(4)X—射线衍射实验二.几类晶体的概念1.分子晶体:分子间以分子间作用力形成的晶体。
2.原子晶体:相邻原子间以共价键相结合形成的空间网结构的晶体叫原子晶体。
原子晶体又叫共价晶体。
3.离子晶体:由阴阳离子通过离子键结合而成的晶体叫做离子晶体。
4.金属晶体:金属原子通过金属键形成的晶体称为金属晶体。
金属晶体的成键粒子是金属阳离子和自由电子。
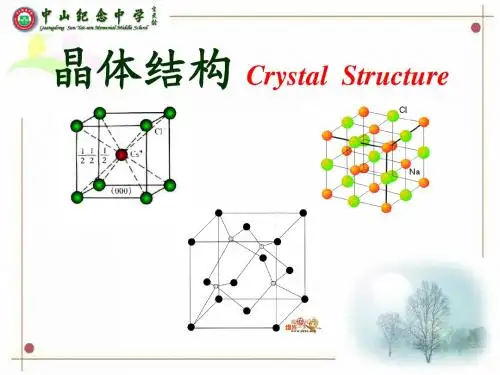
三.离子晶体、原子晶体、分子晶体和金属晶体比较晶体类型离子晶体原子晶体分子晶体组成晶体的粒子阳离子和阴离子原子分子组成晶体粒子间的相互作用离子键共价键范德华力(有的还有氢键)典型实例NaCl 金刚石、晶体硅、SiO2、SiC冰(H2O)、干冰(CO2)晶体的物理特性熔点、沸点熔点较高、沸点高熔、沸点高熔、沸点低导热性不良不良不良导电性固态不导电,熔化或溶于水能导电差差机械加工性能不良不良不良硬度略硬而脆高硬度硬度较小四.几种常见的晶体结构1.氯化钠晶体(离子晶体)在氯化钠晶体中:(1)与每个Na等距紧邻的Cl-有6个(2)与每个+Na等距紧邻的+Na有12个(3)每个氯化钠晶胞中含有4个NaCl。
(4)+Na周围与每个+Na等距紧邻的6个Cl-围成的空间构型为正八面体。
2.氯化铯晶体(离子晶体)在氯化铯晶体中:(1)与每个Cs+等距紧邻的Cl-有8个(2)与每个Cs+等距紧邻的Cs+有6个(3)每个氯化钠晶胞中含有1个CsCl。
3.干冰(分子晶体)在干冰的晶体中:(1)与每个CO2分子等距紧邻的CO2分子有12个。

晶体结构3-1-1 晶体的宏观特征通常人们说的“固体”可分为晶态和非晶态两大类。
晶态物质, 即晶体,是真正意义的固体。
在宏观上,晶体有别于橡胶、玻璃、琥珀、树脂等非晶态的最普遍的本质特征是它的“自范性”,即:晶体能够自发地呈现封闭的规则凸多面体的外形。
非晶态物质则没有自范性1。
单一的晶体多面体叫做单晶。
有时两个体积大致相当的单晶按一定规则生长在一起,叫做双晶;许多单晶以不同取向连在一起,叫做晶簇。
有的晶态物质(例如用于雕塑的大块“汉白玉”),看不到规则外形,是多晶,是许多肉眼看不到的微小晶体的集合体。
有的多晶压成粉末,放到光学显微镜或电子显微镜下观察,仍可看到整齐规则的晶体外形(图3-1)。
a.水晶单晶b。
石膏双晶和晶簇c。
水晶晶簇d。
蛋白质显微照片图3-1 晶体自发呈现规则凸多面体外形举例2配制明矾饱和溶液,在容器中央挂一条线,浸入溶液的线端悬一小块明矾晶体(晶种),尽量保持恒温令溶液慢慢挥发,数天后,你会发现线端的晶种长大了,呈现八面体外形。
你再把得到的明矾晶体放进饱和铬钾矾溶液,不久,会发现呈八面体外形的铬钾矾晶体在明矾晶体上生长。
这个实验不仅说明晶体会自发呈现规则凸多面体外形,还告诉我们,明矾和铬钾矾是类质同晶的——KAl(SO4)2·12H2O和KCr(SO4)2·12H2O组成和结构类同, 有相同的外形。
早在1669年,丹麦科学家斯丹诺(N. Steno)就发现,晶体,例如水晶(SiO2),在自然条件下形成的单晶的形状丰富多样, 然而,借助几何学知识,却可找到相同的晶面(如图3-2中用R、r、m…标记的晶面),而且,确定的晶面之间的二面角——“晶面夹角”是不变的。
这叫做晶面夹角不变定律。
图3-2 自然生长的水晶晶体1固体物质除晶体和称为玻璃态的非晶态外,还有液晶、类晶等介乎晶态与非晶态之间的状态。
液晶和类晶也有某种整齐排列的特性,但在宏观外形和微观结构上却与理想晶体不完全相同。
第一章金属及合金的晶体结构一、名词解释:1.晶体:原子(分子、离子或原子集团)在三维空间做有规则的周期性重复排列的物质。
2.非晶体:指原子呈不规则排列的固态物质。
3.晶格:一个能反映原子排列规律的空间格架。
4.晶胞:构成晶格的最基本单元。
5.单晶体:只有一个晶粒组成的晶体。
6.多晶体:由许多取向不同,形状和大小甚至成分不同的单晶体(晶粒)通过晶界结合在一起的聚合体。
7.晶界:晶粒和晶粒之间的界面。
8.合金:是以一种金属为基础,加入其他金属或非金属,经过熔合而获得的具有金属特性的材料。
9.组元:组成合金最基本的、独立的物质称为组元。
10.相:金属中具有同一化学成分、同一晶格形式并以界面分开的各个均匀组成部分称为相。
11.组织:用肉眼观察到或借助于放大镜、显微镜观察到的相的形态及分布的图象统称为组织。
12.固溶体:合金组元通过溶解形成成分和性能均匀的、结构上与组元之一相同的固相。
二、填空题:1.晶体与非晶体的根本区别在于原子(分子、离子或原子集团)是否在三维空间做有规则的周期性重复排列。
2.常见金属的晶体结构有体心立方晶格、面心立方晶格、密排六方晶格三种。
3.实际金属的晶体缺陷有点缺陷、线缺陷、面缺陷、体缺陷。
4.根据溶质原子在溶剂晶格中占据的位置不同,固溶体可分为置换固溶体和间隙固溶体两种。
5.置换固溶体按照溶解度不同,又分为无限固溶体和有限固溶体。
6.合金相的种类繁多,根据相的晶体结构特点可将其分为固溶体和金属化合物两种。
7.同非金属相比,金属的主要特征是良好的导电性、导热性,良好的塑性,不透明,有光泽,正的电阻温度系数。
8.金属晶体中最主要的面缺陷是晶界和亚晶界。
9.位错两种基本类型是刃型位错和螺型位错,多余半原子面是刃型位错所特有的。
10.在立方晶系中,{120}晶面族包括(120)、(120)、(102)、(102)、(210)、(210)、(201)、(201)、(012)、(012)、(021)、(021)、等晶面。
一、考试重点晶体结构、晶体结合、晶格振动、能带论的基本概念与基本理论与知识二、复习内容第一章晶体结构基本概念1、晶体分类及其特点:单晶粒子在整个固体中周期性排列非晶粒子在几个原子范围排列有序(短程有序)多晶粒子在微米尺度内有序排列形成晶粒,晶粒随机堆积准晶体粒子有序排列介于晶体与非晶体之间2、晶体的共性:解理性沿某些晶面方位容易劈裂的性质各向异性晶体的性质与方向有关旋转对称性平移对称性3、晶体平移对称性描述:基元构成实际晶体的一个最小重复结构单元格点用几何点代表基元,该几何点称为格点晶格、平移矢量基矢确定后,一个点阵可以用一个矢量表示,称为晶格平移矢量基矢元胞以一个格点为顶点,以某一方向上相邻格点的距离为该方向的周期,以三个不同方向的周期为边长,构成的最小体积平行六面体。
原胞就是晶体结构的最小体积重复单元,可以平行、无交叠、无空隙地堆积构成整个晶体。
每个原胞含1个格点,原胞选择不就是唯一的晶胞以一格点为原点,以晶体三个不共面对称轴(晶轴) 为坐标轴,坐标轴上原点到相邻格点距离为边长,构成的平行六面体称为晶胞。
晶格常数WS元胞以一格点为中心,作该点与最邻近格点连线的中垂面,中垂面围成的多面体称为WS原胞。
WS原胞含一个格点复式格子不同原子构成的若干相同结构的简单晶格相互套构形成的晶格简单格子点阵格点的集合称为点阵布拉菲格子全同原子构成的晶体结构称为布拉菲晶格子。
4、常见晶体结构:简单立方、体心立方、面心立方、金刚石闪锌矿铅锌矿氯化铯氯化钠钙钛矿结构5、密排面将原子瞧成同种等大刚球,在同一平面上,一个球最多与六个球相切,形成密排面密堆积密排面按最紧密方式叠起来形成的三维结构称为密堆积。
六脚密堆积密排面按AB\AB\AB…堆积立方密堆积密排面按ABC\ABC\ABC…排列5、晶体对称性及分类:对称性的定义晶体绕某轴旋转或对某点反演后能自身重合的性质对称面对称中心旋转反演轴8种基本点对称操作14种布拉菲晶胞32种宏观对称性7个晶系6、描述晶体性质的参数:配位数晶体中一个原子周围最邻近原子个数称为配位数。
第9章 晶体结构和性质习题解答【9.1】若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用虚线画出点阵结构如下图,各结构基元中圈和黑点数如下表:1234567○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○●●●●●●●●●●●●●●●●●●●●图序号 1 2 3 4 5 6 7 结构基元数 1 1 1 1 1 1 1 黑点数 1 1 1 1 0 2 4 圈数1112313【评注】 从实际周期性结构中抽取出点阵的关键是理解点阵的含义,即抽取的点按连接其中任意两点的向量平移后必须能够复原。
如果不考虑格子单位的对称性,任何点阵均可划出素单位来,且素单位的形状并不是唯一的,但面积是确定不变的。
如果考虑到格子单位的对称形,必须选取正当单位,即在对称性尽量高的前提下,选取含点阵点数目尽量少的单位,也即保持格子形状不变的条件下,格子中点阵点数目要尽量少。
例如,对2号图像,如果原图是正方形,对应的正当格子单位应该与原图等价(并非现在的矩形素格子),此时结构基元包含两个黑点与两个圆圈。
【9.2】有一AB 型晶体,晶胞中A 和B 的坐标参数分别为(0,0,0)和(12,12,12)。
指明该晶体的空间点阵型式和结构基元。
解:晶胞中只有一个A 和一个B ,因此不论该晶体属于哪一个晶系,只能是简单点阵,结构基元为一个AB 。
【9.3】已知金刚石立方晶胞的晶胞参数a =356.7pm 。
请写出其中碳原子的分数坐标,并计算C —C 键的键长和晶胞密度。
解:金刚石立方晶胞中包含8个碳原子,其分数坐标为:(0,0,0),1(2,12,0),(12,0,1)2,(0,12,1)2,(14,14,1)4,3(4,34,1)4,(34,14,3)4,(14,34,3)4(0,0,0)与(14,14,14)两个原子间的距离即为C -C 键长,由两点间距离公式求得:C-C 356.7154.4pm r ====密度-13-10323-1812.0g mol 3.51 g cm (356.710cm)(6.022 10mol )A ZM D N V -⨯⋅==⋅⨯⨯⨯ 【9.4】立方晶系金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400。