第三章 化学动力学基础
- 格式:doc
- 大小:387.50 KB
- 文档页数:8

化学动力学基础知识点总结
化学动力学是化学的一个分支,主要研究化学反应的速率和机理。
以下是一些化学动力学的基础知识点总结:
1. 反应速率:化学反应速率是指单位时间内反应物或生成物浓度
的变化量,可以用单位时间内反应物或生成物的摩尔数来表示。
2. 反应级数:反应级数是指化学反应速率与反应物浓度的幂次方
之间的关系。
一级反应的速率与反应物浓度的一次方成正比,二级反
应的速率与反应物浓度的二次方成正比,以此类推。
3. 活化能:活化能是指反应物分子从常态转变为能够发生化学反
应的活化态所需的能量。
活化能越高,反应速率越慢。
4. 催化剂:催化剂是一种能够加速化学反应速率而自身在反应过
程中不被消耗的物质。
催化剂通过降低反应的活化能来加速反应速率。
5. 反应机理:反应机理是指化学反应的具体步骤和过程,包括反
应物分子如何相互作用形成过渡态以及过渡态如何转化为生成物。
6. 碰撞理论:碰撞理论认为化学反应是反应物分子之间的碰撞导致的。
只有那些具有足够能量的分子在适当的取向下发生碰撞时,才能发生化学反应。
7. 阿伦尼乌斯方程:阿伦尼乌斯方程是描述反应速率与温度之间关系的经验公式。
它表明反应速率常数与温度成指数关系,活化能越高,温度对反应速率的影响越大。
8. 稳态近似:稳态近似是一种处理快速平衡反应的方法,假设反应中间物的浓度在反应过程中保持恒定。
这些是化学动力学的一些基础知识点,化学动力学在化学研究和实际应用中都有广泛的应用,例如在化学工程、药物研发、环境保护等领域。


无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--⋅⋅K molJ3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、 状态是系统中所有宏观性质的综合表现。
描述系统状态的物理量称为状态函数。
状态函数的变化量只与始终态有关,与系统状态的变化途径无关。
3、 系统中物理性质和化学性质完全相同而与其他部分有明确界面分隔开来的任何均匀部分叫做相。
相可以由纯物质或均匀混合物组成,可以是气、液、固等不同的聚集状态。
4、 化学计量数()ν对于反应物为负,对于生成物为正。
5、反应进度νξ0)·(n n sai k et -==化学计量数反应前反应后-,单位:mol第二节:热力学第一定律0、 系统与环境之间由于温度差而引起的能量传递称为热。
热能自动的由高温物体传向低温物体。
系统的热能变化量用Q 表示。
若环境向系统传递能量,系统吸热,则Q>0;若系统向环境放热,则Q<0。

无机化学,有机化学,物理化学,分析化学无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。
有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。
物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。
分析化学化学分析、仪器和新技术分析。
包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:为气体摩尔常数,数值为=8.3143、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP下压强为101.325KPa=760mmHg=76cmHg)第二章:热化学第一节:热力学术语和基本概念1、系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为:⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、状态是系统中所有宏观性质的综合表现。

第一篇:化学反应原理第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--⋅⋅K mol J3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为: ⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、 状态是系统中所有宏观性质的综合表现。
描述系统状态的物理量称为状态函数。
状态函数的变化量只与始终态有关,与系统状态的变化途径无关。
3、 系统中物理性质和化学性质完全相同而与其他部分有明确界面分隔开来的任何均匀部分叫做相。
相可以由纯物质或均匀混合物组成,可以是气、液、固等不同的聚集状态。
4、 化学计量数()ν对于反应物为负,对于生成物为正。
5、反应进度νξ0)·(n n sai k e t -==化学计量数反应前反应后-,单位:mol 第二节:热力学第一定律0、 系统与环境之间由于温度差而引起的能量传递称为热。
热能自动的由高温物体传向低温物体。
系统的热能变化量用Q 表示。
若环境向系统传递能量,系统吸热,则Q>0;若系统向环境放热,则Q<0。


无机化学试题第一章气体填空题:1、某广场上空有一气球,假定气压在一日内基本不变,早晨气温15℃时,气球体积为25.0L;中午气温为30℃,则其体积为 26.3 L;若下午的气温为25℃,气球体积为 25.9 L。
2、某真空集气瓶的质量为134.567g。
将一温度为31℃,压力为98.0 kPa的气体充入其中,然后再称其质量为137.456g,则该气体的质量m= 2.889g。
如果集气瓶中装满31℃的水,其总质量为1067.9g(该温度下水的密度为0.997g·mL-1),集气瓶的容积为0.936 L;该气体的密度ρ= 3.09 g.·L-1,摩尔质量M=79.6g·moI-1。
3、恒定温度下,将1.0L 204kPa的氮气与2.0L 303kPa的氧气充入容积为3.0L的真空容器中,则p(N2)= 68 kPa; p(O2)= 202 kPa; 容器内的总压力p=270 kPa。
4、在温度T时,在容积为c L的真空容器中充入氮气和氩气。
容器内压力为a kPa,若p(N2)=b kPa, 则p(Ar)= a-b kPa; N2和Ar的分体积分别为 bc/aL和 (a-b)c/a L; n(N2)= bc/RT mol,n(Ar)= (a-b)c/RT mol。
5、在相同温度、压力、体积下,两种气体的摩尔质量分别为M1和M2(M1>M2)。
试比较:n1 = n2, m1> m2; Ēk,1= Ēk,2; v1< v2; ρ1>ρ2。
若体积增大,温度、压力保持不变,则ρ1, ρ2都不变。
选择题:1、一定温度下,某容器中含有相同质量的H2,O2,N2与He的混合气体,其中分压最小的组分是………………………………………………………………( B )(A)N2 (B)O2(C)H2(D)He2、某温度下,一容器中含有2.0mol O2,3.0mol N2及1.0mol Ar。
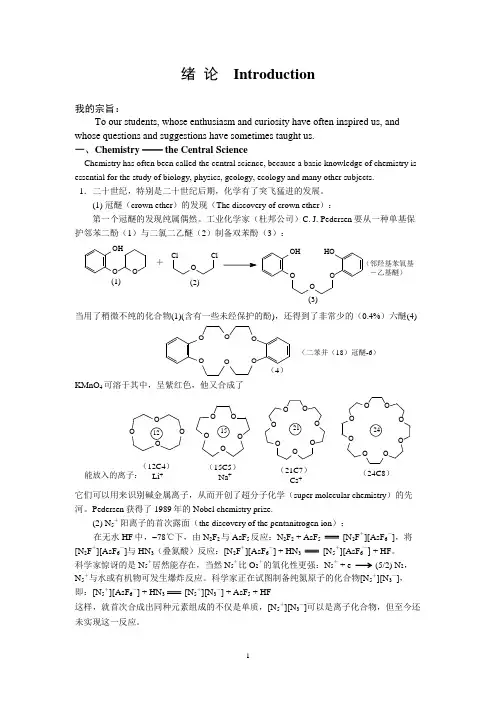
绪 论 Introduction我的宗旨:To our students, whose enthusiasm and curiosity have often inspired us, and whose questions and suggestions have sometimes taught us.一、Chemistry ── the Central ScienceChemistry has often been called the central science, because a basic knowledge of chemistry is essential for the study of biology, physics, geology, ecology and many other subjects.1.二十世纪,特别是二十世纪后期,化学有了突飞猛进的发展。
(1) 冠醚(crown ether )的发现(The discovery of crown ether ):第一个冠醚的发现纯属偶然。
工业化学家(杜邦公司)C. J. Pedersen 要从一种单基保 护邻苯二酚(1)与二氯二乙醚(2)制备双苯酚(3): OHO O Cl O Cl OHHO O O O +(1)(2)(3)(邻羟基苯氧基 -乙基醚)当用了稍微不纯的化合物(1)(含有一些未经保护的酚),还得到了非常少的(0.4%)六醚(4)O OO O OO(4)KMnO 4可溶于其中,呈紫红色,他又合成了(12C4)Li +O O O O O (15C5)Na +OO O OO O OO O O O O O OO (21C7)Cs +(24C8)能放入的离子:它们可以用来识别碱金属离子,从而开创了超分子化学(super molecular chemistry )的先河。
Pedersen 获得了1989年的Nobel chemistry prize.(2) N 5+阳离子的首次露面(the discovery of the pentanitrogen ion ): 在无水HF 中, 78℃下,由N 2F 2与AsF 5反应:N 2F 2 + AsF 5 [N 2F +][AsF 6-],将[N 2F +][AsF 6-]与HN 3(叠氮酸)反应:[N 2F +][AsF 6-] + HN 3 [N 5+][AsF 6-] + HF 。

大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。

化学反应动力学的基础化学反应动力学是一门研究化学反应速率及其机制的科学,它不仅为我们理解反应过程提供了理论基础,同时在工业、环境科学及生物医学等多个领域都具有广泛的应用。
这篇文章将介绍化学反应动力学的基础概念、基本定律、影响因素、反应机理以及相关的实验方法,以帮助读者深入了解这一重要的科学领域。
一、化学反应速率化学反应速率是指单位时间内反应物转化为产物的量,通常用摩尔数/升/秒(mol/L·s)来表示。
为了量化化学反应速率,科学家们引入了以下几个重要概念:平均反应速率:在一个特定时间段内,反应物浓度减少或产物浓度增加的变化率。
例如,对于反应A→B,平均反应速率可以表达为:[ = - = ]瞬时反应速率:在某一时刻,反应物浓度或产物浓度变化的速率。
在数学上,它是反应速率的导数,可以用以下形式表示:[ = - = ]反应级数:反应级数是描述反应速率与各个反应物浓度之间关系的整数,比如对于双分子反应 ( A + B C ),其速率方程通常表示为:[ v = k[A]m[B]n ]其中,(k) 是速率常数,(m) 和 (n) 是分别对应于A和B的反应级数。
二、影响因素多种因素可以影响化学反应的速率,包括温度、压力、催化剂以及反应物浓度等:温度温度对化学反应速率有着显著的影响。
根据阿伦尼乌斯方程,随着温度的升高,分子运动加剧,使得反击能量提升,从而加快了反应速率。
阿伦尼乌斯方程如下所示:[ k = Ae^{-} ]其中,A 为频率因子,(E_a) 是活化能,(R) 是气体常数,(T) 是绝对温度。
反应物浓度增加反应物浓度通常会使得分子碰撞频率增加,从而提高了化学反应速率。
在许多简单的单分子和双分子反应中,这一点尤其明显。
催化剂催化剂是加快化学反应而且自身不被消费的物质。
催化剂通过降低活化能来加快反应速率。
例如,在酶促反应中,酶作为催化剂能够选择性地加快某些生物分子的转变。
压力对于气体相互作用的反应而言,增加压力会导致气体分子之间更频繁地碰撞,从而提升反应速率。

第一篇:化学反应原理第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =8.31411--⋅⋅K molJ 3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP 下压强为101.325KPa = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为:⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、 状态是系统中所有宏观性质的综合表现。
描述系统状态的物理量称为状态函数。
状态函数的变化量只与始终态有关,与系统状态的变化途径无关。
3、 系统中物理性质和化学性质完全相同而与其他部分有明确界面分隔开来的任何均匀部分叫做相。
相可以由纯物质或均匀混合物组成,可以是气、液、固等不同的聚集状态。
4、 化学计量数()ν对于反应物为负,对于生成物为正。
5、反应进度νξ0)·(n n sai ket -==化学计量数反应前反应后-,单位:mol第二节:热力学第一定律0、 系统与环境之间由于温度差而引起的能量传递称为热。
热能自动的由高温物体传向低温物体。
系统的热能变化量用Q 表示。
若环境向系统传递能量,系统吸热,则Q>0;若系统向环境放热,则Q<0。
化学动力学基础三试卷班级姓名分数一、选择题( 共16题32分)1. 2 分(5256)5256二级反应的速率常数的单位是:( )(A) s-1(B) dm6·mol-2·s-1(C) s-1·mol-1(D) dm3·s-1·mol-12. 2 分(5296)5296某具有简单级数的反应,k = dm3·mol-1·s-1,起始浓度为mol·dm-3,当反应速率降至起始速率1/4 时,所需时间为:( )(A) s(B) 333 s(C) 30 s(D) 100 s3. 2 分(5290)5290某反应在指定温度下,速率常数k为×10-2 min-1,反应物初始浓度为mol·dm-3 ,该反应的半衰期应是:( )(A) 150 min(B) 15 min(C) 30 min(D) 条件不够,不能求算4. 2 分(5561)5561平行反应AB (1);AD (2),其反应(1)和(2)的指前因子相同而活化能不同,E1为120 kJ·mol-1,E2为80 kJ·mol-1,则当在1000 K 进行时,两个反应速率常数的比是:( )(A) k1/k2= ×10-3 (B) k1/k2= ×102(C) k1/k2= ×10-5 (D) k1/k2= ×1045. 2 分(5555)均相反应 A + BC + D , A + BE + F 在反应过程中具有([C]/([E] = k1/k2的关系,([C],([E] 为反应前后的浓差,k1,k2是反应(1),(2)的速率常数。
下述哪个是其充要条件( )(A) (1),(2) 都符合质量作用定律(B) 反应前C,E 浓度为零(C) (1),(2) 的反应物同是A,B(D) (1),(2) 反应总级数相等6. 2 分(5776)5776反应 A + BC →AB + C 的焓变(rHm> 0,A ,C 是自由基,( AB ,( BC是分子AB,BC 的摩尔键焓。
第三章 化学动力学基础 1. 有A气体和B气体进行反应,若将A气体浓度增加一倍,速率增加400%,若将B气体的浓度增加一倍,速率增加200%,试写出反应式。
2. 下列生成NO2的反应:2NO+O22NO2 其反应速率表示式为 ][O[NO]22kv
如果压力增加到原来的两倍,试计算速率之变化。
3. 在抽空的刚性容器中,引入一定量纯A气体,发生如下反应: A(g)B(g) + 2C(g)。设反应能进行完全,经恒温到323K时,开始计时,测定 体系总压随时间的变化关系如下: t / min 0 30 50 ∞ p总 / kPa 53.33 73.33 80.00 106.66
求该反应级数及速率常数
4. 若气体混合物体积缩小到原来的1/3,下列反应的初速率变化为多少? 2SO2 + O2 2SO3
5. 在308K时,反应 N2O5(g) 2NO2(g) + 1/2O2(g) 的k = 1.3510-5, 在318K时,k = 4.9810-5,试求这个反应的活化能?
6. CH3CHO的热分解反应是:CH3CHO(g) CH4(g) + CO(g) 在700K时,k=0.0105,已知Ea=188.1kJmol-1,试求800K时的k。 7. 已知HCl(g)在1atm和25℃时的生成热为-88.2kJmol-1,反应 H2(g) + Cl2(g) = 2HCl(g) 的活化能为112.9kJmol-1。试计算逆反应的活化能。
8. 某一个化学反应,当温度由300K升高到310K时,反应速率增加了一倍,试求这个反应的活化能。
9. 某化学反应,在300K时,20min内反应完成了50%,在350K时,5min内反应完成了50%,计算这个反应的活化能。
10. 已知在320℃时反应SO2Cl2(g)SO2(g)+Cl2(g)是一级反应,速率常数为2.210-5s-1。试求:(1)10.0gSO2 Cl2分解一半需多少时间? (2)2.00gSO2Cl2经2h之后还剩多少克?
11. 在人体内,被酵母催化的某生化反应的活化能为39kJmol-1。当人发烧到313K时,此反应的速率常数增大到多少倍?
12. 蔗糖催化水解C12H22O11+H2O催化剂2C6H12O6是一级反应,在25℃速率常数为5.710-5s-1。试求: (1)浓度为1moldm-3蔗糖溶液分解10%需要多少时间? (2)若反应活化能为110kJ.mol-1,那么在什么温度时反应速率是25℃时的十分之一?
13. 反应2NO+2H2N2+2H2O在一定温度下,某密闭容器中等摩尔的比NO与H2混合物在不同初压下的半衰期为 p0(mmHg) 355 340.5 288 251 230 202 t1/2(min) 95 101 130 160 183 224 求反应级数。 14. 环戊二烯(沸点40℃)易在气相中形成双聚:2C5H6(g)→C10H12(g) 现将0.50cm3环戊二烯( =0.802g.cm-3)放入容器为1.000dm3的抽空密闭容器中,加热到130℃,经过一段时间,测定总压的结果如下: t(min) 10 20 30 40 50 60 p总(kPa) 18.07 16.62 15.63 14.87 14.33 13.88 (1) 计算温度升到130℃时尚未聚合的起始压力。
(2) 计算60min时环戊二烯的分压。 (3) 此反应的反应级数和反应速率常数。
15. 把一定量的PH3(g)引入含有惰性气体的温度为873K的反应器中,PH3(g)可完全分解为P4(g)和H2(g),测得总压随时间的变化如下: t / s 0 60 120 ∞ p / kPa 262.40 272.90 275.53 276.40 求反应级数及速率常数
16. 气相反应Cl2O + 2N2O5 NO3Cl + NO2Cl + 2NO2 + O2的可能历程是: N2O5NO2 + NO3 (快平衡) NO2 + NO3k2NO + O2 + NO2 (慢) NO + Cl2Ok3NO2Cl + Cl (快) Cl + NO3k4NO3Cl (快) 而N2O5分解历程如下: N2O5NO2 + NO3 (快平衡) NO2 + NO3k2NO + O2 + NO2 (慢) NO + NO3k32NO2 (快) 试求这两个反应的速度方程式,你能从这两个结果得出什么结论?
k1 k-1
k1 k2 17. 2NO(g) + O2 2NO2(g)存在三种可能的机理,试写出每一种机理的分步反应,若反应速率v=kcNO2cO2,问上述反应按哪种机理进行?
18. N2O(g)的热分解反应为2N2O(g)k2N2(g) + O2(g),从实验测出不同温度时各个起
始压力与半衰期如下: 反应温度T / K 967 967 1030 1030
初始压力 p0 / kPa 156.787 39.197 7.066 47.996
半衰期 t1/2 / s 380 1520 1440 212
(1) 求反应级数和两种温度下的速率常数 (2) 求活化能Ea (3) 若1030K时,N2O(g)的初始压力为54.00kPa,求压力达64.00kPa时所需的时间。
19. 反应Co(NH3)5F2+ + H2OH+Co(NH3)5(H2O)3+ + F-被酸催化。若反应速率公式为 rate = k[Co(NH3)5F2+]α [H+]β,在一定温度及初始浓度条件下,测得分数衰期如下: 298 298 308 [Co(NH3)5F2+] (mol · dm3) 0.1 0.2 0.1 [H+] (mol · dm3) 0.01 0.02 0.01 t1/2×102 / s 36 18 18 t1/4×102 / s 72 36 36 请计算 (1) 反应级数α和β的值 (2) 不同温度下的反应速率常数k (3) 反应实验活化能Ea值
20. N2O5分解反应的历程如下: ① N2O5NO2 + NO3
② NO2 + NO32kNO + O2 + NO2 ③ NO + NO33k2NO2
(1) 当用O2的生成速率表示反应速率时,试用稳态近似法证明:212112kkkkr[N2O5] (2) 设反应②为决速步骤,反应①为快速平衡,用平衡态近似法写出反应的速率表达式r2。 (3) 在什么情况下,r1 = r2?
k-1 k1 21. 已知反应2NO + O22NO2,其r = k[NO]2[O2],试写出一种符合该速率方程的反应历程。
22. 在生命系统中,酶在很多化学反应中扮演重要角色。一些酶的催化反应可以用如下
的Michaelis-Menten机理描述:
E + SES2kE + P,E为酶,S为受体,P为最终产物 忽略第二步的逆向速率,也可以假设酶和受体是很快达到平衡的。 (1) 在285K温度下进行实验,实验中, 初始的速率(P的生成)可由不同的受体浓度来决定,维持酶的总浓度为1.5×10– 9 M (mol·dm3) 可得到下图 ① 当[S]很小时,曲线呈线性;当[S]很大时,曲线与横坐标平行,则速率接近常数,请证明该图与Michaelis-Menten机理是一致的 ② 试写出速率常数k2 ③ 当[S]= 1.0×10– 4 M时,初始速率为多少? ④ 试求E + SES的平衡常数 (2) 在310K,重复相同的酶浓度,得到一相似的曲线,试计算ES转换成E和P时所需要的活化能。
初始速率
[ S ]
3.0×10-6 M ·S-1T = 285K1.5×10-6 M ·S-1
5.0×10-5 M
初始速率
T = 310K
8.0×10-5 M[ S ]
6.0×10-6 M ·S-13.0×10-6 M ·S-1
23. 14C放射性蜕变的半衰期t1/2 = 5730年,今在一考古样品中,测得14C占C的含量只有72%,问该样品已存在多少年了?
24. 在1100K时,研究NO(g) + H2(g)的反应动力学 (1) 当p0 (NO) = )H(02p时,测得如下数据:
t1/2 / s 81 224 p0 / Pa 335 202 试求该反应的总反应级数
k-1 k1 (2) 在不同初始压力下,测定初始反应速率,结果如下: )H(02
p/ kPa
p0 (NO) / kPa (d P / dt) t0 (kPa · s1)
① 53.3 ② 53.3 ③ 38.5 ④ 19.6
40.0 20.3 53.3 53.3 0.137 0.033 0.213 0.105 如该反应的速率方程为,d P / dt = 2(NO)(H)xyk pp试求x、y
25. 氯甲酸·三氯甲酯高温分解反应: ClCOOCCl3(g) 2COCl2(g) 是单向一级反应。将一定量的ClCOOCCl3迅速放入恒温、恒容反应器中,测量时刻t的总压力p及完全反应后的总压力p。两个温度下的实验数据如下: Exp. T / K t / s p / kPa p / kPa (1) 553 454 2.476 4.008 (2) 578 320 2.838 3.554 计算反应的活化能
26. 溶液反应A + BP,当[A]0 = 1.00×104 mol · dm3,[B]0 = 1.00×102 mol · dm3, 测得不同反应温度时的吸光度随时间变化数据如下: T / K t / min 0 27 130 298 D1 1.390 1.030 0.706 0.100 308 D2 1.460 0.542 0.210 0.110 当[A]0 = 1.00×104 mol · dm3,改变[B]0,在298K时测得t1/2数据如下: [B]0 / mol · dm3 1.00×102 2.00×102 t1/2 / min 120 30 若速率方程为r = k [A]α[B]β,试求α、β、k和Ea
27. 已知每克陨石中含238U 6.3×108g,4He为20.77×106cm3(标准状态下)。238U的衰 变反应为:238U206Pb + 8 4He,由实验测得的半衰期t1/2 = 4.51×109年,试求该陨 石的年龄。
28. 有反应N2O5 + NO3NO2,今在298K下进行实验,第一次实验:p1 = 133Pa,