第三章-化学动力学
- 格式:doc
- 大小:727.50 KB
- 文档页数:15

第三章化学动力学(总15页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第三章 化学动力学3-1.在1 100 K 时,3NH (g)在金属钨丝上发生分解。
实验测定,在不同的3NH (g)的初始压力0p 下所对应的半衰期12t ,获得下列数据 0/Pa p ×104 ×104 ×104 12/min t 试用计算的方法,计算该反应的级数和速率系数。
解: 根据实验数据,反应物3NH (g)的初始压力不断下降,相应的半衰期也不断下降,说明半衰期与反应物的起始浓度(或压力)成正比,这是零级反应的特征,所以基本可以确定是零级反应。
用半衰期法来求反应的级数,根据半衰期法的计算公式12121,121,2n t a t a -⎛⎫= ⎪⎝⎭即 ()12,112,221ln /1ln(/)t t n a a =+把实验数据分别代入,计算得()()12,112,2440,20,1ln /ln 7.6/3.7110ln(/)ln(1.710/3.510)t t n p p --=+=+≈⨯⨯ 同理,用后面两个实验数据计算,得 ()ln 3.7/1.710ln(0.75/1.7)n =+≈所以,该反应为零级反应。
利用零级反应的积分式,计算速率系数。
正规的计算方法应该是分别用3组实验数据,计算得3个速率系数,然后取平均值。
这里只列出用第一组实验数据计算的结果,即010022p at k k == 4310012 3.510Pa 2.310 Pa min 227.6 minp k t -⨯===⨯⋅⨯3-2.某人工放射性元素,能放出α粒子,其半衰期为15 min 。
若该试样有80%被分解,计算所需的时间解:放射性元素的蜕变,符合一级反应的特征。
对于一级反应,已知半衰期的数值,就能得到速率系数的值,因为一级反应的半衰期是与反应物浓度无关的常数。
然后再根据一级反应的定积分式,计算分解80%所需的时间。

化学动力学化学动力学(chemical kinetics)是研究化学反映过程的速率和反应机理的物理化学分支学科,它的研究对象是物质性质随时间变化的非平衡的动态体系。
化学动力学也称反应动力学、化学反应动力学,是物理化学的一个分支,是研究化学过程进行的速率和反应机理的物理化学分支学科。
它的研究对象是性质随时间而变化的非平衡的动态体系。
它的主要研究领域包括:分子反应动力学、催化动力学、基元反应动力学、宏观动力学、微观动力学等,也可依不同化学分支分类为有机反应动力学及无机反应动力学。
化学动力学往往是化工生产过程中的决定性因素。
时间是化学动力学的一个重要变量。
经典的化学动力学实验方法不能制备单一量子态的反应物,也不能检测由单次反应碰撞所产生的初生态产物。
体系的热力学平衡性质不能给出化学动力学的信息,全面认识一个化学反应过程并付诸实现,不能缺少化学动力学研究。
原则上,如果能从量子化学理论计算出反应体系的正确的势能面,并应用力学定律计算具有代表性的点在其上的运动轨迹,就能计算反应速率和化学动力学的参数。
但是,除了少数很简单的化学反应以外,量子化学的计算至今还不能得到反应体系的可靠的、完整的势能面。
因此,现行的反应速率理论仍不得不借用经典统计力学的处理方法。
这样的处理必须作出某种形式的平衡假设,因而使这些速率理论不适用于非常快的反应。
尽管对于衡假设的适用性研究已经很多,但完全用非平衡态理论处理反应速率问题尚不成熟。
经典的化学动力学实验方法不能制备单一量子态的反应物,也不能检测由单次反应碰撞所产生的初生态产物。
分子束(即分子散射),特别是交叉分子束方法对研究化学元反应动力学的应用,使在实验上研究单次反应碰撞成为可能。
分子束实验已经获得了许多经典化学动力学无法取得的关于化学元反应的微观信息,分子反应动力学是现代化学动力学的一个前沿阵地。
体系的热力学平衡性质不能给出化学动力学的信息。
例如,对以下反应:2H2(气)+O2(气)─→2H2O(气)尽管H2、O2和H2O的所有热力学性质都已准确知道,但只能预言H2和O2生成H2O的可能性,而不能预言H2和O2在给定的条件下能以什么样的反应速率生成H2O,也不能提供H2分子和O2分子是通过哪些步骤结合为H2O分子的信息。




第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
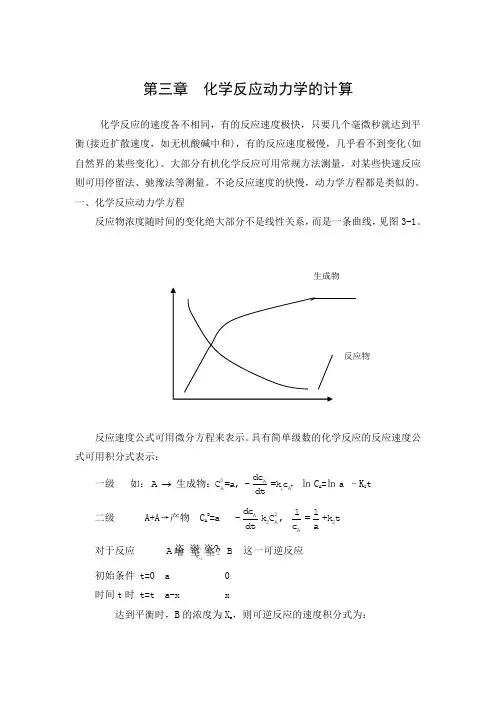
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。

第三章化学动力学基础一、判断题(每题1分,共10分)1. 溶液中,反应物A在t1时的浓度为c1,t2时的浓度为c2,则可以由(c1-c2)/(t1-t2)计算反应速率,当△t→0时,则为平均速率。
()2. 反应2A+2B→C,其速率方程式r = kc(A)[c(B)]2,则反应级数为3。
()3. 化学反应3A(aq)+B(aq)→2C(aq),当其速率方程式中各物质浓度均为1.0 mol∙L--1时,其反应速率系数在数值上等于其反应速率。
()4. 对零级反应来说,反应速率与反应物浓度无关。
()5. 反应aA(aq)+bB(aq)→gG(aq)的反应速率方程式为r = k[c(A)]a[c(B)]b,则此反应一定是一步完成的简单反应。
()6. 可根据反应速率系数的单位来确定反应级数。
若k的单位是mol1-n∙L n-1∙s-1,则反应级数为n。
()7. 对不同化学反应来说,活化能越大者,活化分子分数越多。
()8. 通常升高同样温度,E a较大的反应速率增大倍数较多。
()9. 一般温度升高,化学反应速率加快。
如果活化能越大,则反应速率受温度的影响也越大。
()10. 催化剂只能改变反应的活化能,不能改变反应的热效应。
()二、填空题(每空2分,共40分)1. 元反应A+B→C的反应速率方程式r =________________,其反应级数为_______。
2. 质量作用定律仅适用于________反应;反应速率系数k的单位与元反应方程式中的_____________有关。
3. 某反应的反应速率系数单位为:mol∙L-1·s-1,则该反应的反应级数为________.4. 某反应A→B+C,当A的浓度为0.20 mol·L-1时,反应速率是0.0050 mol∙L-1∙s-1,若是零级反应,反应速率系数为____________,若是一级反应,反应速率系数为_______________。

化学动力学的基本概念化学动力学是研究化学反应速率和反应机理的科学领域。
它关注反应速率随时间、温度、浓度等因素的变化规律,以及反应中的能量变化和物质转化过程。
本文将介绍化学动力学的基本概念,包括反应速率、反应级数、速率常数和反应平衡等内容。
1. 反应速率反应速率是反应物浓度随时间变化的快慢程度,通常用反应物浓度的变化量与时间的变化量的比值来表示。
反应速率可以通过实验测定得到,常用单位是摩尔/升·秒。
反应速率一般随着时间的推移而减小,因为反应物浓度逐渐减少。
2. 反应级数反应级数指的是化学反应中反应物在速率方程式中的指数。
一般而言,反应物的浓度与其在速率方程式中的指数成正比。
如果一个反应物在速率方程式中的指数为1,则称该反应为一级反应;如果某一反应物在速率方程式中的指数为2,则称该反应为二级反应。
反应级数的大小决定了反应速率对浓度变化的敏感程度。
3. 速率常数速率常数是与反应速率有关的一个重要参数,用k表示。
速率常数描述了反应速率与浓度之间的关系。
一般而言,速率常数与反应温度密切相关,随着温度的升高而增大。
速率常数还与反应物的特性和反应机制有关。
4. 反应平衡当反应速率达到一定的平衡状态时,反应物与产物的浓度不再发生明显的变化,此时的反应称为反应平衡。
在反应平衡时,反应物和产物之间的摩尔比例称为平衡常数,通常用K表示。
平衡常数的大小与温度有关,不同温度下的反应平衡常数可以通过实验测定得到。
总结化学动力学研究化学反应速率的变化规律,它的基本概念包括反应速率、反应级数、速率常数和反应平衡。
通过对这些概念的研究,可以深入了解化学反应动力学的基本原理和规律,为实际应用中的化学反应控制和优化提供理论依据。
通过对反应速率、反应级数、速率常数和反应平衡等概念的深入研究,我们可以更好地理解化学反应的速率以及与之相关的因素,为化学工艺和反应控制提供指导。
这篇文章对化学动力学的基本概念进行了介绍,其中包括了反应速率、反应级数、速率常数和反应平衡等内容。
第三章 化学动力学3-1.在1 100 K 时,3NH (g)在金属钨丝上发生分解。
实验测定,在不同的3NH (g)的初始压力0p 下所对应的半衰期12t ,获得下列数据0/Pa p 3.5×104 1.7×104 0.75×104 1/min t 7.6 3.7 1.7 试用计算的方法,计算该反应的级数和速率系数。
解: 根据实验数据,反应物3NH (g)的初始压力不断下降,相应的半衰期也不断下降,说明半衰期与反应物的起始浓度(或压力)成正比,这是零级反应的特征,所以基本可以确定是零级反应。
用半衰期法来求反应的级数,根据半衰期法的计算公式12121,121,2n t a t a -⎛⎫= ⎪⎝⎭即 ()12,112,221ln /1ln(/)t t n a a =+把实验数据分别代入,计算得()()12,112,2440,20,1ln /ln 7.6/3.7110ln(/)ln(1.710/3.510)t t n p p --=+=+≈⨯⨯ 同理,用后面两个实验数据计算,得 ()ln 3.7/1.710ln(0.75/1.7)n =+≈所以,该反应为零级反应。
利用零级反应的积分式,计算速率系数。
正规的计算方法应该是分别用3组实验数据,计算得3个速率系数,然后取平均值。
这里只列出用第一组实验数据计算的结果,即010022p at k k == 431001 3.510Pa 2.310 Pa min 227.6 minp k t -⨯===⨯⋅⨯3-2.某人工放射性元素,能放出α粒子,其半衰期为15 min 。
若该试样有80%被分解,计算所需的时间?解:放射性元素的蜕变,符合一级反应的特征。
对于一级反应,已知半衰期的数值,就能得到速率系数的值,因为一级反应的半衰期是与反应物浓度无关的常数。
然后再根据一级反应的定积分式,计算分解80%所需的时间。
112ln 2ln 2=0.046 min 15 mink t -== 试样被分解80%,即转化分数0.80y =,代入一级反应的定积分式,得所需时间为 111ln 1t k y=- 111ln 35.0 min 0.046min 10.80-=⨯=-3-3.已知物质A 的分解反应是一级反应。
在一定温度下,当A 的起始浓度为30.1 mol dm -⋅时,分解20%的A 需时50min 。
试计算 (1) 该反应的速率系数k 。
(2) 该反应的半衰期1t 。
(3) 当A 的起始浓度为30.02 mol dm -⋅时,分解20%的A 所需的时间。
解:(1) 因为是一级反应,已知在50min 内A 的分解分数,可利用一级反应的定积分式,计算速率系数k 。
即11 ln 1k t y=-3111ln 4.4610min 50min 10.2--==⨯-(2)一级反应的半衰期与反应物的起始浓度无关,只要知道速率系数的值,就能计算一级反应的半衰期,即131ln 2ln 2155.4 min 4.4610 mint k --===⨯ (3) 对于一级反应,在达到各种转化分数时,所需的时间与半衰期一样,都与反应物的起始浓度无关。
所以,只要转化分数相同,所需的时间也就相同。
现在A 的分解分数都是20%,所以(3)的答案与已知的条件相同,也是50min 。
3-4.某抗菌素A 注入人体后,在血液中呈现简单的级数反应。
如果在人体中注射0.5 g 该抗菌素,然后在不同时刻t ,测定A 在血液中的浓度A c (以 mg/100cm 3表示),得到下面的数据:/h t 4 8 12 16 3A /(mg/100cm )c 0.480 0.326 0.222 0.151 (1) 确定反应的级数。
(2) 计算反应的速率系数。
(3) 求A 的半衰期。
(4) 若要使血液中抗菌素浓度不低于0.370mg/100cm 3,计算需要注射第二针的时间。
解:(1)有多种方法可以确定该反应的级数。
方法1.因为测定时间的间隔相同, 4 h t =。
利用一级反应的定积分式0ln c kt c=,则0exp()c kt c=。
在时间间隔相同时,等式右边是常数,则看等式左边c 0/c 的值,是否也基本相同。
将实验数据代入c 0/c 计算式进行计算,得00.4800.3260.222=== 1.470.3260.2220.151c c ≈ 等式左边c 0/c 也基本是一常数,所以可以确定该反应为一级。
方法2. 利用尝试法,假设反应是一级,将c A 与t 的值代入一级反应的积分式,用每两组实验数据计算一个速率系数值,看是否基本为一常数,10.480ln4 h 0.0967 h 0.326k k -=⨯= 10.326 ln 4 h 0.0961 h 0.222k k -=⨯= 10.222 ln 4 h 0.0963 h 0.151k k -=⨯= 计算得到的速率系数值基本为一常数,所以原来的假设是正确的,该反应为一级反应。
也可以用1ln t a x-作图,也就是用A1lnt c 作图,若得到一条直线,说明是一级反应。
(2) 将(1)中得到的几个速率系数,取一个平均值,得 10.0964 h k -=。
(3) 利用一级反应的半衰期公式121ln 2ln 27.19 h 0.0964 h t k-=== (4) 方法1。
利用一级反应的积分式,以在4 h 时测试的浓度为起始浓度,不低于0.37mg/100cm 3的浓度为终态浓度,计算从4 h 起到这个浓度所需的时间,1lnat k a x =- 110.480ln 2.70 h 0.0964 h 0.370-=⨯= 所以,注射第二针的时间约是:(2.7 4.0) h 6.7 h t =+=方法2。
利用实验数据和已经得到的速率系数值,先计算抗菌素的初始浓度1lnak t a x=- 13ln0.0964 h 4.0 h 0.480(mg/100cm )a -=⨯ 解得抗菌素的初始浓度30.706(mg/100cm )a =,则注射第二针的时间约为11110.706ln ln 6.70 h 0.0964 h 0.370a t k a x -===- 3-5.在大气中,CO 2的含量较少,但可鉴定出放射性同位素14C 的含量。
一旦CO 2被光合作用“固定”,从大气中拿走14C ,作为植物的组成后,新的14C 又不再加入,那么植物中14C 的放射量会以5770年为半衰期的一级过程减少。
现从一棵古代松树的木髓中取样,测定得到的14C 含量是大气中CO 2的14C 含量的54.9%,试计算该古松树的树龄。
解:放射性同位素的蜕变是一级反应。
设在大气中,CO 2的14C 含量为c 0,古松树中14C 的含量为c 。
根据已知的14C 的半衰期,利用一级反应的特点,计算出速率系数的值4112ln 20.6931.2010 a 5 770 ak t --===⨯ 再利用一级反应的定积分式,计算14C 的量剩下54.9%所需的时间11 ln 1t k y=- 4111ln 4 997 a 1.2010a 0.549--==⨯ 这就是该古松树的树龄,为4 997 年。
3-6.某有机化合物A ,在酸催化下发生水解反应,在323 K ,pH =5的溶液中进行时,其半衰期为69.3 min ,在pH =4的溶液中进行时,其半衰期为6.93 min ,且知在两个pH 值的各自条件下,半衰期12t 均与A 的初始浓度无关。
设反应的速率方程为+d[A][A][H ]d k tαβ-= 试计算 (1) α和β的值。
(2) 在 323 K 时,反应的速率系数 k 。
(3) 323 K 时,在pH =3的水溶液中,A 水解 80%所需的时间。
解:根据已知条件,半衰期12t 均与A 的初始浓度无关,这是一级反应的特征,所以对反应物A 是一级反应,即1α=。
因为酸是催化剂,反应前后其浓度不变,可并入速率系数项,即 +''d[A][A][H ][A][A] d r k k k tαβα=-=== 根据一级反应的特点有 '12ln 2k t =,代入在不同酸浓度下的半衰期数值,两式相比,得 '121'21(2) 6.930.1(1)69.3t k k t === ①因为'[H ]k k β+=,所以在不同pH 的溶液中,有'511'422[H ](10)(0.1)[H ](10)k k k k βββββ+-+-=== ② 将①与②两个公式相比较,得β =1。
(2)根据一级反应的特征,'112ln 20.6930.01min 69.3mink t -=== '1530.01min 10mol dmH k k ---+==⋅⎡⎤⎣⎦ 3111000 (mol dm )min ---=⋅⋅(3) 根据一级反应的定积分公式'1111ln ln 11H t k y y k +==--⎡⎤⎣⎦3111ln 1.61min (100010)min 10.8--==⨯- 3-7.某一级反应的半衰期,在300 K 和310 K 分别为5 000 s 和1 000 s ,求该反应的活化能。
解: 已知一级反应的半衰期,就等于知道了一级反应的速率系数,因为 12ln 2t k=半衰期之比就等于速率系数的反比。
根据Arrhenius 公式的定积分公式,已知两个温度下的速率系数值,就可以计算反应的活化能。
121a 2112122()()11lnln ()()t T E k T k T R T T t T ⎛⎫=-= ⎪⎝⎭ a 115 00011ln1 0008.314 J K mol 300K 310K E --⎛⎫=- ⎪⋅⋅⎝⎭解得活化能 1a 124.4 kJ mol E -=⋅3-8.某些农药的水解反应是一级反应。
已知在293 K 时,敌敌畏在酸性介质中的水解反应也是一级反应,测得它的半衰期为61.5 d ,试求:在此条件下,敌敌畏的水解速率系数。
若在343 K 时的速率系数为0.173 h -1,求在343 K 时的半衰期及该反应的活化能E a 。
解: 一级反应的半衰期与反应物的起始浓度无关,从293 K 时的半衰期表示式,求出该温度下的反应速率系数12ln 2ln 2(293 K)61.5 dk t == 1410.0113 d 4.7110 h ---==⨯ 再从343 K 时的速率系数值,求出该温度下的半衰期 112ln 20.693(343 K) 4.01 h 0.173 h t k -=== 已知两个温度下的速率系数,根据Arrhenius 公式的定积分公式,就可以计算反应的活化能。