第三章 化学动力学2
- 格式:ppt
- 大小:1.75 MB
- 文档页数:2

第三章化学动力学(总15页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第三章 化学动力学3-1.在1 100 K 时,3NH (g)在金属钨丝上发生分解。
实验测定,在不同的3NH (g)的初始压力0p 下所对应的半衰期12t ,获得下列数据 0/Pa p ×104 ×104 ×104 12/min t 试用计算的方法,计算该反应的级数和速率系数。
解: 根据实验数据,反应物3NH (g)的初始压力不断下降,相应的半衰期也不断下降,说明半衰期与反应物的起始浓度(或压力)成正比,这是零级反应的特征,所以基本可以确定是零级反应。
用半衰期法来求反应的级数,根据半衰期法的计算公式12121,121,2n t a t a -⎛⎫= ⎪⎝⎭即 ()12,112,221ln /1ln(/)t t n a a =+把实验数据分别代入,计算得()()12,112,2440,20,1ln /ln 7.6/3.7110ln(/)ln(1.710/3.510)t t n p p --=+=+≈⨯⨯ 同理,用后面两个实验数据计算,得 ()ln 3.7/1.710ln(0.75/1.7)n =+≈所以,该反应为零级反应。
利用零级反应的积分式,计算速率系数。
正规的计算方法应该是分别用3组实验数据,计算得3个速率系数,然后取平均值。
这里只列出用第一组实验数据计算的结果,即010022p at k k == 4310012 3.510Pa 2.310 Pa min 227.6 minp k t -⨯===⨯⋅⨯3-2.某人工放射性元素,能放出α粒子,其半衰期为15 min 。
若该试样有80%被分解,计算所需的时间解:放射性元素的蜕变,符合一级反应的特征。
对于一级反应,已知半衰期的数值,就能得到速率系数的值,因为一级反应的半衰期是与反应物浓度无关的常数。
然后再根据一级反应的定积分式,计算分解80%所需的时间。





第三章化学反应速率化学动力学(chemical kinetics):研究化学反应速率的科学 .主要研究 :化学反应速率的理论反应机理影响反应速率的因素第一节化学反应速率和反应机理一化学反应速率表示方法化学反应速率(rate of a chemical reaction):衡量化学反应过程进行的快慢,即反应体系中各物质的数量随时间的变化率。
反应速率:平均速率瞬时速率过氧化氢(H2O2)水溶液的分解反应为:H2O2(aq)H2O(l) +12O2(g)I-v00.80200.400.40/20=0.020400.200.20/20=0.010600.10t /min[H 2O 2]/ (mol ⋅L -1)/(mol ⋅L -1⋅⋅min -1)800.050表7-1 H 2O 2水溶液在室温时的分解0.10/20=0.005 00.050/20=0.002 5平均速率(average rate) :瞬时速率(instantaneous rate) :令Δt 趋近于零时的速率。
通常所表示的反应速率均指瞬时速率。
tc v Δ)O H (Δ22-=tc t cd )O (H d O (H lim 2222-=∆∆-=)v反应的瞬时速率可通过作图法求得。
20min时H2O2分解的瞬时速率,A点切线的斜率,去负号即可.如合成氨的反应 :N 2 + 3H 2 ==== 2NH 3一般地,对于化学反应aA + bB = gG + hH 其反应速率定义为:tc t c t c t c νt ξVd NH d d H d d N d d d d d 1B B )(21)(31)(111322=-=-=⋅=⋅=v二 反应机理概念反应机理(reaction mechanism):就是化学反应进行的实际步骤,即实现该化学反应的各步骤的微观过程。
H 2(g)+I 2(g)2HI(g)I 2(g)2I(g)快反应)慢反应(速率控制步骤)H 2(g)+2I(g)2HI(g))2(g)2I(g)快反应(1)慢反应(速率H 2(g)+2I(g)2HI(g)(2)(一)基元反应和非基元反应(基)元反应(elementary reaction)是指反应物分子一步直接转化为产物分子的反应。

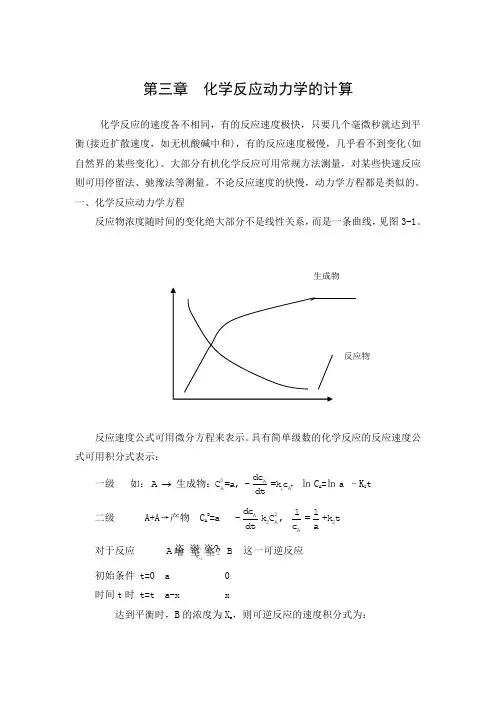
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。



大学无机及分析化学第三章化学动力学题附答案第三章化学动力学基础一判断题1.溶液中,反应物 A 在t1时的浓度为c1,t2时的浓度为c2,则可以由 (c1-c2 ) / (t1 - t2 ) 计算反应速率,当△t→ 0 时,则为平均速率。
......................................................................()2.反应速率系数k的量纲为 1 。
..........................()3.反应2A + 2B → C,其速率方程式v = kc (A)[c (B)]2,则反应级数为 3。
................()4.任何情况下,化学反应的反应速率在数值上等于反应速率系数。
..........()5.化学反应3A(aq) + B(aq) → 2C(aq) ,当其速率方程式中各物质浓度均为 1.0 mol·L-1时,其反应速率系数在数值上等于其反应速率。
......................................................................()6.反应速率系数k越大,反应速率必定越大。
......()7.对零级反应来说,反应速率与反应物浓度无关。
...........................................()8.所有反应的速率都随时间而改变。
........................()9.反应a A(aq) + b B(aq) → g G(aq) 的反应速率方程式为v = k [c (A)]a[ c(B)]b,则此反应一定是一步完成的简单反应。
........................()10.可根据反应速率系数的单位来确定反应级数。
若k的单位是 mol1-n·L n-1·s-1,则反应级数为n。
物理化学习题答案第六版物理化学习题答案第六版是一本非常重要的参考书籍,它包含了许多物理化学领域的经典习题和答案。
通过学习这本书,我们能够更好地理解物理化学的概念和原理,并提高解决问题的能力。
在这篇文章中,我将分享一些我在学习中遇到的一些习题以及对应的答案,希望能够对大家的学习有所帮助。
第一章:热力学1. 对于一个理想气体,当它的体积减小一半时,温度保持不变。
求气体的绝热指数γ。
答案:根据理想气体状态方程PV = nRT,当体积减小一半时,压强翻倍。
根据绝热过程的关系式PV^γ = 常数,代入压强翻倍的条件,可得γ = 1.4。
第二章:量子力学1. 一个质量为m的自由粒子,处于势能为V(x) = 0的无限深势阱中,求其能量本征值和能量本征函数。
答案:根据量子力学的基本原理,能量本征值由Schrödinger方程确定。
在无限深势阱中,Schrödinger方程为-d^2ψ/dx^2 = Eψ,其中E为能量本征值,ψ为能量本征函数。
根据边界条件,能量本征值为En = (n^2π^2ħ^2)/(2mL^2),能量本征函数为ψn(x) = √(2/L)sin(nπx/L),其中L为势阱的宽度。
第三章:化学动力学1. 对于一个一级反应,当初始浓度为C0时,经过时间t后浓度降低到C。
求反应速率常数k。
答案:一级反应的反应速率方程为-dC/dt = kC,其中k为反应速率常数。
将反应速率方程积分得到ln(C/C0) = -kt,整理后可得k = -ln(C/C0)/t。
第四章:电化学1. 在电解质溶液中,当施加电压U时,溶液中的电流I为多少?答案:根据欧姆定律,电流I等于电压U除以电阻R。
所以,I = U/R。
第五章:光化学1. 在光化学反应中,光子与分子碰撞后发生电子跃迁,从而产生化学反应。
请问光子的能量与波长之间的关系是什么?答案:光子的能量E与波长λ之间的关系由普朗克公式确定,即E = hc/λ,其中h为普朗克常数,c为光速。