高三钠及其化合物复习
- 格式:ppt
- 大小:196.00 KB
- 文档页数:18
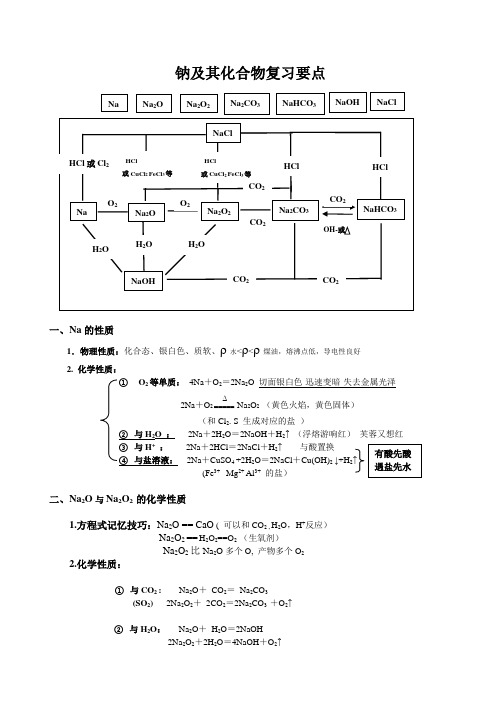
钠及其化合物复习要点一、Na 的性质1.物理性质:化合态、银白色、质软、ρ水<ρ<ρ煤油,熔沸点低,导电性良好2. 化学性质:① O 2等单质: 4Na +O 2=2Na 2O 切面银白色-迅速变暗-失去金属光泽2Na +O 2∆=====Na 2O 2 (黄色火焰,黄色固体)(和Cl 2. S 生成对应的盐 )② 与H 2O : 2Na +2H 2O =2NaOH +H 2↑ (浮熔游响红) 芙蓉又想红 ③ 与H + : 2Na +2HCl =2NaCl +H 2↑ 与酸置换④ 与盐溶液: 2Na +CuSO 4 +2H 2O =2NaCl +Cu(OH)2 ↓+H 2↑(Fe 3+ Mg 2+ Al 3+ 的盐)二、Na 2O 与Na 2O 2 的化学性质1.方程式记忆技巧:Na 2O == CaO ( 可以和CO 2 , H 2O ,H +反应) Na 2O 2 == H 2O 2==O 2 (生氧剂)Na 2O 2比Na 2O 多个O, 产物多个O 2 2.化学性质:① 与CO 2 : Na 2O + CO 2= Na 2CO 3(SO 2) 2Na 2O 2+ 2CO 2=2Na 2CO 3 +O 2↑② 与H 2O : Na 2O + H 2O =2NaOH2Na 2O 2+2H 2O =4NaOH +O 2↑O 2NaNa 2ONaHCO 3 Na 2CO 3 NaOHNa 2O 2NaClNaNa 2O Na 2O 2Na 2CO 3NaHCO 3O 2CO 2CO 2NaOHH 2OH 2OH 2OCO 2NaClHCl 或Cl 2HCl或CuCl 2 FeCl 3等HClHClHCl或CuCl 2 FeCl 3等CO 2CO 2OH-或有酸先酸遇盐先水③ 与H +: Na 2O + 2HCl = 2NaCl+ H 2O2Na 2O 2+4HCl = 4NaCl +2H 2O + O 2↑ ④ 与盐溶液: Na 2O + CuSO 4 + H 2O =Na 2SO 4+Cu(OH)2 ↓2Na 2O 2+2CuSO 4 +2H 2O =2Na 2SO 4+2Cu(OH)2 ↓ +O 2↑(Fe 3+ Mg 2+ Al 3+ 的盐)三、Na 2CO 3 与NaHCO 3的性质1.物理性质:化学式 Na 2CO 3 NaHCO 3 俗名 纯碱 苏打 小苏打 色态 白色(粉末)白色(晶体)溶解性 Na 2CO 3 > NaHCO 3 碱性Na 2CO 3 > NaHCO 32. 化学性质:① 热稳定性: Na 2CO 3 > NaHCO 3不分解 2NaHCO 3∆===== Na 2CO 3+H 2O↑+CO 2↑② 与H +: Na 2CO 3 慢 < NaHCO 3 快Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑ CO -23+2H +=H 2O +CO 2↑NaHCO 3+HCl =NaCl +H 2O +CO 2↑ HCO -3+H +== H 2O +CO 2↑③ 与NaOH : Na 2CO 3 NaHCO 3不反应 NaHCO 3+NaOH=Na 2CO 3+H 2O HCO -3+OH —== H 2O +CO 32—↑④ 与Ca(OH)2: Na 2CO 3 + Ca(OH)2 = 2NaOH+ Ca CO 3↓或Ba(OH)2 2NaHCO 3+Ca(OH)2 =Na 2CO 3+ Ca CO 3↓+2H 2O ⑤ 与可溶性Ca 盐或Ba 盐:NaHCO 3 Na 2CO 3不反应 Na 2CO 3+ CaCl 2=Ca CO 3+NaCl 23. 两者的鉴别: ① Na 2CO 3 Ca(OH)2 无现象NaHCO 3 石灰水变浑浊 ② Na 2CO 3 过量酸 慢 NaHCO 3 快 ③ Na 2CO 3 逐滴酸 后出气体NaHCO 3 先出气体有酸先酸 遇盐先水④可溶性Ca盐或Ba盐:Na2CO3 盐溶液↓NaHCO3 无现象4. 两者的相互转化CO2+H2ONa2CO3 NaHCO3①液OH- ②固四、焰色反应(物理方法)Na+ 黄K+ (紫--蓝色钴玻璃)(1)待测液:含有某元素的溶液(不能判别是分子,原子还是离子,只能判断元素种类)(2)金属丝:铂丝(铁丝、镍丝、钨丝等来熔点高金属丝代替).但不能用铜丝(绿色火焰干扰).(3)盐酸:去除金属丝表面的氧化物.(4)蓝色的钴玻璃:观察钾的焰色(因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰)(5)操作过程:洗烧蘸烧金属丝金属丝至无色待测液金属丝,看颜色。

钠及其化合物(高考必备知识点)利用“价-类”二维图认识钠及其化合物之间的转化关系一、活泼金属钠钠的原子结构为钠离子1、钠的物理性质:银白色、质软、熔沸点低、导电导热性好、密度比水小。
注:钠保存在煤油中或石蜡油中,取用后剩余的钠要放回原试剂瓶中;钠着火时,用沙土灭火。
2、钠的化学性质:(1)钠与水反应:化:2Na + 2H2O = 2NaOH + H22Na + 2H2O = 2Na+ + 2OH- + H2(2)钠与氧气反应:4Na + O2 = 2Na2O (常温)4Na + O2 = 2Na2O2(发出黄色火焰,生成淡黄色固体)(3)钠与卤素反应:2Na + Cl2 = 2NaCl(I2、Br2类似,生成卤化钠)(4)钠与硫、氢气等非金属单质反应:2Na + S = Na2S 2Na + H2 = 2NaH(5)钠与酸溶液反应:2Na + 2HCl = 2NaCl + H2(如果钠少量,只能与酸反应;若钠过量,先与酸反应,再与酸溶液中的水反应) (6)钠与盐溶液反应:将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应.如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Na2SO4+ Cu ( OH )2↓(7)钠与熔融盐反应:这类反应多数为置换反应,常见于金属冶炼工业中,如:4Na+TiCI4(熔融)=4NaCl+ Ti (条件为高温)Na + KCl = K + NaCl (条件为高温)★钠与熔融盐反应不能证明金属活动性的强弱(8)钠与有机物反应:钠还能与某些有机物反应,如钠与乙醇反应:2Na+2C2H5OH→2CH3CH2ONa+H2↑(生成物为氢气和乙醇钠)(钠还能与苯酚反应生成苯酚钠和氢气;与乙酸反应生成乙酸钠和氢气)(9)钠露置在空气中的变化二、氧化钠与过氧化钠三、碳酸钠与碳酸氢钠四、侯氏制碱法化学反应原理:NH3+CO2+ H2O = NH4HCO3NaCl(饱和)+ NH4HCO3=NaHCO3↓+ NH4CI总反应:NaCl(饱和)+NH3+CO2+H2O= NaHCO3↓+ NH4CI 将经过滤、洗涤得到的NaHCO3微小晶体再加热,制得纯碱产品:2NaHCO3 = Na2CO3+CO2↑+H20注:1、将氟化钠溶于水制成饱和氯化钠溶液,2、先通入NH3达饱和,3、再通入CO2至饱和,4、过滤,得到碳酸氢钠固体,5、加热固体、得纯碱.6、滤液,主要是氧化铵。

高三化学一轮复习钠及其化合物知识网络考点一钠的性质、制备、保存和用途1.钠的物理性质颜色状态密度硬度熔点银白色固体比水的密度____,比煤油的密度____ 较小较低,小于100 ℃2.钠的化学性质(1)钠与非金属的反应在一定条件下,可与O2、Cl2、S等非金属反应生成相应的化合物。
常温下,钠与O2反应生成白色固体Na2O,化学方程式为____________________。
点燃条件下,钠与O2反应生成淡黄色固体Na2O2,化学方程式为________________________。
(2)钠与水的反应①化学方程式为_____________________________________。
②离子方程式为_____________________________________。
③钠与含有酚酞的水反应的现象及解释。
(3)与酸溶液反应(如HCl)2Na+2HCl===________________(4)与盐反应a.与熔融盐反应如:4Na+TiCl44NaCl+TiNa+KClNaCl+K↑(制取金属钾,因为钾的沸点比钠的沸点低,使钾成为蒸汽而逸出)b.与盐溶液反应Na与CuSO4溶液反应的化学方程式___________________(5)与某些有机物反应如:2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑2Na+2CH3COOH―→2CH3COONa+H2↑3.钠的制备与保存(1)钠在自然界以化合态形式存在。
工业上通常用电解熔融氯化钠的方法制备钠:2NaCl(熔融)2Na+Cl2↑。
(2)金属钠保存在煤油中,使之隔绝空气与水。
4.钠的用途(1)制取Na2O2等化合物。
(2)______________可用于原子反应堆的导热剂。
(3)用作电光源,制作________。
Array(4)冶炼某些金属。
金属钠具有强的________,熔融状态下可以用于制取金属,如4Na+TiCl44NaCl+Ti。

第二章高三碱金属复习一(钠及其化合物)学习目标:了解碱金属的性质;了解Na2O和Na2O2的性质;掌握氢氧化钠的性质和用途;掌握碳酸钠和碳酸氢钠的区别和联系用二者的鉴别方法;从物质结构上理解碱金属元素(单质、化合物)的相似性和递变规律;了解焰色反应的概念及操作方法。
疑难点拔:1、单质钠的化学性质:钠原子最外层只有一个电子,在反应中极易失去这个电子,所以单质钠具有强还原性,可与非金属单质(如:O2、X2、S等)反应,也可与水、酸、盐溶液和熔融的盐等到反应。
在复习这些反应时应注意发下几点:(1)不同条件下钠与氧气(或空气)反应的现象、反应物的用量、产物的结构和稳定性不同;(2)钠与水反应的现象的原因解释;(3)钠与水、酸、盐溶液的反应,实质上是钠原子与水或酸电离出的H+的反应,所以H+浓度不同,反应剧烈程度不同;(4)金属活动顺序表吵氢后面的金属阳离子的氧化性虽然强于H+,但其反应速率远小于钠原子与H+的反应速率,故金属钠投入盐溶液中首先是与水的反应;然后再分析NaOH是否与盐发生复分解反应。
如果是铝盐溶液,还要考虑钠和铝盐的量的问题,因过量的NaOH 能溶解Al(OH)3;(5)工业上利用钠作还原剂把钛、锆、铌、钽等金属从它们的熔炉融卤化物中还原出来,不能有水的参与;如:。
22223233典型例题分析:例1:将同样大小的金属钠,分别加入①MgCl 2溶液 ②饱和NaCl 溶液 ③NH 4Cl 溶液中,各发生什么现象?主要生成物是什么? 。
例2:可能由CO 、CO 2和O 2组成的混合气体30mL ,通过足量的Na 2O 2,经充分反应后,气体体积变为25mL ,引燃剩余气体,恢复到原温度,测得体积变为20mL (气体体积为相同条件下测得)。
求原混合气体中O 2的体积是多小mL ?例3:将mmolNaHCO 3和nmolNa 2O 2的固体混合物置于密闭容器中,加热到250℃时,使其充分反应。
当n/m 的比值在不同范围时,分析最后生成的气体和残余固体的可能组成是什么?课堂练习:1、下列叙述不正确..的是:A 、Na 的化学性质很活泼,它在自然界中不能以游离态存在B 、Na 2CO 3比NaHCO 3热稳定性强C 、Na 2O 与Na 2O 2都能与水反应产生,同时放出O 2D 、等物质的量的Na 2CO 3和NaHCO 3分别与足量的盐酸反应,Na 2CO 3放出的CO 2比NaHCO 3少2、下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是:A 、Na 和O 2B 、NaOH 和CO 2C 、Na 2O 2和CO 2D 、NaCl 和浓H 2SO 43、钠的下列用途与钠的化学性质无关的是:A 、制取过氧化钠B 、作原子反应堆的导热剂C 、冶炼金属钛D 、应用在电不源上4、下列物质中能使品红试液褪色的是:①活性碳 ②过氧化钠 ③次氯酸钠 ④二氧化硫 ⑤干燥氯气 ⑥双氧水 ⑦臭氧A 、除①以外都可以B 、除⑤以外都可以C 、只有②③④⑥⑦可以D 、全部都可以5、下列各组比较不正确的是:A 、熔点:K Na Li >>.B 、碱性:KOH NaOH LiOH <<C 、还原性:Li Na K >>D 、密度:Li Na K >>6、下列钠元素的化合物,无天然存在的是:①氧化物 ②氢氧化物 ③碳酸盐 ④硝酸盐 ⑤硫酸盐A 、①②B 、除④外C 、除④⑤D 、不属于上述组合7、2.3g 钠放入100g 水中,所得溶液的质量分数是A 、等于2.3%B 、大于2.3%C 、等于4%D 、大于4%8、欲除去小苏打溶液中少量的苏打,最好选用:A 、盐酸B 、苛性钠C 、通二氧化碳D 、石灰水9、下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是:A 、2Na 2O 2+2H 2O =4NaOH+O 2↑B 、2Na+2H 2O =2NaOH+H 2↑C 、2F 2+2H 2O =4HF+O 2D 、Na 2O+H 2O =2NaOH10、下列共存各组的离子通常只能用焰色反应来鉴别的一组是:A 、Ca 2+、Cu 2+、Mg 2+B 、K +、Na +、Ba 2+C 、K +、Ba 2+、Ag +D 、Na +、Cu 2+、Ba 2+11、向紫色石蕊试液中加入过量Na 2O 2粉末,振荡,下列叙述中正确的是:A 、溶液仍为紫色,并有气泡产生B 、最后溶液变蓝色,并有气泡产生C 、最后溶液褪色,并有气泡产生D 、最后溶液变红,色并有气泡产生12、含有锂和另一种碱金属组成的混合物,取1.9g 与水充分反应后,得到0.1gH 2,则另一种碱金属可能是:A 、NaB 、KC 、RbD 、Cs13、在甲、乙、丙、丁4个烧杯中分别加入0.1mol 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL 水,搅拌使固体完全溶解,则甲、乙、丙、丁的溶液质量分数大小顺序是:A 、甲<乙<丙<丁B 、丁<甲<乙=丙C 、甲=丁<乙=丙D 、丁<甲<乙<丙 14、O Na 2、22O Na 、32CO Na 、3NaHCO 、NaCl 中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过NaOH 的溶液后,气体体积减少;若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前有所增加,下列推断正确的是A 、混合物中一定不含有O Na 2B 、混合物中是否含有32CO Na 和NaCl 无法确定C 、混合物中一定不含有22O Na 和NaClD 、混合物中一定不含有32CO Na 和NaCl15、有Na 2CO 3、NaHCO 3、CaO 和NaOH 组成的混合物27.2克,把它们溶于足量的水中,充分反应后,溶液中的Ca 2+、CO 32-和HCO 3-均转化为沉淀,将反应容器中的水分蒸干,最后得到白色固体共29克, 则原混合物中Na 2CO 3的质量为:A 、10.6克B 、5.3克C 、5.9克D 、无法确定16、氢化钠(NaH)是一种白色晶体,其中钠为+1价,氢化钠和水反应放出氢气,下列叙述正确的是A 、NaH 溶于水显酸性B 、NaH 和水反应时,水为还原剂C 、NaH 中氢离子被氧化成H 2D 、NaH 中氢离子半径小于锂离子17、有关Na 2CO 3, NaHCO 3的题目:(1) 纯碱________苏打______ 小苏打_______;(2) 受热不稳定的是_____ 溶解度较大的是_____ 与同浓度盐酸反应更剧烈的是_______; 滴入CaCl 2溶液变浑浊的是_____;既能与HCl 反应又能与NaOH 反应的是_______;加入澄清石灰水能出现浑浊的是________________;(3) Na 2CO 3中含有少量NaHCO 3固体如何提纯? ;(4) Na 2CO 3与NaHCO 3有哪些方法区别? 哪种方法最简单? ;18、在三个密闭容器中分别装有:A 、Na 2O 2和NaHCO 3,B 、Na 2O 2和NH 4HCO 3,C 、Na 2O 2和Ca(HCO 3)2,其中每种物质均有1mol 。

