高三一轮复习《钠及其化合物》
- 格式:ppt
- 大小:1.43 MB
- 文档页数:34

一轮复习第三章金属及其化合物第一讲钠及其化合物(第1课时)教学设计教学目标:知识与技能:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
过程与方法:1、学生自学基本了解钠及其化合物(氧化钠、过氧化钠)的性质。
2、通过思维导图引导学生知道如何复习元素化合物。
3、教师和学生共同通过思维导图学习钠、氧化钠、过氧化钠的性质及运用态度与价值观:1、使学生认识自学是很好且终生的学习的方法。
2、使学生认识思维导图是很好的学习工具。
教学重点:钠和过氧化钠的性质及其运用。
教学难点:学生对知识的整理与归纳的能力的培养。
教学过程:教学过程教学目标教学内容活动设计考纲解读使学生知道学习的方向和要点钠及其化合物在高考纲要求:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
考纲解读:1、掌握钠、过氧化钠、碳酸钠和碳酸氢钠的性质及其运用。
考中的要求和考试形式。
2.了解氧化钠和氢氧化钠。
展示导图:考情分析:此部分内容在选择题和大题中都有可能出现,通常以钠及其化合物考察NA、物质结构、电学、电离和水解等方面。
引导分析了解学习某物质的方法某物质应了解或掌握的内容1、与学生共同回顾在学习元素化合物时通常要知道其哪些方面。
2、展示导图。
思考完善学生用思维导图自学复习钠的性质及用途复习钠的性质及用途学生结合前面讨论完善自己的思维导图。
学生讲述1.培养学生归纳总结的能力2.复习钠的制法、物理性质、化学性质、用钠的制法、物理性质、化学性质、用途及制请优秀学生讲述他的思维导图中关于单质钠的部分。
途及制法法教师作品展示1.巩固钠的相关性质。
2.指导学生思维导图的绘制。
钠的制法、物理性质、化学性质、用途及制法1.展示教师的钠单质的思维导图。
2.与学生作品比较,指出各自的优缺点。
练习巩固、检测钠的相关性质钠的相关性质过渡引入钠的氧化物的复习思维导图体现了每个人对知识的理解认知程度,也是个性的充分表现。
用心画好每张图。
愉快的欣赏每张图,学习是快乐的,生活是美好的。



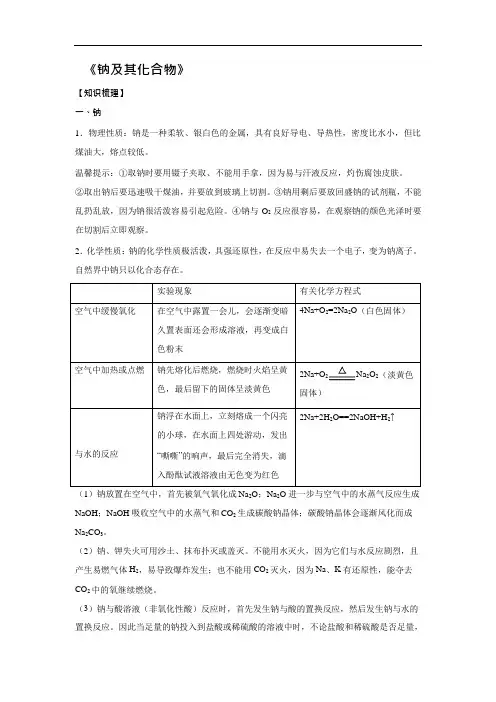
《钠及其化合物》【知识梳理】一、钠1.物理性质:钠是一种柔软、银白色的金属,具有良好导电、导热性,密度比水小,但比煤油大,熔点较低。
温馨提示:①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤。
②取出钠后要迅速吸干煤油,并要放到玻璃上切割。
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险。
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察。
2.化学性质:钠的化学性质极活泼,具强还原性,在反应中易失去一个电子,变为钠离子。
自然界中钠只以化合态存在。
2Na+O2Na2O2(淡黄色固体)(1)钠放置在空气中,首先被氧气氧化成Na2O;Na2O 进一步与空气中的水蒸气反应生成NaOH;NaOH 吸收空气中的水蒸气和CO2 生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成Na2CO3。
(2)钠、钾失火可用沙土、抹布扑灭或盖灭。
不能用水灭火,因为它们与水反应剧烈,且产生易燃气体H2,易导致爆炸发生;也不能用CO2灭火,因为Na、K 有还原性,能夺去CO2 中的氧继续燃烧。
(3)钠与酸溶液(非氧化性酸)反应时,首先发生钠与酸的置换反应,然后发生钠与水的置换反应。
因此当足量的钠投入到盐酸或稀硫酸的溶液中时,不论盐酸和稀硫酸是否足量,金属钠均能完全反应,产生氢气的多少由金属钠决定。
(4)钠与盐溶液反应时,首先发生钠与水的反应,生成NaOH 和H2;然后发生NaOH 溶液与盐溶液的反应。
如钠与硫酸铜溶液的反应,现象为:钠浮在水面上,迅速地熔化为小球,在水面上四处游动,并发出嘶嘶响声,同时溶液中生成蓝色沉淀。
反应过程为:2Na+2H2O =2NaOH+H2↑、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;总反应为:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑。
3.保存:钠很容易跟空气中的氧气和水起反应,因此在实验室中,通常将钠保存在煤油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。



09钠及其化合物1.理清钠元素相关物质的性质2.记忆钠单质相关性质3.速记焰色反应中颜色4.突破过氧化钠相关方程式一、焰色反应定义:某些金属或其化合物在灼烧时使火焰呈现特殊颜色的现象,在化学上叫做焰色反应。
颜色:钠呈黄色;钾呈浅紫色(隔着蓝色钴玻璃观察,目的是滤去钠产生的黄色光,以免对K 的焰色检验造成干扰);铜呈绿色。
实验:焰色反应通常选用灼烧时没有特殊颜色的铂丝或光洁无锈的铁丝作载体,并选择稀盐酸作为洗涤液。
每次焰色反应操作后,都要用稀盐酸洗净金属丝。
用稀盐酸能洗净金属丝的原因是:生成金属氯化物,而金属氯化物在高温时可挥发。
焰色反应实验的操作步骤可归纳为:洗、烧、蘸、烧、观、洗、烧。
注意:铂丝不可用稀H2SO4(不挥发)或稀HNO3(易挥发、分解)洗净。
应用:焰色反应主要用于制造焰火、高压钠灯等,在化学实验上常用来鉴别物质元素(如钠,钾元素)二、钠单质高考真题及模拟题演练1.(2022·浙江·统考高考真题)下列说法不正确...的是A .晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维B .高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明C .氧化铝熔点高,常用于制造耐高温材料D .用石灰石-石膏法对燃煤烟气进行脱硫,同时可得到石膏2.(2022·全国·统考高考真题)生活中处处有化学,下列叙述正确的是 A .HB 铅笔芯的成分为二氧化铅 B .碳酸氢钠可做食品膨松剂 C .青铜和黄铜是不同结构的单质铜D .焰火中红色来源于钠盐灼烧3.(2021·海南·统考高考真题)一次性鉴别等浓度的3KNO 、4NH Cl 、23Na CO 三种溶液,下列方法不可行...的是 A .测定pH B .焰色试验C .滴加3AlCl 溶液D .滴加饱和()2Ca OH 溶液,微热4.(2022·重庆·统考高考真题)下列叙述正确的是 A .Cl 2和Br 2分别与Fe 2+反应得到Cl -和Br - B .Na 和Li 分别在O 2中燃烧得到Na 2O 和Li 2OC .1molSO 3与1molNO 2分别通入1L 水中可产生相同浓度的H 2SO 4和HNO 3D .0.1mol•L -1醋酸和0.1mol•L -1硼酸分别加入适量Na 2CO 3中均可得到CO 2和H 2O 5.(2022·浙江·统考高考真题)下列说法不正确...的是 A .灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化B .用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中C .将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清D .不能将实验室用剩的金属钠块放回原试剂瓶6.(2020·北京·高考真题)水与下列物质反应时,水表现出氧化性的是 A .NaB .Cl 2C .NO 2D .Na 2O7.(2020·浙江·高考真题)下列说法不正确...的是 A .高压钠灯可用于道路照明 B .2SiO 可用来制造光导纤维C .工业上可采用高温冶炼黄铜矿的方法获得粗铜D .3BaCO 不溶于水,可用作医疗上检查肠胃的钡餐A.A B.B C.C D.D 10.(2023·上海松江·统考二模)下列各组物质的转化关系不能..全部通过一步反应完成的是A.Na→NaOH→Na2CO3→NaCl B.Fe→FeCl3→Fe(OH)3→Fe2O3C.Al→Al2O3→Al(OH)3→AlCl3D.Mg→MgCl2→Mg(OH)2→MgSO4 11.(2023·上海金山·统考二模)下列物质在空气中久置会变质,变质过程不涉及氧化还原反应的物质是A.Na B.Na2O C.Na2O2D.Na2SO3三、钠的氧化物高考真题及模拟题演练A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4Cu+ZnSO4B.澄清的石灰水久置后出现白色固体Ca(OH)2+CO2CaCO3↓+H2OC.Na2O2在空气中放置后由淡黄色变为白色2Na2O22Na2O+O2↑D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl216.(2010·山东·高考真题)下列推断正确的是A.SiO2是酸性氧化物,能与NaOH溶液反应B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同C.CO、NO、NO2都是大气污染物气体,在空气中都能温室存在D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液显红色17.(2023·全国·模拟预测)化学实验必须树立安全意识。


