碳的化学性质
- 格式:doc
- 大小:45.00 KB
- 文档页数:3

碳的化学性质/view/abfc1c03a6c30c2259019ee1.html符号C,元素周期表中第6种元素,原子量12,它与其他元素结合形成有机化合物的大家族,碳元素在大气中主要以有机物未完全燃烧而形成的炭黑(soot)形式出现。
碳是一种非金属元素,位于元素周期表的第二周期IV A族。
拉丁语为Carbonium,意为“煤,木炭”。
汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
碳是生铁、熟铁和钢的成分之一。
碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。
生物体内大多数分子都含有碳元素。
碳是一种非金属元素,位于元素周期表的第二周期IV A族。
碳循环它的化学符号是C,它的原子序数是6,电子构型为[He]2s2 2p2。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
性状碳单质通常是无臭无味的固体。
单质碳的物理和化学性质取决于它的晶体结构,外观、密度、熔点等各自不同。
碳的单质已知以多种同素异形体的形式存在:1.石墨2.金刚石3.富勒烯(Fullerenes,也被称为巴基球)4.无定形碳(Amorphous,不是真的异形体,内部结构是石墨)5.碳纳米管(Carbon nanotube)6.蓝丝黛尔石(Lonsdaleite,与金刚石有相同的键型,但原子以六边形排列,也被称为六角金刚石)7.蜡石(Chaoite,石墨与陨石碰撞时产生,具有六边形图案的原子排列)8.汞黝矿结构(Schwarzite,由于有七边形的出现,六边形层被扭曲到“负曲率”鞍形中的假想结构)9.碳纤维(Filamentous carbon,小片堆成长链而形成的纤维)10.碳气凝胶(Carbon aerogels,密度极小的多孔结构,类似于熟知的硅气凝胶)11.碳纳米泡沫(Carbon nanofoam,蛛网状,有分形结构,密度是碳气凝胶的百分之一,有铁磁性)12.石墨烯最常见的两种单质是高硬度的金刚石和柔软滑腻的石墨,它们晶体结构和键型都不同。

碳的化学特性与官能团碳是化学元素周期表中的第六位元素,拥有丰富的化学性质与特性。
它的独特性质使得碳成为生物有机化合物的重要组成部分。
在有机化学中,官能团是由碳及其周围的原子所组成的一些特定的原子团,具有一定的化学活性和反应性。
1. 碳的化学特性碳具有四个价电子,能形成四个共价键。
这使得碳能够形成庞大的碳链和构建复杂的有机分子。
碳的价电子结构使得它能与其他原子(包括碳自身)形成共价键,从而形成不同类型的化学键,如单键、双键和三键。
另一个重要的碳的化学特性是其稳定性。
碳是一个非金属元素,具有较高的电负性,因此在化学反应中常处于较稳定的状态。
这使得碳能够在各种不同的环境条件下存在,并参与形成多种化合物。
2. 官能团的定义与分类官能团是指具有一定特定化学性质的原子团,由一个或多个原子构成,并影响有机分子的性质和反应性。
它们通常以一个或多个原子上的键合关系来定义。
官能团可根据其化学性质和结构进行分类。
以下是一些常见的官能团分类:2.1 羟基(-OH)羟基是指一个氧原子与氢原子通过共价键连接而成的官能团。
它常见于醇和酚类化合物,如甲醇(CH3OH)和苯酚(C6H5OH)。
羟基的存在赋予了醇类化合物水溶性和氢键形成的能力。
2.2 羰基(C=O)羰基是指一个碳原子与一个氧原子通过双键连接而成的官能团。
它常见于酮和醛类化合物,如丙酮(CH3COCH3)和乙醛(CH3CHO)。
羰基的存在赋予了酮和醛的特定化学性质,如氧化性和亲核性。
2.3 羧基(-COOH)羧基是指一个碳原子与一个羟基和一个羰基通过共价键连接而成的官能团。
它常见于羧酸类化合物,如乙酸(CH3COOH)。
羧基的存在赋予了羧酸的酸性和亲电性。
2.4 胺基(-NH2)胺基是指一个氮原子通过共价键连接至一个或多个氢原子的官能团。
它常见于胺类化合物,如甲胺(CH3NH2)。
胺基的存在赋予了胺类化合物碱性和亲电性。
除了以上所列的官能团外,还有许多其他常见的官能团,如硫醇基(-SH)、卤素基(-X,X为卤素原子,如氯或溴)等。

第二节单质碳的化学性质1. 碳与氧的化学反应在氧气的存在下,碳会发生燃烧反应,生成二氧化碳。
例如,将炭放在明火上,它会迅速燃烧,产生明亮的火焰。
燃烧反应的化学方程式如下:C + O2 → CO2这个反应是放热反应,释放大量的热能。
此外,碳还可以和氧气在高温环境下进行化学反应,生成一些气体和固体产物。
例如,碳和二氧化氧反应可以产生一氧化碳:2CO2 + C → 3CO这个反应是吸热反应,需要提供能量才能进行。
2. 碳与卤素的化学反应卤素指的是氟、氯、溴、碘和烷基卤素等元素。
碳和卤素可以在一定条件下进行化学反应,生成卤化烃。
例如,碳和氯气反应可以生成氯化甲烷:CH4 + Cl2 → CH3Cl + HCl这个反应需要高温和紫外线的刺激才能进行。
卤素和碳可以在有火焰的情况下直接反应,生成一种黑色的物质,叫做碳黑。
3. 碳与酸的化学反应碳和酸可以进行化学反应,生成一种气体,叫做二氧化碳。
例如,将碳酸钙和盐酸混合,会释放出二氧化碳气体:CaCO3 + 2HCl → CaCl2 + H2O + CO2这个反应是放热反应,并且会产生大量的气泡。
如果用酸处理煤,会释放出大量的二氧化碳气体。
4. 碳和碱的化学反应碱是一类化合物,具有碱性。
碳和碱可以进行化学反应,生成一种气体,叫做甲烷。
例如,将氢氧化钠和苯并芘混合,会产生甲烷气体:2NaOH + C12H8 → Na2CO3 + 2H2O + CH4这个反应是吸热反应,需要提供能量才能进行。
此外,碳也可以和碱金属发生电化学反应,生成化合物。
例如,碳和钠反应可以产生碳化钠:2C + 2Na → Na2C这个反应是放热反应,并且需要一定的温度才能进行。
5. 碳和其他元素的化学反应碳和其他元素也可以进行化学反应,生成不同的化合物。
例如,碳和氢气反应可以产生甲烷:C + 4H2 → CH4这个反应是放热反应,并且需要高温和高压才能进行。
碳和硫化钙混合,可以产生一种橙黄色的物质,叫做硫酸钙。

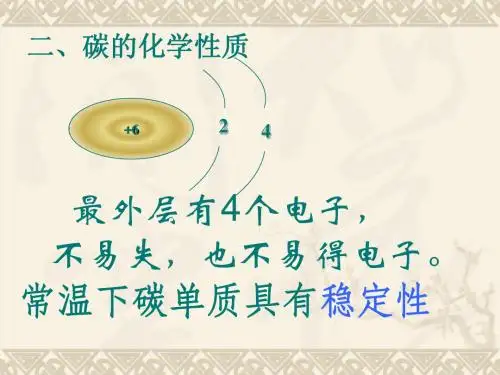
知识点一:碳的化学性质碳的几种常见单质物理性质不同,它们的化学性质是否也不同呢? 金刚石、石墨均由 构成,所以化学性质 。
1、常温下具有 性, 可用于 等。
原因是元素化学性质由 决定,碳的原子结构示意图为 ,最外层电子数为 ,需要 才能达到稳定结构,都不太容易,故碳单质在常温下具有稳定性。
例如古代书画历经千年不变色。
而随着温度的升高,碳在点燃或者高温的条件下,活动性大大增强。
2、 性, 可用做 。
①当氧气充足时,完全燃烧的化学方程式 ;②当氧气不充足时, 不完全燃烧的化学方程式 。
启示:①量变引起质变:反应物及条件相同时,生成物的种类跟 有关;②试管口略向下倾斜的原因是防止 ,使试管炸裂。
③该实验若用酒精灯做热源,需加网罩, 作用是 。
④实验结束后,先 , 目的是防止 ,使试管炸裂。
【讨论】反应结束后,试管内剩余红色固体为 ,待试管冷却后再把试管中的粉末倒到纸上,目的是防止 。
写出碳和其他物质反应的化学方程式:①焦炭还原氧化铁 ②碳与二氧化碳反应 ③水蒸气通过炽热的碳层知识点二:氧化还原反应以木炭还原氧化铜为例在该实验中,氧化铜(“得到”或“失去”)氧变成单质铜,这种含氧化合物里的氧被夺去的反应, 叫做 反应。
氧化铜做 剂,具有 性; 碳 在该实验中 (“得到”或“失去”)氧变成二氧化碳,发生 反应,碳做 剂,具有 性。
【小结】推质量守恒定律,氧原子不可能凭空产生,也不可能凭空消失,有物质得氧就一定有物质失氧,故得氧和失氧是同一个过程的不同方面。
②木炭燃烧时,应尽量提供充足的空气, 避免 。
3、 性, 可用于 。
①碳粉和氧化铜粉末需混合均匀的原因是 。
课题 2 制取 CO₂一、CO₂的实验室制法( )药品: ( 态)和 ( 色态)【知识拓展】实验室制取CO₂不选择“碳酸钠粉末” “稀硫酸” “浓盐酸”的原因:(1)不选碳酸钠粉末的原因:。
(2)不选稀硫酸: 。
(3)不选浓盐酸:。
(二)制取装置的选择1、发生装置的选择( 型)填写图中带有标号仪器的名称: a ,b 。

碳元素的结构和化学性质解析碳元素是地球上最丰富的元素之一,也是生命存在的基础。
它的结构和化学性质对于理解生命的起源和发展具有重要意义。
本文将从碳元素的结构、碳的同素异形体、碳的化学键以及碳的化学反应等方面进行解析。
一、碳元素的结构碳元素的原子序数为6,电子构型为1s²2s²2p²。
碳原子有四个价电子,可以形成四个共价键。
这使得碳元素能够与其他元素形成多种化合物,包括有机化合物和无机化合物。
二、碳的同素异形体碳元素存在多种同素异形体,其中最常见的是晶体结构的钻石和石墨。
钻石由碳原子通过共价键形成三维网状结构,每个碳原子与四个邻近的碳原子相连。
这种结构使得钻石具有极高的硬度和热导率。
而石墨则是由平面层状的碳原子通过共价键连接而成,每个碳原子与三个邻近的碳原子相连。
这种结构使得石墨具有良好的导电性和润滑性。
三、碳的化学键碳元素可以形成多种化学键,包括单键、双键和三键。
单键是最常见的碳化学键,由两个碳原子共享一个电子对形成。
双键由两个碳原子共享两个电子对形成,而三键则由两个碳原子共享三个电子对形成。
双键和三键使得碳化合物具有不同的性质和反应活性。
四、碳的化学反应碳元素可以与多种元素发生化学反应,形成各种化合物。
最常见的是碳与氧气反应形成二氧化碳,这是生物呼吸的过程中产生的废气。
碳还可以与氢气反应形成甲烷,这是一种常见的天然气。
此外,碳还可以与氮、硫等元素形成多种有机化合物,如氨基酸、硫醇等。
五、碳元素在生命中的重要性碳元素在生命中具有重要的地位。
生命体中的有机化合物都含有碳元素,包括蛋白质、核酸、脂质等。
这些有机化合物是构成生命体的基础,参与了生命体的各种生物过程。
碳元素的结构和化学性质决定了有机化合物的多样性和功能。
总结起来,碳元素的结构和化学性质对于理解生命的起源和发展具有重要意义。
碳的同素异形体、化学键和化学反应使得碳元素具有多样性和反应活性。
在生命中,碳元素是构成生命体的基础,参与了各种生物过程。

为什么地球上的生命大多以碳为基础?
地球上的生命大多以碳为基础的原因有几个方面:
碳的化学性质:碳是一种非常独特的元素,它有着丰富的化学性质,能够形成多种不同类型的化合物。
碳原子可以形成长链、分支链和环状结构,这使得碳能够构建多样性和复杂性极高的有机分子,包括蛋白质、脂肪、碳水化合物和核酸等生物大分子。
碳的丰富性:地球上的碳资源丰富,而且碳循环在地球大气、海洋和陆地之间发生,提供了持续的碳来源。
碳以多种形式存在,包括二氧化碳、碳酸盐、有机物等,这些形式提供了生命所需的碳原料。
水和有机化合物的相容性:水是地球上最常见的溶剂,而有机化合物通常在水中非常稳定。
碳原子能够与水形成稳定的化学键,这使得碳基生物能够在水中进行生存和生长。
地球环境条件:地球表面的温度、压力和化学条件对于碳化学反应是非常有利的。
这些条件使得碳能够在地球表面上形成稳定的有机分子,为生命的起源和进化提供了基础。
综上所述,碳作为生命的基础元素具有独特的化学性质、丰富的资源、与水相容性以及适合的地球环境条件,这些因素共同促成了地球上大多数生命以碳为基础的特点。

引言概述:碳是地球上最为丰富的元素之一,其化学性质对于理解有机化学以及生命起源具有重要意义。
在上一篇文章中,我们已经介绍了碳的基本化学性质,包括其原子结构和键合特性。
在本篇文章中,我们将继续探讨碳的化学性质,重点关注碳的共轭系统、氧化还原性质、酸碱性质、配位性质以及碳的催化性质等方面。
正文内容:一、碳的共轭系统1.共轭体系的定义和性质1.1共轭体系的结构特征1.2共轭体系的共享电子特性1.3共轭体系的光学和电学性质2.碳的共轭体系2.1芳香化合物的共轭体系2.2共轭二烯和多烯体系的化学性质2.3共轭聚合物的应用和性能优势二、碳的氧化还原性质1.氧化反应1.1碳的氧化反应机理和条件1.2碳的氧化反应的应用和工业价值2.还原反应2.1碳的还原反应的类型和条件2.2碳的还原反应的应用领域2.3碳的还原反应与生物体的关系三、碳的酸碱性质1.碳化合物的酸性1.1碳酸的酸碱性质及其反应机制1.2碳酸的酸碱反应的应用领域2.碳的碱性2.1碳的碱性物质和反应类型2.2碳化合物的碱性与催化作用四、碳的配位性质1.碳的配位键和配位化合物1.1碳的配位键结构和性质1.2碳的配位化合物的合成和应用2.碳配位化合物在有机金属化学中的作用2.1碳配位化合物的配位键类型和特点2.2碳配位化合物的应用和合成方法五、碳的催化性质1.碳的催化反应类型1.1碳催化剂的种类和应用1.2碳催化剂与反应机制的关系2.碳的催化剂的合成和改性方法2.1碳催化剂的制备方法和条件2.2碳催化剂的表面改性对催化性能的影响总结:通过对碳的化学性质的探讨,我们了解到碳作为有机化学的基础,具有丰富的化学性质,包括共轭系统、氧化还原性质、酸碱性质、配位性质以及催化性质等方面。
这些性质不仅对于有机化学的研究和合成有重要意义,还为生命起源和有机材料的开发提供了关键线索。
通过进一步的研究和应用,我们相信碳的化学性质将会为人类带来更多的惊喜和创新。


有关碳的知识
碳(Carbon)是一种非金属元素,化学符号为C,在常温下具有稳定性,不易反应、极低的对人体的毒性,甚至可以以石墨或活性炭的形式安全地摄取,位于元素周期表的第二周期IVA族。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳和生物之中。
拉丁语为Carbonium,意为“煤,木炭”。
碳元素结构多样,能够以具有多方面性质的单质形式存在,如晶形碳、无定形碳和过渡碳。
碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
碳还有多种同素异形体,如金刚石、石墨、石墨烯、富勒烯等,这些同素异形体广泛应用于航空、医疗、石油化工、国防等领域。

高中单质碳的化学性质知识点
高中单质碳的化学性质主要涉及以下几个方面的知识点:
1. 反应性:单质碳是一种非金属元素,它常常以固态石墨的形式存在。
石墨具有较高
的化学稳定性,不与大部分化学物质发生直接反应。
然而,高温下单质碳与氧气反应,生成二氧化碳,这是石墨的燃烧反应。
2. 氧化性:单质碳可以与氧气发生反应生成二氧化碳。
碳与氧气的反应通常需要较高
的温度,例如在空气中加热碳至800-1000°C以上时,就能发生燃烧反应。
3. 还原性:单质碳在高温下可以用作还原剂,可以与金属氧化物反应生成相应金属。
4. 与酸的反应:石墨会与浓硫酸反应生成二氧化硫和一氧化碳。
此外,浓硝酸和浓盐
酸对碳具有较强的氧化性。
5. 与碱的反应:单质碳在高温下可以与碱金属(如钾、钠)反应生成碱金属碳化物。
需要注意的是,单质碳的化学性质还包括与其他物质的反应,如与氢气、氮气、氯气
等的反应。
此外,炭与许多物质(如氢氟酸、氰化钠等)也可能引发反应,具体反应
性质视具体条件而定。
碳化学性质
碳为地球的第六大元素,构成着地球上的生命形态和环境结构。
它也是各种化学反应、工业生产及其他生物学过程中的重要物质。
因此,研究碳化学特性对于了解地球上的环境非常重要。
碳元素具有许多独特的性质,能够跟其它化学元素形成复杂的化合物。
碳与氫及硫结合,可形成碳水化合物,俗称烃;碳与氧及氟结合,可形成有机酸;碳与氟结合,可形成氟化物,俗称氟化碳;碳与硼结合,可形成碳的离子,称碳的离子化合物;碳与氮结合,可形成氮的碳酸根,称氮的离子化合物。
此外,碳还可以形成多种碳纳米管,如碳纳米管和碳纤维,这些产物具有良好的导电性能和力学性能,广泛用于航空航行器、电子器件等领域。
碳不仅具有上述的优异性质,还能长久存在。
一般碳的寿命很长,在地壳层中的存在往往超过几千万年。
这使得它在矿物结构中可以长久保持形状,并持续发挥其化学作用。
碳的化学特性极为复杂,使它是学习和研究的重要课题。
高等院校开设碳化学的课程,着重研究其与氮氧等元素及其离子化合物的形成及其结构性质、反应机理和催化作用等方面,以深入了解碳元素的性质,进而为地球上有机物质的形成、变化提供科学的知识支持。
总之,研究碳的化学性质对于了解地球上的有机变化,以及研究其它物质的化学性质具有重要意义。
高校应该加强对碳化学性质的研究,以开拓科学前沿、服务社会。
碳的物理化学性质推荐文章物理的教学手段有哪些热度:物理培优补差计划热度: 2017中考物理电功率复习提纲热度:高中物理学习方法有哪些热度:初中物理学习方法有哪些热度:碳是一种非金属元素,它以多种形式广泛存在于大气和地壳之中。
接下来店铺为你整理了碳的物理化学性质,一起来看看吧。
碳的物理性质同位素现代已知的同位素共有十五种,有碳8至碳22,其中碳12和碳13属稳定型,其余的均带放射性,当中碳14的半衰期长达5730年,其他的为稳定同位素。
在地球的自然界里,碳12在所有碳的含量占98.93%,碳13则有1.07%。
C的原子量取碳12、13两种同位素丰度加权的平均值,一般计算时取12.01。
碳12是国际单位制中定义摩尔的尺度,以12克碳12中含有的原子数为1摩尔。
碳14由于具有较长的半衰期,衰变方式为β衰变,碳14原子转变为氮原子且碳是有机物的元素之一,生物在生存的时候,由于需要呼吸,其体内的碳14含量大致不变,生物死去后会停止呼吸,此时体内的碳14开始减少。
人们可透过倾测一件古物的碳14含量,来估计它的大概年龄,这种方法称之为碳定年法。
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
同素异形体金刚石碳以无烟煤(一种煤炭类型),石墨和钻石的形式天然的存在,历史上更容易得到的是煤灰或木炭。
最终这些不同的材料被认为是由相同的元素形成的。
不惊奇的是,钻石是最难确认的。
来自佛罗伦萨(意大利)的博物学者Giuseppe Averani和医学工作者Cipriano Targioni首先发现了钻石是可以被加热摧毁的。
在1694年他们使用一个大型放大镜聚集阳光到钻石上,宝石最终消失了。
Pierre-Joseph Macquer和Godefroy de Villetaneuse在1771年重复了这个实验。
之后,在1796年,英国化学家Smithson Tennant展示其燃烧后生成的仅仅是CO2而最终证明了钻石只是碳的一种形式。
碳的化学名称碳的化学名称是“碳元素”,是地球上最常见的元素之一。
它在自然界中以不同形式存在,如钻石、石墨和石炭等。
碳的化学性质非常稳定,能够形成多种化合物,并广泛存在于有机物中。
碳元素的化学性质非常活泼,与其他元素形成多种化合物。
其中最常见的是与氧元素形成的氧化物,如二氧化碳(CO2)。
二氧化碳是一种无色、无味的气体,存在于空气中的微量。
它是地球上重要的温室气体之一,对维持地球的气候平衡起着重要作用。
碳元素还能与氢元素形成碳氢化合物,如甲烷(CH4)。
甲烷是一种无色、无味的气体,在自然界中广泛存在,如沼气和天然气中。
它是一种重要的燃料,被广泛用于家庭和工业领域。
除了与氧和氢元素形成的化合物,碳元素还能与其他元素形成多种化合物。
例如,与氮元素形成的化合物被称为氰化物,如氰化钠(NaCN)。
氰化物在工业上有多种用途,如金属提取和有机合成等。
碳元素还能形成无机盐,如碳酸钙(CaCO3)。
碳酸钙是一种白色固体,广泛存在于大自然中,如贝壳、珊瑚和石灰岩等。
它在建筑材料、医药和食品工业中有重要应用。
碳元素还能形成多种有机化合物。
有机化合物是由碳元素和氢元素以及其他元素组成的化合物。
它们是生命的基础,存在于所有生物体内。
有机化合物包括脂肪、蛋白质、糖类和核酸等,它们在生物体内扮演着重要的角色。
碳元素的化学性质使其在生活中有广泛应用。
例如,碳元素可以形成多种材料,如塑料、橡胶和纤维等。
这些材料在日常生活中被广泛使用,如塑料制品、橡胶制品和纺织品等。
碳元素还可以形成重要的药物和化妆品。
许多药物和化妆品的成分中都含有碳元素。
这些化合物具有独特的生理活性,能够对人体产生特定的作用。
碳元素作为地球上最常见的元素之一,具有丰富的化学性质。
它能够与许多元素形成多种化合物,包括无机化合物和有机化合物。
这些化合物在生活中有广泛应用,如温室气体、燃料、无机盐、有机化合物、材料和药物等。
碳元素的化学名称虽然简单,但它在化学世界中却有着重要的地位和作用。