初中化学区分软水硬水的实验
- 格式:docx
- 大小:810.34 KB
- 文档页数:2



区别软水和硬水的方法水是地球上最重要的资源之一,它被广泛地用于工业生产、农业灌溉以及城市生活等各种领域。
可是,大多数的水质不符合食用和工业应用的标准,因此,需要对水质进行处理。
水质的处理方式之一是分离软水和硬水,因此,如何区分软水和硬水是大家都感兴趣的话题。
本文将针对如何区分软水和硬水的方法进行介绍,以帮助读者更好地掌握和理解这个问题。
首先,我们需要了解什么是软水和硬水。
软水是指处理过电离离子交换(DI)过程的水,又称DI水,其中含有较少的离子,基本没有硬度矿物质,如硫酸根、氯离子等,因此耐洗性较好,用于食品加工和洗衣洗涤等行业更加安全,也有助于减少家用电器的维护厂的投入。
硬水是指含有硬度矿物质的水,如硫酸根、氯离子等,水质中的总离子浓度较高,容易形成结垢,洗衣效果差,对电器的腐蚀性也比较强,因此用于食品加工和洗衣洗涤等行业可能会带来安全隐患。
那么,如何区分软水和硬水呢?区分软水和硬水的方法有多种,其中最常见的是滴定法测定水中的硫酸根离子,以及采用蒸馏法去除硫酸根离子。
滴定法是一种化学检测方法,用于测定溶液中的硫酸根离子含量,即硬度矿物质的浓度。
此方法需要使用一种称为碱滴定剂的溶液,将水样取0.2毫升,加入滴定剂,反应到硬度矿物质完全滴定,滴定剂余量可以用来测定水中的硫酸根离子含量。
蒸馏法是处理水质的常用方法,可以去除硬度矿物质等有害物质。
具体实施过程是,将水置入蒸锅内,加热至沸点,当水变成蒸汽时,将蒸汽由蒸锅上部排出,在冷却时,蒸汽又变为液态,即去除了硬度矿物质等有害物质。
另外,还可以采用物理或化学方法,如精制过滤、逆渗透或离子交换等处理技术,对水质进行净化处理,以减少水中的硬度矿物质,生成更加清洁的软水。
总之,软水与硬水的区别是指软水含有更低的硬度矿物质,而硬水则含有更高的硬度矿物质。
为了保证水的质量,应采取有效的措施,如检测水质中的硬度矿物质浓度、蒸馏净水、电离离子交换去离子等,达到将软水与硬水做出区分的目的。

硬水和软水的区别怎么鉴别
硬水是溶有较多含钙、镁物质的水; 软水是溶有较少或不含钙、镁物质的水! 水的硬度是指水中钙、镁离子的浓度。
尽管一定硬度的水,能降低金属的毒性及心血管病的发生率,但是,居民饮用的水还需进行软化处理,以免让硬水带来不良后果。
硬水和软水的区别怎么鉴别
1什么是软水硬水
软水是指不含或含较少可溶性钙、镁化合物的水。
自然水中,雨水和雪水属软水。
常见的有蒸馏水。
硬水是指含有较多可溶性钙、镁化合物的水。
软水硬水的鉴别以及分布。
使用软水的益处和使用硬水的危害。
硬水软化,最简单的方法就是煮沸。
2软硬水的鉴别方法
1、分别用两只烧杯取等量水样,向两只烧杯中分别滴加等量肥皂水。
泡沫多、浮渣少的为软水。
反之,泡沫少、浮渣多的为硬水。
2、加热盛水烧杯,在杯壁留下较多水垢的是硬水。
因为硬水是含有
较多的可溶性钙、镁物质的水,加热后,这些可溶性的钙镁物质转化成不可溶性的物质。
沉淀杂质多的是硬水,杂质越多,水的硬度越大。
3、利用干燥的玻璃片。
分别在其不同的位置滴等量水样。
待其完全蒸发后,白色残留物多的为硬水,反之为软水。

区别软水和硬水的方法
软水和硬水是两种水质的分类,在日常生活中,有的地区的水质比较软,而有的地区的水质比较硬,因此,如果想要正确地区分软水和硬水,那么就需要了解它们之间的不同之处。
首先,要区分软水和硬水,可以首先观察它们之间的性质。
一般来说,软水的pH值较低,即较酸;而硬水中,大多数含有一定量的
离子,其pH值则较高。
此外,硬水中由于含有一定量的离子,所以
其发挥的肥料作用更好。
其次,要区分软水和硬水,还可以从其中的离子种类来判断。
一般来说,软水中含有较少的离子,而硬水中则含有大量的离子,其中主要包括Ca2+和Mg2+。
因此,可以根据含有的离子的多少来判断一
水的硬度。
此外,要区分软水和硬水,可以从它们的用途来辨别。
一般来说,软水适合用于洗衣服,烹饪等家庭生活用水,而硬水则适宜于工业用水,如用于清洗、锅炉加热等用途。
以上这些方法都可以用来区分软水和硬水。
了解它们之间的区别,在日常生活中有着重要的意义,可以帮助大家更好地使用和处理水,从而获得更多的方便和满足。
随着社会的发展,污染物对环境的侵害也越来越严重。
水资源的保护显得尤为重要,因此,有必要了解软水和硬水的不同之处,才能正确使用和处理水,保护环境和水源,从而为我们社会实现更健康、优质的生活水平奠定基础。
总之,软水和硬水是两种不同的水质,它们在日常生活中应用广泛;了解它们的区别,可以帮助大家正确地使用和处理水,保护环境和水源,从而为我们社会实现更健康、优质的生活水平奠定基础。

第2课时硬水与软水举世不师,故道益离。
柳宗元杭信一中何逸冬【新竹高于旧竹枝,全凭老干为扶持。
出自郑燮的《新竹》◆教学目标】1.知识与技能(1)知道硬水与软水的区别,并学会用肥皂水检验硬水与软水,初步了解硬水的危害及硬水的软化方法。
(2)了解蒸馏的基本操作技能。
2.过程与方法(1)通过对硬水危害的了解与认识,讨论交流,让学生了解硬水软化的必要性,并学会区分硬水和软水。
(2)通过对蒸馏实验的了解与认识,让学生明白蒸馏是四种净水方法中净化程度最高的。
3.情感、态度与价值观(1)通过水的软化处理,懂得卫生健康饮水和节约用水,体会化学在实际生活中的广泛应用。
(2)通过探究活动(蒸馏),培养学生科学探索精神。
【教学重点】1.硬水与软水的区别2.蒸馏的净水方法【教学难点】知道硬水与软水的区别【教学准备】多媒体课件、水样(河水、自来水、蒸馏水)、肥皂水、火柴、制取蒸馏水装置一套等。
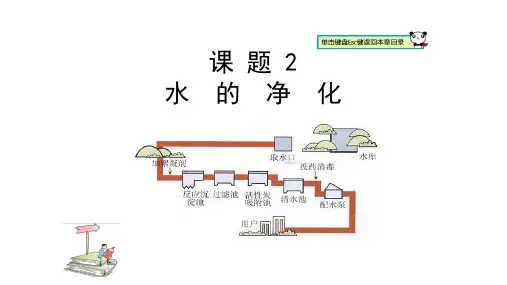
一、导入新课[提问]上节课我们学习了沉淀、过滤、吸附等净水方法,那么经过上述处理的水,澄清透明,比较洁净,是不是纯净物?为什么?二、推进新课1.硬水和软水[讲解]经过除颜色和异味的水,里面还会含有其它的一些可溶物,比方说钙镁化合物,而含有较多可溶性钙、镁化合物的水我们称为硬水,不含或含较少可溶性钙、镁化合物的水我们称为软水。
[小结]硬水:含有较多可溶性钙、镁化合物的水。
软水:不含或含有较少可溶性钙、镁化合物的水。
[提问]我们要如何区分硬水和软水呢?[演示]在硬水和软水中分别加入等量的肥皂水,让学生观察实验现象。
[回答][小结]硬水和软水的检验方法:将等量的肥皂水分别滴加到盛有等量的软水和硬水的试管中,搅拌,观察两试管中产生泡沫的情况,产生丰富泡沫的是软水,泡沫很少或不起泡沫,易起浮渣的是硬水。
[提问]硬水给生活和生产带来了哪些危害?[指导阅读]教材P76内容[讲解]其实硬水的危害还远远不止这些,比如长期饮用硬度很高的水,人体健康也会受到影响,它可引起消化道功能紊乱。

硬水和软水的区别有哪些如何鉴别"硬水"是指含有较多、可溶性、钙镁化合物的水。
如,自然界中的泉水、井水等。
“软水”指的是不含或含较少可溶性钙、镁化合物的水。
如,自然界中的雪水、雨水都是软水。
一般来说硬度小于150mg/L的水称为“软水”;硬度大于150 mg/L的水称为“硬水”。
硬水和软水的区别硬水和软水的区别1、水的物质含量不一样:软水不含或含较少可溶性钙、镁化合物,硬水含有较多可溶性钙镁化合物。
2、软水不易与肥皂产生皂垢,而硬水相反。
硬水并不对健康造成直接危害,但是会给生活带来很多麻烦,比如用水器具上结水垢、肥皂和清洁剂的洗涤效率减低等。
利用这点可以区分硬水和软水。
3、硬水可以经过处理转化为软水,经软化处理的硬水指钙盐和镁盐含量降为 1.0~50 毫克/升后得到的软化水。
用直流电源作动力,使水中的离子选择性地透过离子交换膜而获得软水。
4、通常我们所说的"硬水"与"软水",主要是指碳酸钙和碳酸镁的含量,以“毫克碳酸钙/公升水”或“ppm”来表示,称为水的硬度。
硬水和软水的鉴别方法方法1:取一杯热水,倒入肥皂水,轻轻搅拌。
水面上出现泡沫的为软水,水面上出现浮渣的为硬水,浮渣越多,水的硬度越大。
方法2:用烧杯加热,在杯壁留下较多水垢的是硬水。
因为硬水是含有较多的可溶性钙,镁物质的水,加热后,这些可溶性的钙镁物质转化成不可溶性的物质,沉淀杂质多的是硬水,杂质越多,水的硬度越大。
方法3:用两块干燥、干净的毛巾,分别沾上硬水和软水,拧干后擦拭镜片,晾干后观察镜片上水渍的为硬水,镜片上没有水渍,明亮如新的软水。
方法4:分别用软水和硬水制成冰块,由于碳酸钙、碳酸镁不溶于水,可以观察到用硬水制成冰块颜色混浊,有异味,软水制成的冰块晶莹剔透,手感软滑。

区分硬水和软水的方法是
如何区分硬水和软水
硬水和软水是两种质量不同的水,了解它们的特点可以帮助我们正确使用它们。
那么,如何区分硬水和软水呢?
首先,硬水是指含有大量矿物质的水,其中主要是钙和镁离子,这些离子对洗衣服、洗澡和清洗厨房设备等有害。
而软水则是指经过处理,含有很少矿物质的水,可以有效减少清洁时所需要的清洁剂以及保护水器室内的洁净度。
其次,我们可以通过比较两种水的味道来区分硬水和软水。
硬水的味道比软水更重,而软水的味道比较淡,清淡。
最后,我们可以通过比较这两种水的沉淀物来区分硬水和软水。
硬水中含有大量沉淀物,而软水中只含有很少量的沉淀物,甚至可以看不到。
总之,要区分硬水和软水,可以通过比较它们的矿物质含量、味道和沉淀物的多少来判断。
硬水含有大量矿物质,其味道更重,而软水则含有很少的矿物质,味道比较淡,沉淀物也很少。
只有了解这些特征,才能正确使用硬水和软水。

硬水和软水可以用肥皂水区分的原理。
答:因为肥皂的成分是硬脂酸钠(C17H35COONa),在水中硬脂酸钠被水电离,形成硬脂酸根离子和钠离子。
而一般硬水中存在大量的钙离子和镁离子,而硬脂酸根离子会和镁离子和钙离子结合生成硬脂酸镁和硬脂酸钙,硬脂酸钙和硬脂酸镁都是不溶于水的沉淀,因此,如果是将肥皂投入到硬水中,会出现有沉淀的现象。
而软水中是不存在或存在微量的镁离子和钙离子,因此,如果是将肥皂投入到软水中,是不会出现有沉淀的现象,水是纯净透明的。
其实,除了钙、镁离子外,肥皂亦能被铁、锰、锌、铜…等离子所沉淀,所以在化学上乃定义:凡是水体存在能被肥皂产生沉淀的矿物质离子,都称为硬度离子。
由此可知,硬度是指所有硬度离子总浓度的指针值而言。
不过在一般的自然水(包括自来水)中,除了钙、镁离子外,其余硬度离子之存量很少,因此水之硬度可以说是水中钙和镁离子之浓度所代表之综合特性而已。

案例采撷初中化学“水的净化”的项目式教学课例———以“硬水、软水与健康饮水”项目为例文|谢娜辉初中化学是项目式教学融合探究的最主要学科之一,因为初中化学与实际生活结合较多,在化学学科的项目式教学过程中,能帮助学生理解生活中的化学实例,使其更深入地学习化学学科中的理论知识。
本文以“硬水、软水与健康饮水”为例,探究初中化学项目式教学的应用实践。
一、项目可行性分析项目式教学的可行性分析主要分为三个方面的内容,一是项目目标设定需要基于课本内容,而且研究内容需要具备现实意义。
二是要注重以学生为中心,素质教育要求教师在设计项目流程时要充分发挥学生的主动性,让学生自觉提出问题并寻求答案,培养学生发现问题和解决问题的能力。
三是项目式教学作为近几年兴起的概念,主要是为了解决教学与实际脱离所产生的问题,因此项目式教学要注重实践与理论相结合。
“硬水、软水与健康饮水”是《义务教育化学课程标准(2022年版)》“物质的性质与应用”章节下第四单元“自然界的水”和第十二单元课题2“化学元素与人体健康”相结合的项目,能融合不同章节内容进行项目式教学,也是本项目的创新点之一。
在传统的理论教学过程中,其实完成大纲教学并不难,但是想要在传递知识的同时让学生提升自身素养还是很困难的。
化学学科与平常生活息息相关,很多日常现象都可以与化学知识结合起来,“硬水、软水与健康饮水”项目的教学不仅完成了教学内容中核心概念和重点知识的学习,还与实际生活紧密相连,真正实现了“做中学”“创中学”、在真实情境中学的理念。
在“硬水、软水与健康饮水”项目的教学环节中,非常注重学生能力的培养,不仅让学生更直观、更深刻地学习了硬水和软水的区别,还锻炼了学生的团体合作、资料搜集、沟通能力等。
最后加入健康饮水的概念和方式,让学生能拓展学科以外的知识,同时为社会健康发展作出贡献。
二、项目教学目标“硬水、软水与健康饮水”项目式教学的目标设计主要分为课程标准和课时目标两个维度。
软水硬水的区分原理
软水和硬水的区分原理主要是由于水中溶解的钙离子和镁离子的含量不同。
软水中的钙离子和镁离子含量较低,而硬水中的钙离子和镁离子含量较高。
软水通常是经过去除了大部分钙和镁离子的处理方法得到的,比如通过离子交换或反渗透等技术去除水中的钙和镁离子。
硬水相比软水含有更多的钙和镁离子,通常是由于地下水或井水与岩石中的钙镁化合物接触而溶解而来。
硬水在与肥皂等表面活性剂反应时,会产生沉淀物,使得清洁效果不佳,而且还会在管道和家电设备中产生水垢堵塞。
因此,软水对于家庭用水、工业用水和农业灌溉等方面都有很大的好处。
中考化学知识点:硬水与软水中考化学知识点:硬水与软水硬水中因溶有较多的可溶性钙、镁化合物,给我们的生活、生产带来许多麻烦.大部分地区的地下水主要含有Ca(HCO3)2、Mg(HCO3)2等物质,可通过加热的方法进行软化.有些地区的地下水因含有CaCl2、MgCl2,简单的加热方法不能将其软化,可加入过量Ca(OH)2、Na2CO3的将水的Ca2+、Mg2+转变成CaCO3、Mg(OH)2沉淀,从而达到软化的目的.若使这种方法,你认为应先加入Ca(OH)2后加Na2CO3,其中,除Mg2+时发生的化学反应为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2(化学方程式表示).由于去除Ca2+、Mg2+时加入了过量Ca(OH)2、Na2CO3,使软化后的水具有较强的碱性,使用前需用盐酸调整水的酸碱度,以除去水中残存的Na2CO3、NaOH.考点:硬水与软水;物质除杂或净化的探究;书写化学方程式、文字表达式、电离方程式.专题:结合课本知识的信息;压轴实验题.分析:在含有CaCl2、MgCl2的水中可加入过量Ca(OH)2、Na2CO3的将水的Ca2+、Mg2+转变成CaCO3、Mg(OH)2沉淀,要注意过量的Ca(OH)2、Na2CO3的除去问题,如先加碳酸钠,再加氢氧化钙,最后用盐酸调节水的酸碱度时,又会生成氯化钙,无法除去硬水中较多的可溶性钙的化合物.解答:解:除去水中的CaCl2、MgCl2时,如先加碳酸钠,再加氢氧化钙,最后水中含有过量的氢氧化钙,用盐酸调节水的酸碱度时,又会生成氯化钙,无法除去硬水中较多的可溶性钙的化合物,所以应先加Ca(OH)2,然后加Na2CO3,一方面除去氯化钙,又除去过量的氢氧化钙,最后再用盐酸除去过量的Na2CO3、NaOH,涉及到的方程式有:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2、CaCl2+Na2CO3=2NaCl+CaCO3↓、Na2CO3+Ca(OH)2=2NaOH+CaCO3↓、2HCl+Na2CO3=2NaCl+CO2↑+H2O、HCl+NaOH=NaCl+H2O.故答案为:Ca(OH)2;Na2CO3;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;Na2CO3、NaOH.点评:水是人类宝贵的自然资源,与水相关的化学知识是化学考查热点之一,如水的组成及水电解实验、性质、用途、硬水和软水、节约水资源、水污染及防治等内容,在中考中出现机率很高;掌握复分解反应发生的条件和钙、镁化合物的性质是解题关键.。
初中化学区分软水硬水的实验
硬水和软水:
(1)硬水:含有可溶性钙、镁化合物较多的水;软水:含有可溶性钙、镁化合物较少的水
(2)判断方法:加入肥皂水搅拌,产生泡沫多的为软水,反之为硬水。
(3)转化方法:煮沸、蒸馏等
(4)硬水的危害:用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长还会使衣物变硬。
锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重者可引起爆炸。
长期饮用硬水有害身体健康。
实验结论:
①水在通电的条件下分解成氢气和氧气。
化学反应为:2H2O通电2H2↑+O2↑
②水是由氢元素和氧元素组成的。
5、反应的微观过程:
由电解水微观过程可知:
①化学反应的实质是:分子分解成原子,原子又重新结合成新的分子。
②分子与原子的关系:分子是由原子构成的,即分子可以分解成原子,原子可以结合成分子。
③在化学反应中,分子可以分解成原子,而原子不可再分。
④化学反应前后,发生改变的是分子的种类;化学反应前后,元
素的种类,原子的种类、数目、质量都不变。
6、注意事项:
①为了增强水的导电性,常在水中加入少量的氢氧化钠溶液或稀硫酸。
②现象要点:“正氧负氢”—争养父亲;“氢二氧一”—V氢气:V氧气=2:1。
描述体积比时要注意比例顺序。
③在实验中,氢气与氧气的体积比略大于2:1。
主要原因是:
a.由于氢气与氧气在水中的溶解度不同,在相同条件下,氧气在水中的溶解度比氢气大;
b.在电解水过程中会有副反应发生,消耗了氧气,使氧气的体积比理论值低。
初中化学区分软水硬水的实验
黄通文2016年11月24日
实验步骤:1、用小刀刮下肥皂碎屑,烧杯中加入自来水即可。
用玻璃棒搅拌,调制肥皂水。
2、准备好硬水软水。
软水用自来水即可。
硬水,可在自来水中加入泥土,再加入氯化钙,搅拌均匀,装入瓶中备用。
图中一支软水,一支硬水。
3、分别用滴管加入肥皂水,效果显著:肥皂水加入软水中,只有乳白色呈现,而硬水中有大量白色泡沫出现。
4、再将两只试管摇匀,软水只是乳白色,而硬水中悬浮大量泡沫,水没有多大变化。