04第四章 重排反应
- 格式:ppt
- 大小:1.71 MB
- 文档页数:73

重排反应有机化学中重排反应很早就被⼈们发现,研究并加以利⽤。
第⼀次被Wohler 发现的,由⽆机化合物合成有机化合物,从⽽掀开有机化学神秘⾯纱的反应—加热氰酸铵⽽得到尿素,今天也被化学家归⼊重排反应的范畴。
⼀般地,在进攻试剂作⽤或者介质的影响下,有机分⼦发⽣原⼦或原⼦团的转移和电⼦云密度重新分布,或者重键位置改变,环的扩⼤或缩⼩,碳架发⽣了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、⾃由基反应和周环反应四⼤类。
也有按照不同的标准,分成分⼦内重排和分⼦间重排,光学活性改变和不改变的重排反应,等等。
⼀、亲核重排重排反应中以亲核重排为最多,⽽亲核重排中⼜以1,2重排为最常见。
(⼀)亲核1,2重排的⼀般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发⽣亲核1,2重排的条件(1)转变成更稳定的正离⼦(在⾮环系统中,有时也从较稳定的离⼦重排成较不稳定的离⼦)(2)转变成稳定的中性化合物(3)减⼩基团间的拥挤程度,减⼩环的张⼒等⽴体因素。
(4)进⾏重排的⽴体化学条件:带正电荷碳的空p轨道和相邻的C-Z 键以及α碳和β碳应共平⾯或接近共平⾯(5)重排产物在产物中所占的⽐例不仅和正电荷的结果有关,⽽且和反应介质中存在的亲核试剂的亲核能⼒有关3.迁移基团的迁移能⼒(1)多由试验⽅法来确定基团的固有迁移能⼒(2)与迁移后正离⼦的稳定性有关(3)邻位协助作⽤(4)⽴体因素4.亲核1,2重排的⽴体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进⾏迁移的相对时机5.记忆效应:后⼀次重排好像和第⼀次重排有关,中间体似乎记住了前⼀次重排过程(⼆) 亲核重排主要包括基团向碳正离⼦迁移,基团向羰基碳原⼦迁移,基团向碳烯碳原⼦迁移,基团向缺电⼦氮原⼦转移,基团向缺电氧原⼦的迁移,芳⾹族亲核重排,下⾯就这六种迁移作简要介绍:1.基团向碳正离⼦迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)⽚那醇重排:邻⼆醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)⼆烯酮-酚重排:4,4-⼆取代环⼰⼆烯酮经酸处理重排成3,4-⼆取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作⽤⽣成⾼⼀级的同系物(6)烯丙基重排:烯丙基系统中双键发⽣位移的反应2.基团向羰基碳原⼦迁移:(1) Benzil-Benzilic Acid重排:α-⼆酮经强碱处理会发⽣重排,⽣成α-羟基⼄酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另⼀种酮3.基团向碳烯碳原⼦迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成⾼⼀级同系物的⽅法(2) 其他的碳烯重排反应,主要是1,2氢迁移⽣成烯4.基团向缺电⼦氮原⼦转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上⽆取代基酰胺经溴及碱处理,脱羰⽣成伯胺(3)Curtius重排:酰基叠氮热分解⽣成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,⽣成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍⽣物经类似Hoffmann的重排⽣成少⼀个碳的胺(6)Neber重排:肟酮的磺酸酯在⼄醇钾处理后⽔解⽣成α-氨基酮5.基团向缺电氧原⼦的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原⼦迁移到氧原⼦上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作⽤,在分⼦中插⼊氧⽣成酯的反应6.芳⾹族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺⼆、⾃由基重排反应1.1,2迁移:⽐正离⼦重排反应少得多,主要发⽣在:(1)某些双⾃由基的1,2-烷基和氢(2)烯基(迁移的⼄烯基若是环的⼀部分,则发⽣重排)2.⾮1,2迁移:多发⽣1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质⼦化N-卤化胺经热分解或光解形成六氢吡啶等的反应。



有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质子化N-卤化胺经热分解或光解形成六氢吡啶等的反应。


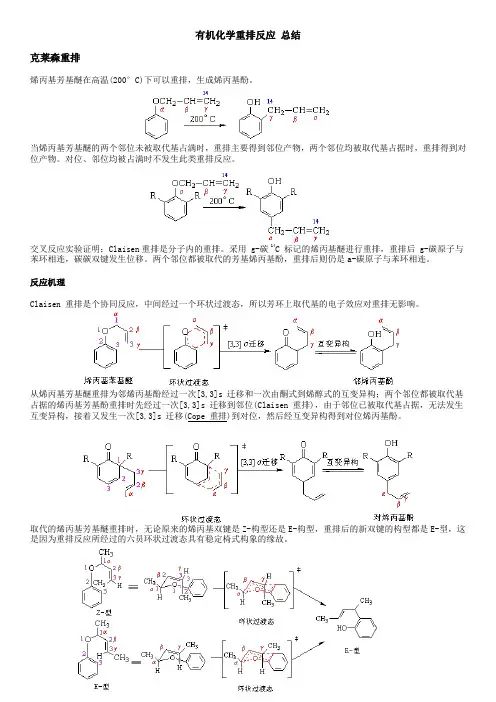
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。


重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。

有机化学基础知识点有机物的重排反应和合成反应有机化学是研究碳及其化合物的科学,其中有机物的重排反应和合成反应是基础知识点之一。
本文将介绍有机物的重排反应和合成反应的定义、机理以及实际应用。
一、有机物的重排反应有机物的重排反应是指有机分子内部的原子或基团的重排重新组合,从而得到不同的同分异构体的化学反应。
1. 酯的重排反应酯的重排反应是在酯分子内部发生酯基重组的过程。
常见的酯重排反应是酯的酰迁移反应,即酯中的酯基与另一官能团发生借位反应,形成新的酯。
例如,乙酸正丁酯在催化剂存在下发生酰迁移反应,生成异丁酸正丁酯。
2. 烯烃的重排反应烯烃的重排反应是指烯烃分子内部碳链重排的反应。
常见的烯烃重排反应有烯烃的烯重排、烯烃的环重排等。
烯烃的烯重排反应是指分子中的双键位置发生移位,产生不同位置的同分异构体。
例如,2-戊烯经过烯重排反应,生成3-戊烯。
3. 羟酮的重排反应羟酮的重排反应是指碳链上羟基和酮基位置的重排反应。
常见的羟酮重排反应有羟酮的酮迁移反应。
例如,2-丁酮二氨基萘酚经过酮迁移反应,生成3-丁酮二氨基萘酚。
以上是有机物的重排反应的几个典型例子。
有机物的重排反应可以通过改变分子内部原子或基团的排列方式,产生不同结构的化合物,进而影响其物化性质和功能。
二、有机物的合成反应有机物的合成反应是指通过化学反应,从原料中合成目标有机物的过程。
1. 氢化反应氢化反应是将烯烃或芳香化合物中的双键或芳香环上的不饱和键与氢气加成生成饱和键的反应。
常见的氢化反应有烯烃的氢化、芳香化合物的加氢反应等。
例如,乙烯经过氢化反应,生成乙烷。
2. 酯化反应酯化反应是酸与醇或酚反应生成酯的过程。
常见的酯化反应有酸醇酯化反应、酸酚酯化反应等。
例如,乙酸与乙醇经过酯化反应,生成乙酸乙酯。
3. 羟基化反应羟基化反应是指在有机分子中引入羟基的化学反应。
常见的羟基化反应有烯醇的氢化反应、酮的羟醇化反应等。
例如,丙烯经过氢化反应,生成1-丙醇。

重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程。
以下例子中取代基R由碳原子1移动至碳原子2:分子间重排反应也有可能发生。
按反应机理,重排反应可分为:基团迁移重排反应和周环反应。
基团迁移重排反应反应物分子中的一个基团在分子范围内从某位臵迁移到另一位臵的反应。
常见的迁移基团是烃基。
迁移基团的原来位臵称为迁移起点,迁移后的位臵称为迁移终点,这类反应又可按价键断裂方式分为异裂和均裂,前者重要得多,其中尤以缺电子重排最为重要。
缺电子重排反应是反应物分子先在迁移终点形成一个缺电子活性中心,从而促使迁移基团带着键裂的电子对发生迁移,并通过进一步变化生成稳定产物。
以频哪酮重排反应为例,反应物分子中的一个羟基与酸作用形成锌盐后失水变为缺电子活性中心正碳离子,促使邻位带羟基碳原子上的一个甲基带着电子对发生1,2-迁移,同时羟基氧原子上未共用电子对转移至碳?氧之间构成双键,最后失去质子而得产物(见上反应式)。
在迁移终点形成一个富电子活性中心后,促使迁移基团不带键裂电子对而转移,叫富电子重排反应,例如法沃斯基重排:a - 卤代酮在强碱作用下重排,生成碳架不同的羟酸酯,反应通过富电子活性中心负碳离子进行:环反应反应物因分子内共价键协同变化而发生重排Favorsky重排反应的反应,有电环化反应和δ迁移反应。
例如环丁烯经加热发生逆向电环化而得1,3-丁二烯,1,3-己二烯经加热发生氢原子1,5-迁移而得2,4-己二烯。
这类重排在合成中应用最多的是属于3,3-迁移的科普重排和克莱森重排。
科普重排是1,5-二烯受热重排为另一个1,5-二烯的反应。
例如内消旋-3,4-二甲基-1,5-己二烯经加热几乎定量地转变为(Z ,E)-2,6-辛二烯:克莱森重排反应是参与反应的体系中有一个氧原子代替了碳原子。
重排反应重排反应范围较广,引起重排反应的因素也很多。
一般情况下都是分子受试剂作用后,暂时产生一个不稳定中心,这个不稳定中心经分子内某些基团的迁移和调正,趋向较稳定的形式,这样便发生了重排反应。
从形成不稳定中心的性质看大体克将重排反应分为四类:缺电子体系重排,即某些基团向缺电子中心迁移;失电子体系重排,即某些基团向失电子中心迁移;丙烯型重排;向芳核的迁移性重排 其中以缺电子体系的重排最为重要一.缺电子体系重排反应 缺电子体系重排都包含着一个基团从碳原子上转移到仅有六个价电子的邻近原子上的重排如,由于这类重排反应,是分子中一个原子灰基团向相邻原子上的转移,故又称1,2-转移重排反应 二.频呐醇重排一个偶尔用于酮的合成的反应,它作为产物确实能生成羰基化合物,频哪醇用无机酸处理时,转变成甲基叔丁基酮。
先失去水生成正碳离子,正碳离子重排产生质子化的酮。
(芳基比烷基有较大的迁移能力)2,3-二甲基-2,3-丁二醇用30%的热硫酸处理,就可以重排成3,3-二甲基-2-丁酮。
CH3CH3CH3OH OHCH3C C CH3CH3OCH3C C CH3H2O30%H2SO4反应机理是:首先在质子的进攻下,形成正碳离子的不稳定中心,从而引起分子中烷基的转移,然后失去一个质子完成重排。
上述重排中,正碳离子的形成是关键的一步,反应过程中,如能生成类似正碳离子者,都能发生此类重排,例如用硝酸银处理3-溴-2,3-二甲基-2-丁醇。
某些不对称的邻二醇在酸的处理下,也能发生呐侉重排如果邻二醇的取代基R 不同时,一般多是失电子的基团发生转移,因失电子基具有更大的亲核能力。
不对称的醇也能发生重排,只是正碳离子有它的几个中最稳定的一个形式。
C CRR R HOHCC R RR H OH III 注意:因为二式比一式稳定,故不生成一式。
二.瓦格涅尔、麦尔外英重排CH3CH3CH3CH3C C CH3CH3OCH3C C CH330%H2SO4OH Br有些醇类,尤其是b-碳原子上连有2~3个烃基的醇类,遇酸不仅生成正常的取代或消除产物,还往往伴有碳架的重排。