Hofmann重排反应
- 格式:doc
- 大小:30.50 KB
- 文档页数:2


有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
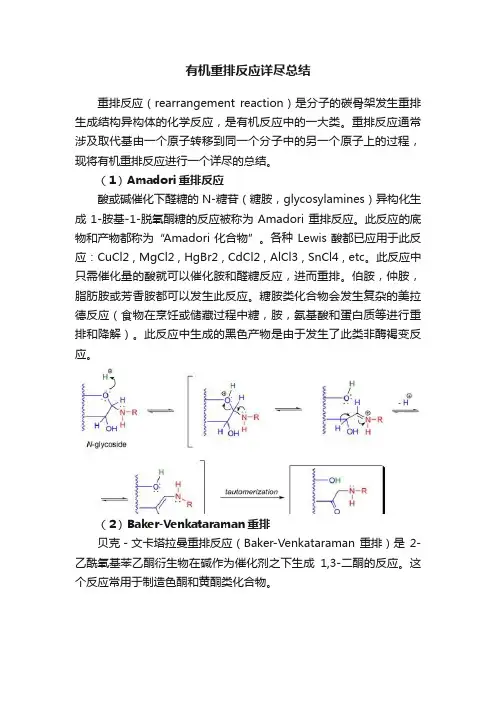
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
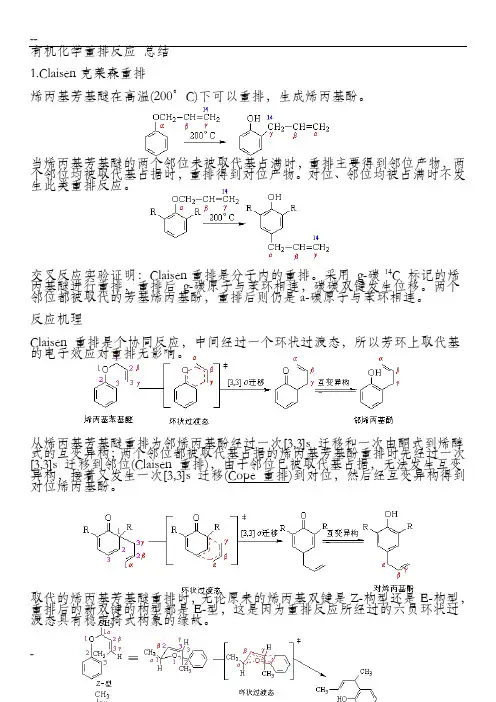
--有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。

hoffmann重排反应Hoffmann重排反应是有机化学中一种重要的反应类型,它可以将一个酮或醛转化为一个脱氢胺。
这个反应以其高效、高选择性和广泛适用性而受到广泛关注。
Hoffmann重排反应的机理是通过一个中间体的形成来实现的。
首先,酮或醛通过与氯胺反应生成一个胺盐。
然后,在碱的作用下,胺盐经过一个脱氢胺中间体的形成,失去一个氮气分子,并形成一个新的胺。
最后,通过水解,我们可以得到最终的产物。
Hoffmann重排反应的一个重要应用是在药物合成中。
例如,我们可以使用该反应将酮转化为相应的胺。
这对于合成药物分子中的特定官能团是非常有用的。
此外,这个反应还可以用于合成天然产物和农药等有机化合物。
除了药物合成,Hoffmann重排反应还可以应用于合成聚合物。
例如,通过该反应,我们可以将酮或醛单体转化为含有胺官能团的聚合物。
这种聚合物具有许多重要的性质,如生物相容性、溶解性和稳定性,因此在材料科学领域有着广泛的应用。
除了在有机合成和材料科学中的应用之外,Hoffmann重排反应还在环境保护领域发挥着重要作用。
在这个领域,该反应被用来处理含有酮或醛的废水。
通过将这些有机物转化为无害的胺类化合物,可以有效地减少对环境的污染。
尽管Hoffmann重排反应具有许多优点,但也存在一些限制。
首先,该反应对底物的选择性有一定的要求。
只有那些具有活泼氢原子的酮或醛才能有效地进行反应。
其次,反应条件通常要求高温和碱性条件,这可能会导致一些副反应的发生。
因此,在实际应用中,需要仔细选择反应条件以获得最佳的反应结果。
Hoffmann重排反应作为一种重要的有机合成方法,已经在许多领域取得了广泛的应用。
它不仅在药物合成和材料科学中发挥着重要作用,还在环境保护中发挥着积极的作用。
随着对于新型催化剂和反应条件的研究不断深入,相信Hoffmann重排反应将会在未来得到更广泛的应用和发展。
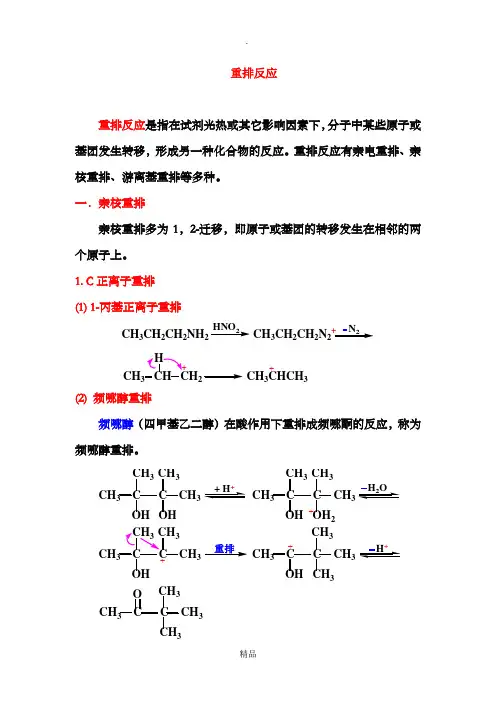
重排反应重排反应是指在试剂光热或其它影响因素下,分子中某些原子或基团发生转移,形成另一种化合物的反应。
重排反应有亲电重排、亲核重排、游离基重排等多种。
一.亲核重排亲核重排多为1,2-迁移,即原子或基团的转移发生在相邻的两个原子上。
1. C 正离子重排 (1) 1-丙基正离子重排CH 3 CH CH 2 CH 3CHCH 3CH 3CH 2CH 2NH 2 CH 3CH 2CH 2N 2+HHNO 2N 2+(2) 频哪醇重排频哪醇(四甲基乙二醇)在酸作用下重排成频哪酮的反应,称为频哪醇重排。
CH 3 C C CH 3CH 3OH CH 3OH CH 3C C CH 3CH 3OH CH 3 C C CH 3CH 3OH CH3CH 3 C C CH 3CH 3OH CH 3OH 2+++CH 3 C C CH 3CH 3OCH 3重排注意:频哪醇重排中重基团次序为:CHH>>>>>CH>烷基>(3) Wagner-Meerwein重排-取代醇(R3CCH2OH, R3CCHR', R2CHCHR'OHOH)脱水或用试剂(为HX、PCl5、SOCl2等)处理时,或卤化氢加成到多环烯及多环卤代物消除卤化氢等,常常发生C架的重排,称Wagner-Meerwein重排。
CH3 CH C CH3CH3OH CH3CH3 CH C CH3CH3CH 3OH2+CH3 CH C CH33CH3CH3CH3+重排CH3 C C CH3CH3CH3CH3 CH C CH3ClCH 3CH 3CH 3H + H CH 3CH 3CH 33+重排CH 3CH 3CH 3+ Cl四元环变五元环CH 3H 3CCH 3Cl下列反应亦是Wagner-Meerwein 重排:CH 3 C CH 2BrCH3CH 3OH+CH 3 C CH 2CH 3CH 3++重排CH 3 C CH 2CH 3CH 3H CH 3 C CHCH 3CH 3+ H 2O/ H +CH 3 C CH 2CH 3CH 3CH 3 C CH 2NH 2CH 3ROHCH 3 C CH 2CH 3R ++重排CH 3 C CH 2RCH 3CH 3 C CH RCH 3+ H 2O/ H +CH 3 C CH 2RCH 3HNO 2注意:① 若R 为苯基,则反应经过如下中间产物:+CH 3 C CH 2NH 2CH 3CH 3 C CH 2N 2CH 3+重排HNO 2CH 3 C CH 2CH 3+CH 3CH 3 C CH② 若R 为乙烯基,同样经过环丙烯中间体:+CCC+CC+C C12CH 3CH CH +++HO CN HCNHOCH 2NH 22HNO 2OH2. 缺电子氮(氮宾)重排 (1) 霍夫曼重排(Hofmann 重排)即酰胺在碱性溶液中与Cl 2 或Br 2作用下得到少一个C 原子的胺的反应(也称Hofmann 降解反应)。


![异氰酸酯中间态的重排反应[研究知识]](https://uimg.taocdn.com/73501269b90d6c85ec3ac69f.webp)

--有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。

重排反应7 重排反应重排反应指同⼀分⼦内,某⼀原⼦或基团从⼀个原⼦迁移到另⼀个原⼦形成新的分⼦的反应。
利⽤重排常常可以合成⽤其它⽅法难以合成的物质。
其反应机理不外乎亲核、亲电和⾃由基⼏种。
按其迁移的⽅式⼤致可分为从碳原⼦到碳原⼦的重排、从碳原⼦到杂原⼦的重排以及从杂原⼦到碳原⼦的重排等⼏种。
7.1从碳原⼦到碳原⼦的重排从碳原⼦到碳原⼦的重排使碳⾻架发⽣变化。
其中典型的重排包括亲核1,2-重排和亲电1,2-重排。
前者包括Wagner-Meerwein重排和Pinacol重排;后者包括Wolf和Arndt-Eistert重排等。
7.1.1Wagner-Meerwein重排在质⼦酸或Lewis酸催化下形成的碳正离⼦中,烷基、芳基或氢从正离⼦相邻的碳原⼦上迁移到正离⼦上的反应,称为Wagner-Meerwein重排。
⽣成更稳定的碳正离⼦或产物成为重排的动⼒。
反应⽰例:双环⼆烯酮重排为四氢萘酚。
⽤质⼦酸处理某些环外烯烃可致重排。
7.1.2 Pinacol重排酸催化下,邻⼆醇脱⽔重排为醛或酮的反应称为Pinacol重排。
(1)四取代邻⼆醇的重排如果四个取代基相同,得单⼀产物。
如果是对称的邻⼆醇,产物分配主要取决于迁移基团的迁移能⼒。
迁移能⼒可能与亲核能⼒正相关。
⼀般⽽⾔,芳基>烷基>氢。
对位供电⼦基取代的芳基>未取代的芳基>邻位取代的芳基(空间障碍)。
如果是不对称的邻⼆醇,产物分配主要取决于形成的碳正离⼦的稳定性,与迁移基团的迁移能⼒关系不⼤。
不对称Pinacol重排的选择性不是太好,常常得到混合物,在药物合成上的意义不太⼤。
(2)三取代邻⼆醇的重排对于三取代的邻⼆醇,其中的叔碳上形成的碳正离⼦较稳定,所以⼀般是仲碳上的基团(或氢原⼦)迁移。
如果需要叔碳上的基团迁移,可采⽤衍⽣物法在碱性条件下重排。
(3)脂环上的邻⼆醇重排羟基位于脂环上的邻⼆醇的重排常导致脂环结构的变化。
螺环的形成:羟基共环的情形:如上,对于羟基共环的情形,总是处在离去的羟基反式的基团迁移,这在⼀定程度上说明Pinacol重排可按分⼦内SN2机理进⾏。
hofmann重拍的反应机理Hofmann重拍反应是一种常见的有机合成方法,用于将二烷基苯并联转化为芳香烃。
它是由德国化学家 August Wilhelm von Hofmann 在 1881 年发明的。
该反应机理包括三个步骤:首先,二烷基苯通过电解质催化剂(如碳酸钠或氢氧化钠)的作用被氧化成二烷基苯醛;其次,二烷基苯醛在高温条件下被转化成芳香醛;最后,芳香醛在碱性条件下被还原成芳香烃。
Hofmann重拍反应的优点在于反应条件宽松,产率高,同时也可以用于大规模生产。
因此,它广泛应用于有机合成工业中。
1. Hofmann重拍反应的基本原理Hofmann重拍反应是一种常见的有机合成方法,用于将二烷基苯并联转化为芳香烃。
它是由德国化学家 August Wilhelm von Hofmann 在 1881 年发明的。
Hofmann重拍反应机理包括三个步骤:首先,二烷基苯通过电解质催化剂(如碳酸钠或氢氧化钠)的作用被氧化成二烷基苯醛;其次,二烷基苯醛在高温条件下被转化成芳香醛;最后,芳香醛在碱性条件下被还原成芳香烃。
Hofmann重拍反应的优点在于反应条件宽松,产率高,同时也可以用于大规模生产。
因此,它广泛应用于有机合成工业中。
需要注意的是,Hofmann重拍反应是一种有副反应的反应,也就是说,在反应过程中会产生一些副产物。
因此,在实际应用中,需要适当调整反应条件,以最大程度地减少副产物的产生。
2. Hofmann重拍反应的反应条件Hofmann重拍反应是一种常见的有机合成方法,用于将二烷基苯并联转化为芳香烃。
它是由德国化学家 August Wilhelm von Hofmann 在 1881 年发明的。
Hofmann重拍反应的反应条件主要包括温度、压力、催化剂和溶剂。
关于温度,Hofmann重拍反应的第一步是二烷基苯的氧化反应,这一步的反应温度一般在120°C 左右。
第二步是二烷基苯醛的转化反应,这一步的反应温度一般在 180-200°C左右。
hofmann 重排反应
Hofmann 重排反应,也称为 Hofmann 消失法或 Hofmann 发氢反应,是指一种将1°或2°烷基溴化物转化为相应氨的引物的反应。
该反应通过反应产物主要体现在其相对分子质量的减小上,实现烷基的重排。
具体反应条件可以用碱金属氢氧化物(如氢氧化钠、氢氧化钾等)和氨水溶液进行反应,反应中产生大量的氨气。
反应机理为:首先碱金属氢氧化物水解季铵盐与氯离子,产生季铵羟基,接着氨在氢氧化物的帮助下对季铵羟基与三氯甲烷进行羟化取代作用而产生氨基一反应物;在配体羰基(Carbonyl)碳的原子中心进行亲核取代反应,产生第一次 Hofmann 重排的中间体;然后中间体再通过交错反应而产生更稳定的醛基含氮化合物;该化合物的反应可能会继续通过 Hofmann 反应或它的变异反应生成其他化合物。
每天一个人名反应--Hofmann重排伯酰胺在次卤酸盐处理经异氰酸酯中间体而生成少一个碳原子的伯胺。
亦称Hoffmann降解反应。
Hofmann重排是一个1,2-亲核重排(迁移)反应,中间体为异氰酸酯。
后者很少被分离出,而是经水解、脱羧直接形成产物伯胺。
异氰酸酯若醇解则得氨基甲酸酯、胺解得脲。
在这些反应中,若迁移碳为手性碳,则构型保持。
R基可为烷基或芳基。
当R为大于6个碳的烷基时,收率低,此时可用Br2/NaOMe替代Br2/NaOH,产物为氨基酸酯,后者可以水解成胺。
伯酰胺的氧化重排也可用其它氧化剂,如次氯酸钠、四醋酸铅。
高价碘是近年发展的比较绿色的试剂,可避免使用溴、铅等有害试剂。
NBS/DBU为温和的体系,甲氧基、氨基、硝基取代的苯甲酰胺也可顺利反应。
参考文献1. Hofmann, A. W. The effect of bromine on amides in basic solutions. Ber. 1881, 14,2725-2736.2. Hofmann, A. W. The effect of bromine on amides in basic solutions. Ber. 1882, 15, 407-416.3. Hofmann, A. W. The effect of bromine on amides in basic solutions. Ber. 1882, 15, 762-775.4. Kovacic, P., Lowery, M. K., Field, K. W. Chemistry of N-bromamines and N-chloramines. Chem. Rev. 1970, 70, 639.5. Zhdankin, V. V., Stang, P. J. Recent Developments in the Chemistry of Polyvalent Iodine Compounds. Chem. Rev. 2002, 102, 2523-2584.6. Stick, R. V.; Stubbs, K. A. J. Carbohydr. Chem. 2005, 24, 529–547.7. Jia, Y.-M.; Liang, X.-M.; Chang, L.; Wang, D.-Q. Synthesis 2007, 744–748.8. Yu, C.; Jiang, Y.; Liu, B.; Hu, L. Tetrahedron Lett. 2001, 42, 1449–1452.9. Jew, S.-s.; Kang, M.-h. Arch. Pharmacol Res. 1994, 17, 490–491.摘自:有机人名反应——机理及应用第四版,Strategic Applications of Named Reactions in Organic Synthesis。
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。