晶体结构
- 格式:pdf
- 大小:281.62 KB
- 文档页数:12

基础元素晶体的常见晶体结构基础元素晶体的常见晶体结构包括简单立方晶体结构、体心立方晶体结构、面心立方晶体结构、六方晶体结构和菱面体晶体结构。
简单立方晶体结构(SC)是最简单的晶体结构,它由具有相同大小和形状的离子、原子或分子的球形颗粒按照等距离的方式堆积而成。
简单立方晶体结构的每个颗粒只与其六个最近邻相互作用。
简单立方晶体结构的晶胞除了一个球形颗粒占据中心位置之外,其他所有位置都是空的。
简单立方晶体结构的一个典型例子是钠晶体。
体心立方晶体结构(BCC)是在简单立方晶体结构的基础上加入了一个位于晶胞中心的球形颗粒。
体心立方晶体结构的每个颗粒除了与其最近的六个颗粒相互作用外,还与位于晶胞中心的颗粒相互作用。
体心立方晶体结构的一个典型例子是铁晶体。
面心立方晶体结构(FCC)是在体心立方晶体结构的基础上还加入了每个面的球形颗粒。
面心立方晶体结构的每个颗粒除了与其最近的十二个颗粒相互作用外,还与位于每个面心的颗粒相互作用。
面心立方晶体结构的一个典型例子是铜晶体。
六方晶体结构是一种特殊的结构,其晶胞具有六个等面积和等角度的面。
六方晶体结构的每个颗粒与其最近的十二个颗粒相互作用。
六方晶体结构的一个典型例子是冰晶体。
菱面体晶体结构是一种具有两种中心和一个面的结构。
该结构的晶胞具有六个等面积和等角度的面。
菱面体晶体结构的每个颗粒与其最近的四个颗粒相互作用。
菱面体晶体结构的一个典型例子是碳晶体。
在实际应用中,基础元素晶体的晶体结构对其化学、物理性质和应用都有重要影响。
不同的晶体结构决定了晶体的密堆程度、所含晶胞数目、形态和表面性质等。
晶体结构的研究对材料科学、物理学、化学和地质学等学科具有重要的理论和应用价值。
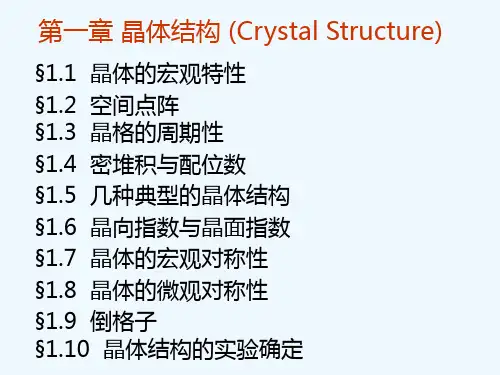

第七章晶体结构第一节晶体的点阵结构一、晶体及其特性晶体是原子(离子、分子)或基团(分子片段)在空间按一定规律周期性重复地排列构成的固体物质。
晶体中原子或基团的排列具有三维空间的周期性,这是晶体结构的最基本的特征,它使晶体具有下列共同的性质:(1)自发的形成多面体外形晶体在生长过程中自发的形成晶面,晶面相交成为晶棱,晶棱会聚成顶点,从而出现具有几何多面体外形的特点。
晶体在理想环境中应长成凸多面体。
其晶面数(F)、晶棱数(E)、顶点数(V)相互之间的关系符合公式:F+V=E+2 八面体有8个面,12条棱,6个顶点,并且在晶体形成过程中,各晶面生长的速度是不同的,这对晶体的多面体外形有很大影响:生长速度快的晶面在晶体生长的时候,相对变小,甚至消失,生长速度小的晶面在晶体生长过程中相对增大。
这就是布拉维法则。
(2)均匀性:晶体中原子周期性的排布,由于周期极小,故一块晶体各部分的宏观性质完全相同。
如密度、化学组成等。
(3)各向异性:由于晶体内部三维的结构基元在不同方向上原子、分子的排列与取向不同,故晶体在不同方向的性质各不相同。
如石墨晶体在与它的层状结构中各层相平行方向上的电导率约为与各层相垂直方向上电导率的410倍。
(4)晶体有明显确定的熔点二、晶体的同素异构由于形成环境不同,同一种原子或基团形成的晶体,可能存在不同的晶体结构,这种现象称为晶体的同素异构。
如:金刚石、石墨和C60是碳的同素异形体。
三、晶体的点阵结构理论1、基本概念(1)点阵:伸展的聚乙烯分子具有一维周期性,重复单位为2个C原子,4个H 原子。
如果我们不管其重复单位的内容,将它抽象成几何学上的点,那么这些点在空间的排布就能表示晶体结构中原子的排布规律。
这些没有大小、没有质量、不可分辨的点在空间排布形成的图形称为点阵。
构成点阵的点称为点阵点。
点阵点所代表的重复单位的具体内容称为结构基元。
用点阵来研究晶体的几何结构的理论称为点阵理论。
(2)直线点阵:根据晶体结构的周期性,将沿着晶棱方向周期的重复排列的结构单元,抽象出一组分布在同一直线上等距离的点列,称直线点阵。

14种晶体结构晶体是由原子、分子或福隔离子按照一定的空间规则排列而成的有序固体。
晶体结构是指晶体中原子、离子或分子排列的规则和顺序。
在固体物质中,晶体结构的种类有很多种,其中比较常见的有以下14种:1. 立方晶体结构:最简单的晶体结构之一,具有三个等长的边和六个等角,包括简单立方、体心立方和面心立方三种类型。
2. 六方晶体结构:其晶胞的基本结构是六方密堆,其中最典型的就是六方晶体和螺旋晶体。
3. 正交晶体结构:晶胞具有三个不相互垂直的晶轴,分别被称为a、b 和c 轴,是最常见的晶体结构之一。
4. 单斜晶体结构:晶胞具有两个不相互垂直的晶轴,是晶体结构中的一种。
5. 三方晶体结构:具有三个相等的轴,夹角为60度,最常见的晶体结构之一是石英。
6. 菱晶体结构:晶胞内部有四面体结构,是一种简单的晶体结构。
7. 钙钛矿晶体结构:一种具有钙钛矿结构的晶体,包括钙钛矿结构和螺旋钙钛矿结构。
8. 蜗牛晶体结构:晶胞的形状像一只蜗牛的壳,是晶体结构中的一种。
9. 立方密排晶体结构:晶胞的结构是立方密排,是晶体结构中的一种。
10. 体心立方晶体结构:晶体结构的晶胞中有一个原子位于晶体的中心,是晶体结构中的一种。
11. 面心立方晶体结构:晶体结构的晶胞的各个面的中心有一个原子,是晶体结构中的一种。
12. 钻石晶体结构:晶体结构的晶胞构成了一种钻石结构,是晶体结构中的一种。
13. 银晶体结构:晶体结构的晶胞构成了一种银结构,是晶体结构中的一种。
14. 锶钛矿晶体结构:晶体结构的晶胞构成了一种锶钛矿结构,是晶体结构中的一种。
晶体结构的种类繁多,每种晶体结构都有其独特的结构特点和性质,对晶体的物理和化学性质有着重要的影响。
研究晶体结构不仅可以帮助我们更好地了解晶体的构成和性质,还有助于我们在材料科学、物理化学等领域的应用和研究。
因此,对晶体结构的研究具有重要的科学意义和应用价值。


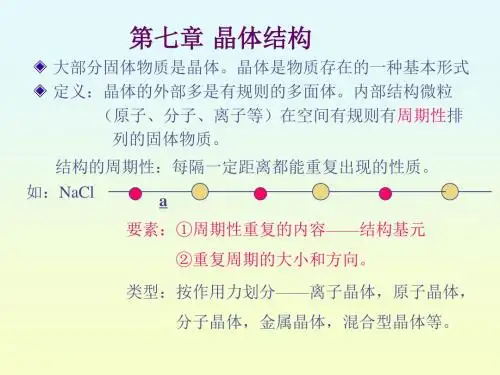
第七章 晶体结构第一节 晶体的基本概念一、晶体概述固态物质按其组成粒子(分子、原子或离子等)在空间排列是否长程有序分成晶体(Crystal )和非晶体(又称为无定形体、玻璃体等)两类。
所谓长程有序,是指组成固态物质的粒子在三维空间按一定方式周期性的重复排列,从而使晶体成为长程有序结构。
长程有序体现了平移对称性等晶体的性质。
与晶体相反,非晶体(Non-crystal )内部的粒子(分子、原子或离子等)在空间排列不是长程有序的,而是杂乱无章的排列。
例如橡胶、玻璃等都是非晶体。
晶体内部各部分的宏观性质相同,称为晶体性质的均匀性。
非晶体也有均匀性,尽管起因与晶体不同。
晶体特有的性质是异向性、自范性、对称性、确定的熔点、X 光衍射效应、晶体的缺陷等。
对于长程有序的晶体结构来说,若了解了其周期性重复单位的结构及排列方式,就了解了整个晶体的结构。
可见,周期性重复单位对认识晶体结构非常重要。
在长程有序的晶体结构中,周期性重复的单位(一般是平行六面体)有多种不同的选取方法。
按照对称性高、体积尽量小的原则选择的周期性重复单位(平面上的重复单位是平行四边形,空间中的重复单位是平行六面体),就是正当晶胞,一般称为晶胞(Crystal cell )。
二、晶胞及以晶胞为基础的计算1. 晶胞的两个要素晶胞是代表晶体结构的最小单元,它有两个要素:一是晶胞的大小、型式,晶胞的大小可由晶胞参数确定,晶胞的型式是指素晶胞或复晶胞。
二是晶胞的内容,是指晶胞中原子的种类和位置,表示原子位置要用分数坐标。
晶体可由三个不相平行的矢量a , b , c 划分成晶胞,适量a , b , c 的长度a , b , c 及其相互之间的夹角α, β, γ称为晶胞参数,其中α是矢量b 和c 之间的交角,β是矢量a 和c 之间的交角,γ是矢量a 和b 之间的交角。
素晶胞是指只包含一个重复单位的晶胞,复晶胞是指只包含一个以上重复单位的晶胞。
分数坐标是指原子在晶胞中的坐标参数(x , y , z ),坐标参数(x , y , z )是由晶胞原点指向原子的矢量r 用单位矢量a , b , c 表达,即r = x a + y b + z c如图所示晶体,小球和大球的分数坐标分别为 小球:)21,21,21( ),21,0,0( ),0,21,0( ),0,0,21( 大球:)21,21,0( ),21,0,21( ),0,21,21( ),0,0,0( 2. 以晶胞为基础的计算(1)根据晶体的化学式计算密度:D =ZM/N A V ,M 是晶体化学式的相对式量,Z 是一个晶胞中包含化学式的个数,V 是晶胞的体积,N A 是阿佛加德罗常数。




第二章晶体结构及常见晶体结构类型1、名词解释(a)晶体与晶体常数(b)类质同晶和同质多晶(c)二八面体型与三八面体型(d)同晶取代与阳离子交换(e)尖晶石与反尖晶石(f)晶胞与晶胞参数(g)配位数与配位体(h)同质多晶与多晶转变(i)位移性转变与重建性转变(j)晶体场理论与配位场理论解:(a)晶体是内部质点在三维空间成周期性重复排列的固体。
或晶体是具格子构造的固体。
晶体常数:晶轴轴率或轴单位,轴角。
(b)类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
(c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体型结构。
三八面体型:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三八面体型结构。
(d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构类型的现象。
阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层时,一些电价低、半径大的阳离子(如K+、Na+等)将进入晶体结构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下可以被其它阳离子交换。
(e)正尖晶石:在AB2O4尖晶石型晶体结构中,若A2+分布在四面体空隙、而B3+分布于八面体空隙,称为正尖晶石;反尖晶石:若A2+分布在八面体空隙、而B3+一半分布于四面体空隙另一半分布于八面体空隙,通式为B(AB)O4,称为反尖晶石。
(f)任何晶体都对应一种布拉菲格子,因此任何晶体都可划分出与此种布拉菲格子平行六面体相对应的部分,这一部分晶体就称为晶胞。
晶胞是能够反映晶体结构特征的最小单位。
表示晶体结构特征的参数(a、b、c,α(bc)∧、β(ac)∧、γ(ab)∧)称为晶胞常数,晶胞参数也即晶体常数。
(g):配位数:晶体结构中与一个离子直接相邻的异号离子数。
配位体:晶体结构中与某一个阳离子直接相邻、形成配位关系的各个阴离子中心连线所构成的多面体。
(h)同质多晶:同一化学组成在不同外界条件下(温度、压力、pH值等),结晶成为两种以上不同结构晶体的现象。
多晶转变:当外界条件改变到一定程度时,各种变体之间发生结构转变,从一种变体转变成为另一种变体的现象。
(i)位移性转变:不打开任何键,也不改变原子最邻近的配位数,仅仅使结构发生畸变,原子从原来位置发生少许位移,使次级配位有所改变的一种多晶转变形式。
重建性转变:破坏原有原子间化学键,改变原子最邻近配位数,使晶体结构完全改变原样的一种多晶转变形式。
(j)晶体场理论:认为在晶体结构中,中心阳离子与配位体之间是离子键,不存在电子轨道的重迭,并将配位体作为点电荷来处理的理论。
配位场理论:除了考虑到由配位体所引起的纯静电效应以外,还考虑了共价成键的效应的理论。
2、在氧离子面心立方密堆积结构中,对于获得稳定结构各需何种价离子,其中:(1)所有八面体间隙位置均填满;(2)所有四面体间隙位置均填满;(3)填满一半八面体间隙位置;(4)填满一半四面体间隙位置。
并对每一种堆积方式举一晶体实例说明之。
解:(1)填满所有的八面体空隙,2价阳离子,MgO;O;(2)填满所有的四面体空隙,1价阳离子,Li2(3)填满一半的八面体空隙,4价阳离子,TiO;2(4)填满一半的四面体空隙,2价阳离子,ZnO。
3、试解释:(a)在AX型晶体结构中,NaCl型结构最多;(b )MgAl 2O 4晶体结构中,按r +/r -与CN 关系,Mg 2+、A l3+都填充八面体空隙,但在该结构中Mg 2+进入四面体空隙,Al 3+填充八面体空隙;而在MgFe 2O 4结构中,Mg 2+填充八面体空隙,而一半Fe 3+填充四面体空隙。
(c )绿宝石和透辉石中Si:O 都为1:3,前者为环状结构,后者为链状结构。
解:(a )在AX 型晶体结构中,一般阴离子X 的半径较大,而阳离子A 的半径较小,所以X 做紧密堆积,A 填充在其空隙中。
大多数AX 型化合物的r +/r -在0.414~0.732之间,应该填充在八面体空隙,即具有NaCl 型结构;并且NaCl 型晶体结构的对称性较高,所以AX 型化合物大多具有NaCl 型结构。
(b )按照阳、阴离子半径比与配位数之间的关系,Al 3+与Mg 2+的配位数均应该为6,填入八面体空隙。
但是,根据鲍林规则,高电价离子填充于低配位的四面体空隙时,排斥力要比填充八面体空隙中较大,稳定性较差,所以Al 3+填入八面体空隙,而Mg 2+填入四面体空隙。
而在MgFe 2O 4结构中,由于Fe 3+的八面体择位能为0,可以进入四面体或八面体空隙,当配位数为4时,Fe 3+离子半径0.049nm ,Mg 2+离子半径0.057nm ,Fe 3+在四面体空隙中更加稳定,所以Mg 2+填充八面体空隙、一半Fe 3+填充四面体空隙。
(c )绿宝石和透辉石中Si :O 都为1:3。
但是,绿宝石中的其它阳离子Be 2+和Al 3+的离子半径较小,配位数较小(4或6),相互间斥力较大,所以绿宝石通过[SiO 4]顶角相连形成六节环,再通过Be 2+和Al 3+将六节环连接起来,离子堆积结合状态不太紧密,这样晶体结构较稳定。
透辉石中是Mg 2+和Ca 2+,离子半径较大,配位数较大(分别为6和8),相互间斥力较小,所以透辉石通过[SiO 4]顶角相连形成单链,离子堆积结合状态比较紧密。
4、叙述硅酸盐晶体结构分类原则及各种类型的特点,并举一例说明之。
解:硅酸盐矿物按照硅氧四面体的连接方式进行分类,具体类型见下表。
硅酸盐矿物的结构类型5、堇青石与绿宝石有相同结构,分析其有显著的离子电导,较小的热膨胀系数的原因。
解:堇青石Mg 2A l3[AlSi 5O 18]具有绿宝石结构,以(3Al 3++2Mg 2+)置换绿宝石中的(3Be 2++2Al 3+)。
6个[SiO 4]通过顶角相连形成六节环,沿c 轴方向上下迭置的六节环内形成了一个空腔,成为离子迁移的通道,因而具有显著的离子电导;另外离子受热后,振幅增大,但由于能够向结构空隙中膨胀,所以不发生明显的体积膨胀,因而热膨胀系数较小。
6、(1)什么叫阳离子交换?(2)从结构上说明高岭石、蒙脱石阳离子交换容量差异的原因。
解:(1)在粘土矿物中,如果入层间,来平衡多余的负电荷,在一定条件下这些阳离子可[AlO 6]层中部分Al 3+被Mg 2+、Fe 2+代替时,一些水化阳离子(如Na +、Ca 2+等)进以被其它阳离子交换,这种现象称为阳离子交换。
(2)高岭石的阳离子交换容量较小,而蒙脱石的阳离子交换容量较大。
因为高岭石是1:1型结构,单网层与单网层之间以氢键相连,氢键强于范氏键,水化阳离子不易进入层间,因此阳离子交换容量较小。
而蒙脱石是为2:1型结构,复网层间以范氏键相连,层间联系较弱,水化阳离子容易进入复网层间以平衡多余的负电荷,因此蒙脱石的阳离子交换容量较大。
7、同为碱土金属阳离子Be 2+、Mg 2+、Ca 2+,其卤化物BeF 2和SiO 2结构同,MgF 2与TiO 2(金红石型)结构同,CaF 2则有萤石型结构,分析其原因。
解:碱土金属离子Be 2+、Mg 2+、Ca 2+,随着原子序数的增大,离子半径逐渐增大,极化性能变化不大。
当阴离子同为F -时,使得其r+/r-增大,配位数增大,由BeF 2的4配位到MgF 2的6配位,再到CaF 2的8配位。
8、金刚石结构中C 原子按面心立方排列,为什么其堆积系数仅为34%?解:为了分析晶体结构方便起见,金刚石结构中C 原子可以看成按面心立方排列。
但实际上由于C 原子之间是共价键,具有方向性和饱和性,每个C 原子只与4个C 原子形成价键(紧密相邻),所以并没有达到紧密堆积(紧密堆积时每个原子同时与12个原子紧密相邻),其晶体结构内部存在很多空隙。
所以其堆积系数仅为34%,远远小于紧密堆积的74.05%。
9、简答题(1)试述玻璃和晶体的差别?(2)晶胞与空间格子是何种关系?解:(1)晶体的内部质点在三维空间作有规律的重复排列,兼具短程有序和长程有序的结构。
而玻璃的内部质点则呈近程有序而远程无序的无规网络结构或微晶子结构。
与非晶体比较晶体具有自限性、均一性、异向性、对称性、最小内能和稳定性。
(2)晶胞是指能够充分反映整个晶体结构特征的最小结构单位,晶体可看成晶胞的无间隙堆垛而成。
晶胞的形状大小与对应的单位平行六面体完全一致,并可用与平行六面体相同的参数来表征晶胞的几何特征。
其区别是单位平行六面体是不具任何物理、化学特征的几何点(等同点)构成的。
而晶胞则是实在的具体质点构成。
10、以NaCl晶胞为例,试说明面心立方紧密堆积中的八面体和四面体空隙的位置和数量。
解:以NaCl晶胞中(001)面心的一个球(Cl离子)为例,它的正下方有1个八面体空隙(体心位置),与其对称,正上方也有1个八面体空隙;前后左右各有1个八面体空隙(棱心位置)。
所以共有6个八面体空隙与其直接相邻,由于每个八面体空隙由6个球构成,所以属于这个球的八面体空隙数为6×1/6=1。
在这个晶胞中,这个球还与另外2个面心、1个顶角上的球构成4个四面体空隙(即1/8小立方体的体心位置);由于对称性,在上面的晶胞中,也有4个四面体空隙由这个参与构成。
所以共有8个四面体空隙与其直接相邻,由于每个四面体空隙由4个球构成,所以属于这个球的四面体空隙数为8×1/4=2。
11、Li2O晶体,Li+的半径为0.074nm,O2-的半径为0.140nm,其密度为1.646g/cm3,求晶胞常数a0;晶胞中Li2O的分子数。
解:按照已知密度计算:根据已知离子半径计算:[LiO4]的棱为小立方体的面对角线。
将已知数值代入上式并解方程得:12、在透辉石CaMg[Si2O6]晶体结构中,O2-与阳离子Ca2+、Mg2+、Si4+配位型式有哪几种,符合鲍林静电价规则吗?为什么?解:透辉石CaMg[Si2O6],O2-与阳离子Ca2+、Mg2+、Si4+配位型式有三种,即2个桥氧和2个非桥氧形成[SiO4],6个非桥氧形成[MgO6],4个桥氧和4个非桥氧形成[CaO8]。
同时与1个Si4+、2个Mg2+和1个Ca2+配位的非桥氧,其静电价强度总和为4×1/4+2×2×1/6+2×1/8=23/12,而同时与1个Si4+、1个Mg2+和1个Ca2+配位的非桥氧,其静电价强度总和为4×1/4+2×1/6+2×1/8=19/12,小于其负电价;同时与2个Si4+、2个Ca2+配位的桥氧,其静电价强度总和为4×2×1/4+2×2×1/8=5/2,大于其负电价。