3-常见晶体结构
- 格式:ppt
- 大小:4.41 MB
- 文档页数:53

三种晶体结构的最密排晶面和最密排晶向1.引言1.1 概述晶体是具有长程有序排列的原子、离子或分子的固体物质。
晶体的结构是由最密排列的晶面和晶向构成的。
最密排晶面是指在晶体结构中,原子、离子或分子最紧密地靠近的面,而最密排晶向则指的是在晶体中最紧密地排列的方向。
本文将分析三种不同的晶体结构,探讨它们各自的最密排晶面和最密排晶向。
通过深入研究这些结构的排列方式,可以更好地理解晶体的性质和行为。
第一种晶体结构是立方晶系,也是最简单的晶体结构之一。
它的最密排晶面是(111)晶面,最密排晶向则是[110]晶向。
这些晶面和晶向在晶体中具有紧密的排列,使晶体的结构呈现出高度的对称性。
第二种晶体结构是六方晶系,它相对于立方晶系而言稍复杂一些。
在六方晶系中,最密排晶面是(0001)晶面,最密排晶向是[10-10]晶向。
与立方晶系不同,六方晶系具有六方对称性,呈现出更复杂的晶体结构。
第三种晶体结构是四方晶系,它也是一种常见的晶体结构。
在四方晶系中,最密排晶面是(100)晶面,最密排晶向是[110]晶向。
四方晶系的晶体结构与立方晶系相似,但具有更多的对称性和排列方式。
通过对这三种晶体结构的最密排晶面和最密排晶向进行研究,我们可以更好地理解晶体的基本结构和性质。
这对于材料科学、凝聚态物理和相关领域的研究具有重要意义,同时也有助于开发新材料和改进现有材料的性能。
1.2文章结构文章结构部分的内容可以包括以下几个方面的介绍:1.2 文章结构本文主要分为引言、正文和结论三个部分。
引言部分概述了晶体结构和最密排晶面、最密排晶向的研究背景和重要性,并提出了本文研究的目的和意义。
正文部分分为三个小节,分别介绍了三种晶体结构的最密排晶面和最密排晶向。
每个小节将首先介绍该种晶体结构的一般特点和常见应用,然后详细讨论最密排晶面和最密排晶向的确定方法和规律,并给出具体的实例和数据进行说明。
结论部分对于每种晶体结构的最密排晶面和最密排晶向进行总结和回顾,并指出各种晶体结构最密排晶面和最密排晶向的综合特点和应用前景。



金属晶体的常见结构
金属晶体的常见结构有以下几种:
1. 面心立方(FCC)结构:在这种结构中,金属原子分别位于正方形面的角点和中心,以及正方形面的中心。
每个原子都与12个邻近原子相接触,形成一个紧密堆积的结构。
典型的例子是铜、铝和金。
2. 体心立方(BCC)结构:在这种结构中,金属原子分别位于正方体的角点和正方体的中心。
每个原子都与8个邻近原子相接触,形成一个比较紧密的结构。
铁和钨是常见的具有BCC结构的金属。
3. 密排六方(HCP)结构:在这种结构中,金属原子以一定的方式排列,形成六边形的密排层,其中每个层的原子位于前一层原子的空隙上。
这些层之间存在垂直堆叠,形成一个紧密堆积的结构。
典型的例子是钛和锆。
除了以上三种常见的金属晶体结构外,还有其他特殊的结构,如体心立方密堆积(BCC HCP)和面心立方密堆积(FCC HCP)等。
这些不同的结构对于金属的性质和行为有着重要的影响。
1。
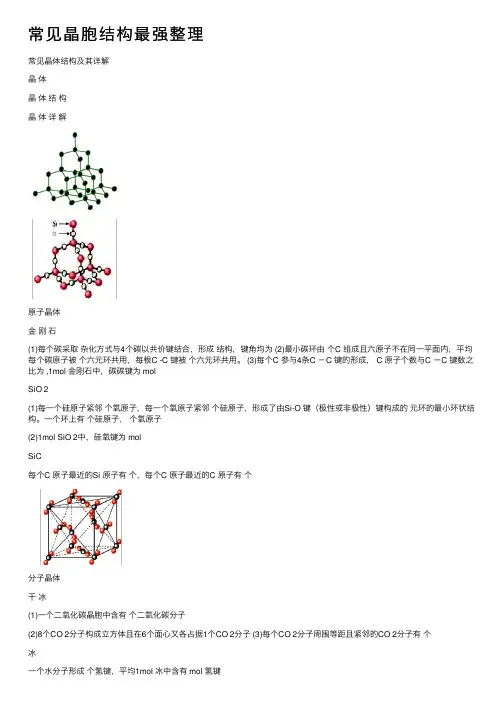
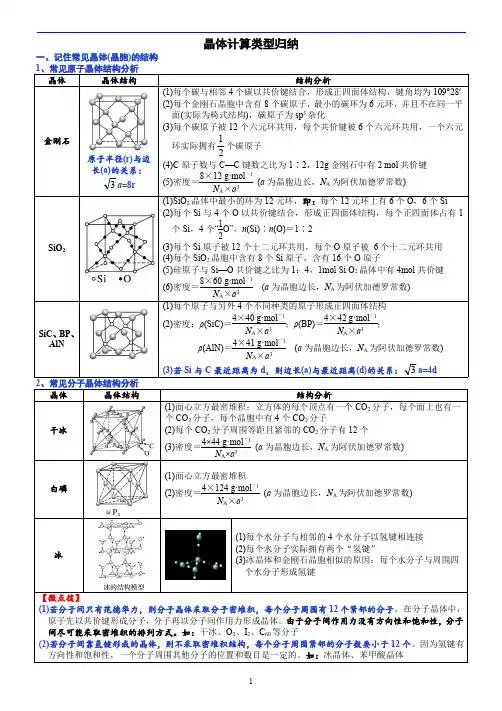
常见晶胞结构最强整理常见晶体结构及其详解晶体晶体结构晶体详解原⼦晶体⾦刚⽯(1)每个碳采取杂化⽅式与4个碳以共价键结合,形成结构,键⾓均为 (2)最⼩碳环由个C 组成且六原⼦不在同⼀平⾯内,平均每个碳原⼦被个六元环共⽤,每根C -C 键被个六元环共⽤。
(3)每个C 参与4条C -C 键的形成, C 原⼦个数与C -C 键数之⽐为 ,1mol ⾦刚⽯中,碳碳键为 molSiO 2(1)每⼀个硅原⼦紧邻个氧原⼦,每⼀个氧原⼦紧邻个硅原⼦,形成了由Si-O 键(极性或⾮极性)键构成的元环的最⼩环状结构。
⼀个环上有个硅原⼦,个氧原⼦(2)1mol SiO 2中,硅氧键为 molSiC每个C 原⼦最近的Si 原⼦有个,每个C 原⼦最近的C 原⼦有个分⼦晶体⼲冰(1)⼀个⼆氧化碳晶胞中含有个⼆氧化碳分⼦(2)8个CO 2分⼦构成⽴⽅体且在6个⾯⼼⼜各占据1个CO 2分⼦ (3)每个CO 2分⼦周围等距且紧邻的CO 2分⼦有个冰⼀个⽔分⼦形成个氢键,平均1mol 冰中含有 mol 氢键C 60(1)⾜球烯的分⼦是由60个碳原⼦构成的,空间构型有12个正五边形,20个正六边形(2)⼀个C 60分⼦中含有根单键,根双键 (3)C 60晶胞中与⼀个C 60最近的C 60分⼦有个(与⼲冰的晶胞相似)离⼦晶体NaCl (型)(1)每个Na +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Na +有个。
每个Na +周围等距且紧邻的Na +有个,同理Cl -也然。
(2)每个晶胞中含个Na +和4个Cl -。
CsCl (型)(1)每个Cs +周围等距且紧邻的Cl -有个,每个Cl -周围等距且紧邻的Cs +有个。
(2)左图为个晶胞;右图为⼀个晶胞,每个晶胞中含个Cs +,个Cl -。
CaF 21、1个晶胞中含有个Ca 2+,个F -,Ca 2+的配位数为个,F -配位数为个2、Ca 2+周围等距离最近的Ca 2+ 个,F —周围等距离最近的F — 个⾦属晶体简单⽴⽅堆积典型代表空间利⽤率配位数为体⼼⽴⽅堆积典型代表空间利⽤率配位数为⾯⼼⽴⽅堆积典型代表空间利⽤率配位数为六⽅最密堆积典型代表空间利⽤率配位数为混合晶体⽯墨1、碳原⼦的杂化⽅式为,键⾓为2、⽯墨晶体的⽚层结构中,每个六元碳环含有个碳原⼦数,每个六元碳环所含有的共价健数是个3、⽯墨同层C 原⼦间以连接,熔化需要破坏碳碳之间作⽤⼒,故熔沸点较⾼;层与层之间的作⽤⼒为,作⽤⼒⽐较弱,故⽯墨的硬度较低。





常见的晶体结构高中化学晶体是由原子、分子或离子等按照一定的规则排列组成的固体物质。
晶体结构是指晶体中原子、分子或离子的排列方式和空间位置的有序性。
以下是一些常见的晶体结构:1.立方晶系:立方晶系是最简单的晶体结构类型,具有最高的对称性。
立方晶系包括以下几种晶体结构:-简单立方结构:最简单的晶体结构,如钠金属。
-面心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于正方形面的中心,如铝、铜等。
-体心立方结构:每个立方格点上除了原子所在的角点外,还有一个原子位于立方体的中心,如铁、锂等。
-体心立方密堆结构:在体心立方结构的基础上,每个体心立方顶点上还有各自的三个原子,如铬、铤等。
2.六方晶系:六方晶系的晶体结构相对复杂,具有六重轴对称性。
六方晶系包括以下几种晶体结构:-六方最密堆积结构:最密堆积的晶体结构,如铝合金、硬质合金等。
3.正交晶系:正交晶系的晶体结构具有三个相互垂直的轴和互相垂直的面,没有对称轴。
正交晶系包括以下几种晶体结构:-基心正交结构:每个顶点上有原子以外,还有一个原子位于底面的中点,如锌等。
-面心正交结构:每个顶点上原子以外,还有一个原子位于两个邻接底面的中点和两个对称角上的原子,如镍。
4.单斜晶系:单斜晶系的晶体结构具有一个二重轴和一组不对称的轴,没有对称轴。
单斜晶系包括以下几种晶体结构:-单斜底心结构:每个顶点上有原子以外,还有一个原子位于两个底面的中点,如铅、镀镍等。
5.斜方晶系:斜方晶系的晶体结构没有对称轴,具有两个相等且垂直的轴。
-斜方单斜结构:具有一个反射面,如黄铁矿、菱铁矿等。
6.三斜晶系:三斜晶系的晶体结构没有对称轴,也没有垂直的轴。
三斜晶系包括以下几种晶体结构:-无底心三斜结构:没有底心原子,如铜酸亚锌等。
这些晶体结构是根据晶体的对称性进行分类的,每一种晶体结构都有其独特的排列方式和空间位置。
通过研究晶体结构,可以揭示物质的物理和化学性质以及材料的制备和应用方面的特点。