18-19 专题2 第1单元 第3课时 溴、碘的提取
- 格式:doc
- 大小:67.02 KB
- 文档页数:8


专题二溴、碘的提取教案三一、三维目标1.知识与技能:1)、了解从海水中提取溴、碘的过程,认识溴、碘及其化合物的用途;2)、了解工业上从海水中获取溴和海带中获取碘单质的基本方法3)、掌握氯、溴、碘间的置换反应;4)、掌握萃取的原理及操作方法。
2.过程与方法:通过引导学生观察、分析演示实验的现象和实验探究活动,培养学生的观察问题、分析问题和动手能力。
3.情感态度与价值观通过从海水中提取溴、碘的,让学生意识到人类生活的自然是提供人类生活资源的重要来源和社会责任感。
二、教学重点、难点溴、碘提取的反应原理和方法三、过程和方法实验探索﹑实际操作﹑引导启发四、教学思路新教材区别于以往教材的一大特点是通过实验本身去探索和归纳知识及与社会实践的紧密联系,注重培养学生的学习知识能力和社会责任感。
本节课注重从实验本身出发,通过实验让学生了解一些物质的性质,再由教师引导及学生讨论一起获得知识理论,再来认识实际应用。
很好的体现了理论联系实际这一科学方法。
五、教学过程:[创设情景] 可能在坐的各位许多都喜欢拍照,按下按扭,美丽的图案就很快的呈现在我们面前。
感光胶片在这一刹那起了决定性作用。
那什么东西使感光胶片会有如此神奇的功能呢?[学生回答] 碘化银[教师评价] 非常的好!同学们复习新课非常到位。
[教师讲述] 碘化银是一种很好的感光材料,可以用来拍照。
它也有另外一种类似于干冰的重要用途—人工降雨。
人体含有少量的碘,但碘却是人体不可缺少的元素,碘缺乏可对人体尤其是儿童智力发育造成严重危害,缺了碘就会得“大脖子”病,1990年世界儿童首脑会议制定了“2000年全球消灭碘缺乏病”的目标。
这节课我们就来学习从海水中提取溴﹑碘。
[板书]:一.溴、碘的提取原理[演示实验1] 在一支试管中加入2-3ml KBr溶液,滴加少量新制氯水,①振荡,静置,观察实验现象;②再滴加少量CCI4,振荡,静置,观察实验现象。
[分组实验]在两支试管中各加入2-3ml KI溶液,分别滴加少量溴水和新制氯水,①振荡,静置,观察实验现象;②再滴加少量CCI4,振荡,静置,观察实验现象。







课题 $2.1.3溴、碘的提取
一、教学目标:
知识与技能:
1.了解从海水或海产品中提取溴、碘单质的基本原理和方法。
2.知道氯、溴、碘单质的主要性质及其差异。
3.认识氯、溴、碘及其化合物在生产和生活中的重要应用。
过程与方法:
1.体验实验探究的过程和一般方法,锻炼化学实验基本操作技能。
2.能根据观察的实验现象形成结论,增强分析、解决问题的能力。
情感态度和价值观:
认识到海水是人类的宝贵自然资源,培养与大自然友好相处的情感。
二、教学重点和难点:
从海水或海产品中提取溴、碘单质的基本原理和方法。
三、教学过程:。

第3课时 溴、碘的提取目标与素养:1.了解从海水或海产品中提取溴、碘单质的基本原理和方法。
(宏观辨识与微观探析)2.知道氯、溴、碘单质的性质及其差异。
(宏观辨识与微观探析)3.掌握Cl -、Br -、I -的检验方法。
(科学探究与创新意识)一、溴、碘的提取 1.反应原理(1)溴的提取:海水提取粗食盐后的母液,通入氯气将其中的溴离子转化为单质溴。
(2)碘的提取:海水中碘的浓度很低,工业上不直接由海水提取碘,而是以具有富集碘能力的植物如海带、海藻为原料提取碘。
3.提取流程(1)海水提溴的工艺流程:(2)从海带中提取碘的工艺流程:微点拨Cl 2、Br 2、I 2的氧化性由强到弱的顺序是Cl 2>Br 2>I 2; Cl -、Br -、I -的还原性由强到弱的顺序是I ->Br ->Cl -。
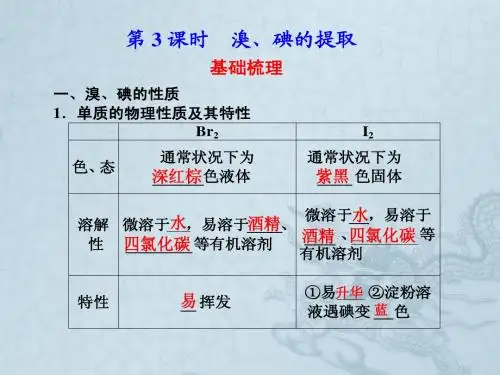
二、溴、碘的性质 1.单质的物理性质氯易液化,溴易挥发,碘易升华。
溴是室温下唯一一种液态单质。
2.Br -、I -的检验(1)试剂:硝酸银溶液和稀硝酸。
(2)化学方程式:NaBr +AgNO 3===AgBr↓+NaNO 3,NaI +AgNO 3===AgI↓+NaNO 3。
(3)现象:分别出现淡黄色沉淀、黄色沉淀。
3.溴、碘及其化合物的重要用途(1)溴可用于生产熏蒸剂、杀虫剂、抗爆剂等药剂。
(2)溴化银是重要的感光材料。
(3)碘是一种重要的药用元素,也应用于含碘食品的生产。
(4)碘化银可用于人工降雨。
1.判断正误(正确的打“√”,错误的打“×”) (1)海水中提取溴的过程中不发生氧化还原反应 (×) (2)可以用淀粉溶液检验加碘食盐中的KIO 3(×)(3)加入AgNO 3溶液,生成白色沉淀,加盐酸沉淀不消失,则原溶液中有Cl -存在(×)(4)某无色溶液先通入Cl 2,溶液变成棕黄色,再滴入淀粉溶液后,溶液又变蓝,则原溶液中有I -存在(√)2.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象。
第3课时溴、碘的提取学习目标:1.了解溴、碘的主要性质及其应用。
2.了解溴、碘的提取和反应原理。
(重难点)3.掌握Cl-、Br-、I-的检验方法。
(重点)[自主预习·探新知]1.溴、碘的制备与性质(1)Br2、I2的制备①制取溴单质:在一支试管中加入2~3 mL KBr溶液,滴加少量新制氯水,再滴加少量CCl4,振荡,静置,观察到的实验现象为分层,上层为无色溶液,下层为橙红色液体,反应的化学方程式为Cl2+2KBr===2KCl+Br2。
②制取碘单质:在一支试管中加入2~3 mL KI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡,静置,观察到的实验现象为分层,上层为无色溶液,下层为紫红色液体。
反应的化学方程式为Cl2+2KI===2KCl+I2。
(2)Br2、I2的物理性质①溴单质具有氧化性,能将碘化钾溶液中的碘置换出来,反应的化学方程式为Br2+2KI===2KBr+I2。
②在水溶液中,溴离子能与银离子反应,生成难溶于水和稀硝酸的浅黄色溴化银沉淀。
反应的化学方程式为NaBr+AgNO3===AgBr↓+NaNO3,实验室常用硝酸银溶液和稀硝酸来检验Br-。
③在水溶液中,碘离子能与银离子反应,生成难溶于水和稀硝酸的黄色碘化银沉淀。
反应的化学方程式为NaI+AgNO3===AgI↓+NaNO3,实验室常用硝酸银溶液和稀硝酸来检验I-。
④I2遇淀粉变蓝色,该性质可用于检验I2。
(4)溴、碘及其化合物的应用①溴可用于生产多种药剂,如熏蒸剂、杀虫剂、抗爆剂等。
溴化银是一种重要的感光材料,是胶卷中必不可少的成分。
②碘是一种重要的药用元素,含碘食品的生产也需要碘元素,碘化银可用于人工降雨。
2.溴、碘的提取(1)海水提溴提取粗食盐后的母液――→Cl 2Br 2的水溶液鼓入热空气或水蒸气――→冷凝粗溴――→精制溴单质。
(2)从海产品中提取碘的流程说明:海带中所含的碘在浸泡时可以I -的形式进入溶液。
[基础自测]1.判断正误(正确的打“√”,错误的打“×”)(1)海水提溴的过程中不发生氧化还原反应。
( )(2)可以用淀粉溶液检验加碘食盐中的KIO 3。
( )(3)用CCl 4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色。
(4)反应Br 2+2KI===I 2+2KBr 说明还原性Br 2大于I 2。
( )(5)海带用水浸泡可以使I 2直接溶于水。
( )(6)检验Cl -、Br -、I -可以加入HNO 3和AgNO 3溶液。
( )【答案】 (1)× (2)× (3)× (4)× (5)× (6)√2.某学生往一支试管里按一定次序分别加入下列几种物质:A.KI 溶液,B.淀粉溶液,C.NaOH 溶液,D.氯水。
发现溶液颜色按下面次序变化:【导学号:90512056】①无色→②棕黄色→③蓝色→④无色。
依据溶液颜色的变化回答下列问题:(1)加入以上药品的顺序是_______________________________________。
(2)写出①→②的离子反应方程式,若为氧化还原反应,请用双线桥法标明电子转移的方向和数目:___________________________________________________________________________________________________________。
(3)I 2与NaOH 反应类似Cl 2与NaOH 反应,写出③→④的化学方程式:_____ _____________________________________________________________。
【解析】溶液显棕黄色,说明溶液中有I2生成,氯水和KI溶液反应生成I2,而氯水显浅黄绿色,故①为KI溶液,②为氯水;溶液显蓝色是由于淀粉遇I2形成的,故③为淀粉溶液;又由于I2+2NaOH===NaI+NaIO+H2O,I2逐渐消失,蓝色将逐渐褪为无色,故④为NaOH溶液。
【答案】(1)A、D、B、C(3)I2+2NaOH===NaI+NaIO+H2O[合作探究·攻重难]氯、溴、碘的主要性质及卤离子检验[(1)通过什么反应可证明氧化性Br2>I2?写出化学方程式。
【提示】Br2+2KI===2KBr+I2。
(2)如何证明溶液中含有I-?【提示】取溶液加入AgNO3溶液和稀HNO3或加入氯水和淀粉溶液或加入氯水和CCl4溶液。
(3)通过什么反应证明还原性I->Cl-?【提示】Cl2+2KI===I2+2KCl。
(1)氧化性:F2>Cl2>Br2>I2;还原性:I->Br->Cl->F-(2)卤素单质的检验Cl2Br2I2常温下外观黄绿色气体深红棕色液体紫黑色固体常用检验方法①能使湿润的KI淀粉试纸变蓝②能使湿润的蓝色石蕊试纸先变红后褪色能使湿润的KI淀粉试纸变蓝遇淀粉溶液变蓝(3)卤素离子X-(Cl-、Br-、I-)的检验①AgNO 3溶液—稀HNO 3法②氯水—CCl 4法③氯水—淀粉法 溶液――→氯水淀粉溶液溶液变蓝色…I - [对点训练]1.下列叙述中正确的是( )A .碘易升华,所以碘要保存在用铁盖旋紧的试剂瓶中B .液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封C .能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气D .碘易溶于酒精,所以用酒精从碘水中萃取碘B [由保存方法可知道,液溴按B 项所述保存是对的,因液溴易挥发,水封可减缓挥发。
碘易与铁反应(Fe +I 2===FeI 2),可知A 不正确。
所有能与I -反应生成I 2的物质都有此现象,如溴蒸气等,不一定是Cl 2,C 不正确。
酒精与水互溶,不符合萃取剂要求,D 不正确。
]2.甲、乙、丙三种溶液中各含有一种X -(X -为Cl -、Br -或I -),往甲中加入淀粉溶液和氯水,则溶液变为橙色,再往此溶液中加入丙溶液,颜色无明显变化。
则甲、乙、丙依次含有( )A .Br -、I -、Cl -B .Br -、Cl -、I -C .I -、Br -、Cl -D .Cl -、I -、Br -A [往甲中加淀粉溶液和氯水,溶液变橙色,说明甲中含Br -,再加入丙溶液,无明显变化,说明丙中不含I -,应含Cl -,由此可说明乙中含I -。
]溴、碘的提取[(1)从海水中提取溴、碘和海水中提取食盐的原理相同吗?【提示】 不同。
海水提取食盐为物理变化,而溴、碘的提取为化学变化。
(2)从海水中提取溴的过程中,为什么往溴水中鼓入热空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提取溴?【提示】溴具有很强的挥发性,往溴水中鼓入热空气或水蒸气,溴即可挥发出来。
在实验室中可以采用萃取的方法提取溴。
(3)写出海水中的Br-和海植物中I-提取的化学方程式。
【提示】2NaBr+Cl2===2NaCl+Br2;2NaI+Cl2===2NaCl+I2。
(4)从海水中提取溴和碘时操作对象有何不同?为什么?【提示】海水中溴元素(Br-)的含量丰富,从海水中提取溴是直接利用提取粗盐后的母液通入氯气进行处理,而海水中含碘总量虽大,但浓度较低,这给提取带来了麻烦,某些海藻具有富集碘的能力,如海带,因此,利用浸泡液浸泡海带可富集碘,或将干海带灼烧后的灰烬作为提取碘的原料。
(1)从海水中提取溴,一般要经历三个步骤,即浓缩、氧化和提取。
①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2===Br2+2NaCl。
②向含溴单质的水溶液中通热空气或水蒸气,将溴单质吹入盛二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O===2HBr+H2SO4(也可用NaOH 或Na2CO3溶液吸收)。
③向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2===2HCl+Br2。
④用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(2)从海植物中提取I2①用水浸泡海带或海藻灼烧后的灰烬。
②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl2===I2+2NaCl。
③过滤,用有机溶剂萃取碘单质。
④蒸馏I 2的有机溶液得到I 2。
[对点训练] 3.从海带中提取碘单质,成熟的工艺流程如下,下列关于海带制碘的说法,不正确的是( )干海带――→灼烧海带灰――→沸水浸泡悬浊液――→过滤滤液――→H +H 2O 2碘水――→CCl 4I 2的CCl 4溶液――→蒸馏I 2A .实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌B .含I -的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应C .在碘水中加入几滴淀粉溶液,溶液变蓝色D .碘水加入CCl 4得到I 2的CCl 4溶液,该操作为“萃取”A [A 项错误,实验室是在坩埚中灼烧干海带;B 项正确,碘元素化合价升高,发生氧化反应;C 项正确,碘水中有碘单质,能使淀粉显特殊的蓝色;D 项正确,这是一个富集提取的过程,化学上称为萃取。
]4.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:(1)将NaCl 溶液进行电解,在电解槽中可直接得到的产品有H 2、________、________。
(2)步骤Ⅱ用SO 2水溶液吸收Br 2,可制得HBr 和硫酸,该反应中,氧化剂是________(填化学式,下同),氧化产物是________。
(3)写出步骤Ⅲ反应的化学方程式___________________________________ ______________________________________________________________。
【答案】 (1)Cl 2 NaOH (2)Br 2 H 2SO 4(3)Cl 2+2HBr===2HCl +Br 2[当 堂 达 标·固 双 基]1.在盛有KI 溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是( )A .上层紫红色,下层接近无色B.均匀、透明、紫红色C.均匀、透明、无色D.上层接近无色,下层紫红色D[2KI+Cl2===2KCl+I2,碘在四氯化碳中的溶解度大于在水中的溶解度且CCl4的密度比水大,故上层接近无色,下层紫红色(碘在CCl4中的颜色)。
] 2.稀的碘水和溴水的颜色非常浅,近乎无色。
检验稀碘水和稀溴水时,所用的最佳试剂是()A.淀粉溶液B.氯水C.NaOH溶液D.NaBr溶液A[氯水、NaBr溶液与溴水、碘水都不反应,NaOH溶液与二者都反应,二者都褪色,现象相同,不能区分,淀粉遇I2变蓝色。
]3.下列叙述中正确的是()A.液溴易挥发,在存放液溴的试剂瓶中应加水液封B.能使润湿的淀粉-KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层呈紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+A[B项,能氧化KI生成I2的物质不一定是Cl2;C项,CCl4层呈紫色,含有I2;D项,溶液中可能含有SO2-4。