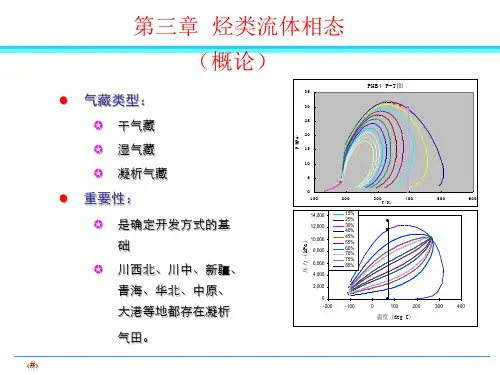
单组分相图
- 格式:ppt
- 大小:184.00 KB
- 文档页数:13


物理化学相平衡知识点相平衡一、主要概念组分数,自由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)二、重要定律与公式本章主要要求掌握相律的使用条件和应用,单组分和双组分系统的各类典型相图特征、绘制方法和应用,利用杠杆规则进行有关计算。
1、相律: F = C - P + n, 其中:C=S-R-R’(1) 强度因素T,p可变时n=2(2) 对单组分系统:C=1, F=3-P(3) 对双组分系统:C=2,F=4-P;应用于平面相图时恒温或恒压,F=3-P。
2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:实验主要是测定系统的相变点。
常用如下四种方法得到。
12对于气液平衡系统,常用方法蒸气压法和沸点法;液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图对于单组分系统C =1,F =C -P +2=3-P 。
当相数P =1时,自由度数F =2最大,即为双变量系统,通常绘制蒸气压-温度(p-T )相图,见下图。
pTlBC AOsgC 'pTlBCA Os gFGD单斜硫pT液体硫BCAO正交硫硫蒸气(a) 正常相图 (b) 水的相图(c) 硫的相图图6-1 常见的单组分系统相图4、二组分系统的相图类型:恒压的t -x (y )和恒温的p -x (y )相图。
相态:气液相图和液-固(凝聚系统)相图。
(1)气液相图根据液态的互溶性分为完全互溶(细分为形3成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p -x (压力-组成)图或恒压下的t -x (温度-组成)图,见图5-2和图5-3。
t = 常数液相线气相线g + llgB Apx B (y B )t = 常数g + l液相线气相线g + llgB Apx B (y B )g + lg + lt = 常数液相线气相线lgBApx B (y B )(a) 理想混合物 (b) 最大负偏差的混合物 (c) 最大正偏差的混合物 图6-2 二组分系统恒温下的典型气液p -x 相图p = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )p = 常数g + l液相线或泡点线气相线或露点线g + llg BAtx B (y B )g + lp = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )(a) 理想或偏差不大的混合物 (b) 具有最高恒沸点(大负偏差) (c) 具有最低恒沸点(大正偏差)B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B最低会溶点B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B DCGFOgg + l g + ll 1 + l 2p = 常数lBAtx B (y B )(d) 有最高会溶点的部分互溶系统 (e)有最高和最低会溶点的部分互溶系统 (f) 沸点与会溶点分离4x B (y B )三相线COD ( l 1 +g + l 2)l 1DC GFOgg + lg + l l 1 + l 2p = 常数l 2B Atx B (y B )三相线COD ( g + l 1 + l 2)g + l 1l 1DC GFOgg + l 2l 1 + l 2p = 常数l 2BAtg + B(l )三相线COD [ A(l ) +g + B(l ) ]DCGFOgg + A(l )A(l ) + B( l )p = 常数BAtx B (y B )(g) 液相部分互溶的典型系统 (h)液相有转沸点的部分互溶系统 (i) 液相完全不互溶的系统图6-3 二组分系统恒压下的典型气液相图(2)液-固系统相图: 通常忽略压力的影响而只考虑t -x 图。

相图分析物理化学复习总结之相平衡f组分数,⾃由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)本章主要要求掌握相律的使⽤条件和应⽤,单组分和双组分系统的各类典型相图特征、绘制⽅法和应⽤,利⽤杠杆规则进⾏有关计算1、相律: F = C - P + n , 其中:C=S-R-R’U+ }3 Q0 G- D4 L$ \6 e- D) l(1) 强度因素T,p可变时n=2/ n) \+ r' I3 G" P5 [3 q* A) f(2) 对单组分系统:C=1, F=3-P j(3) 对双组分系统:C=2,F=4-P;应⽤于平⾯相图时恒温或恒压,F=3-P。
Y% z2 ]7 h' z5 d- X- 2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结⽽成。
(2)实验⽅法:实验主要是测定系统的相变点。
常⽤如下四种⽅法得到。
4 Z r! M- J2 u! s( _. ms 对于⽓液平衡系统,常⽤⽅法蒸⽓压法和沸点法;" A+ d4 S0 D/ v! r液固(凝聚)系统,通常⽤热分析法和溶解度法。
$ l( m3 N$ j5 a" ^3、单组分系统的典型相图对于单组分系统C=1,F=C-P+2=3-P。
当相数P=1时,⾃由度数F=2最⼤,即为双变量系统,通常绘制蒸⽓压-温度(p-T)相图,见下图。
(a) 正常相图(b) ⽔的相图(c) 硫的相图图6-1 常见的单组分系统相图/ ]. g/ W. Y' n* ?" ^# _⼆组分系统的相图j类型:恒压的t-x(y)和恒温的p-x(y)相图。
相态:⽓液相图和液-固(凝聚系统)相图。
5 f% ^( `8 E0 e; h; W! y1 |8 SB(1)⽓液相图根据液态的互溶性分为完全互溶(细分为形成理想混合物、最⼤正偏差和最⼤负偏差)、部分互溶(细分为有⼀低共溶点和有⼀转变温度的系统)和完全不溶(溶液完全分层)的相图。



第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。


5.2 单组分系统的相平衡单组分系统的相数与自由度C =1 f +Φ = 3当Φ = 1 单相 双变量系统当Φ = 2 两相平衡 单变量系统当Φ = 3 三相共存 无变量系统单组分系统的自由度最多为2,双变量系统的相图可用平面图表示。
1、单组分系统的两相平衡——Clapeyron 方程在一定温度和压力下,任何纯物质达到两相平衡时,在两相中Gibbs 自由能相等若温度改变d T ,则压力改变d p ,达新的平衡时根据热力学基本公式,有这就是Clapeyron 方程,可应用于任何纯物质的两相平衡系统设有1 mol 物质,则气-液、固-液和气-固平衡的Clapeyron 方程分别为说明了压力随温度的变化率(单组分相图上两相平衡线的斜率)受焓变和体积变化的影响。
对于气-液两相平衡,并假设气体为理想气体,将液体体积忽略不计,则这就是Clausius-Clapeyron 方程,是摩尔气化焓 假定的值与温度无关,积分得: 利用Clausius -Clapeyron 方程的积分式,可从两个温度下的蒸气压,求摩尔蒸发焓变。
或从一个温度下的蒸气压和摩尔蒸发焓,求另一温度下的蒸气压。
2、水的相图水的相图是根据实验绘制的三个单相区 在气、液、固三个单相区内,Φ = 1, f =2 ,温度和压力独立地2=f 1=f 0=f 12G G =12d d G G =1122d d d d S T V p S T V p -+=-+2121d d S S V H T T VV p ∆==-∆-d d p H T T V∆=∆vap m vap m d d H p T T V ∆=∆fus m fus m d d H p T T V ∆=∆sub m sub m d d H p T T V ∆=∆vap m d d (g)H p T TV ∆≈vap (/)H T nRT p ∆=vap m 2d ln d H p T RT ∆=vap m 211211ln ()H p p R T T ∆=-m Vap H ∆m Vap H ∆有限度地变化不会引起相的改变。