八、单组分体系相图
- 格式:pdf
- 大小:866.43 KB
- 文档页数:32




第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。

第5章 相平衡复习、讨论基本内容:➢ 相:体系内部物理性质和化学性质完全均匀的一部分。
气相、液相、固相 ➢ 相数:体系内相的数目Φ≥1➢ 相图:描述多相体系状态随浓度、温度、压力等变量的改变而发生变化的图形➢ 均相体系:只有一相的体系Φ=1 ➢ 多相体系:含多相的体系Φ>1➢ 凝聚体系:没有(或不考虑)气相的体系 ➢ 物系点:相图中表示体系总组成的点 ➢ 相点:表示某一个相的组成的点➢ 液相线:相图中表示液相组成与蒸气压关系的曲线 ➢ 气相线:相图中表示气相组成与蒸气压关系的曲线 ➢ 步冷曲线:冷却过程温度随时间的变化曲线T-t➢ 独立组分数:C = S - R - R',S 为物种数,R 为体系中各物种之间独立的化学平衡关系式个数,R’为浓度和电中性限制条件的数目。
对于浓度限制条件,必须是某个相中的几种物质的浓度之间存在某种关系时才能作为限制条件。
C=1单组分体系,C=2二组分体系。
若没有化学变化:C=S ;含单质的体系且R ’=0:C=N ;含单质的体系且S>N :R = S – N 。
➢ 自由度:确定平衡体系状态所需要的独立强度变量的数目f ≥0➢ 最低(高)恒沸点:对拉乌尔定律正(负)偏差很大的双液系的T —x 图上的最低(高)点。
恒沸点时气相组成与液相相同,具有纯物质的性质,一定压力下恒沸混合物的组成为定值(f*=C-Φ+1=1-2+1=0)。
➢ 最低(高)恒沸混合物:最低(高)恒沸点对应的混合物。
恒沸物是混合物而不是化合物➢ 会溶温度(临界溶解温度):部分互溶双液系相图上的最低点或最高点 ➢ 转熔温度:不稳定化合物分解对应的温度➢ 共轭层:部分互溶双液系相图上的帽形区内溶液为两层➢ 相律:平衡体系中相数、独立组分数与变量数之间的关系f = C - Φ + n ➢ 杠杆规则:液相的物质的量乘以物系点到液相点的距离,等于气相的物质的量乘以物系点到气相点的距离。
Bn BBn n l ×(X B -x B )=n g ×(y B -X B )单组分体系相图(p-T):水、CO 2、C二组分体系相图(T-x):液-液体系:简单的低共熔混合物形成化合物稳定的化合物不稳定的化合物形成固溶体完全互溶固溶体部分互溶固溶体有一低共熔点有一转熔温度完全互溶理想的非理想偏差不很大正偏差很大 负偏差很大部分互溶具有最高会溶温度具有最低会溶温度同时有最高和最低会溶温度没有会溶温度不互溶液-固体系:基本要求:1. 明确基本概念(相、相数、组分数、自由度;S 、R 、R ’、f 、C 、Φ)2. 能熟练运用相律f=C-Φ+n (n 通常为2,在限制T 或p 时<2,也可能>2,见后面例题“NaCl 水溶液与纯水达成渗透平衡”)3.会用杠杆规则(适用于任何两相区)求两相平衡体系中两相的组成和量4.熟悉二组分体系的相图(会确定图中点、线、面的相态、相数、自由度等)5.熟悉相图规律、基本相图➢两相区的两侧是两个不同的单相区,两相区包含的两种相态就是两个单相区的相态➢三相线的两端分别顶着两个单相区、中间与另一个单相区相连➢在临界点以下,任何两个相数相同的相区都不可能上下相邻(相区交错规则)6.能够由步冷曲线画相图,或由相图画步冷曲线(相图中的两相平衡线与步冷曲线的转折点对应;三相线与步冷曲线的平台对应)。




研究一个多组分(或单组What?
研究个多组分(或单组分)多相体系的平衡状态随温度压力组分浓度随温度、压力、组分浓度等变化而改变的规律。
相图/平衡相图/Phase Diagram
1.判断系统在一定热力学条件下所
趋向的最终状态;Why?
2.正确选择配料方案3
3.
确定工艺制度4.合理分析生产过程中的质量问题5.新材料的研制
1
相关的基本概念
•Gibbs 相律
-=n
c f +φ自由度数
相数
外界因素
独立组分数
2
第九章单组分相图
3
单元系统相图
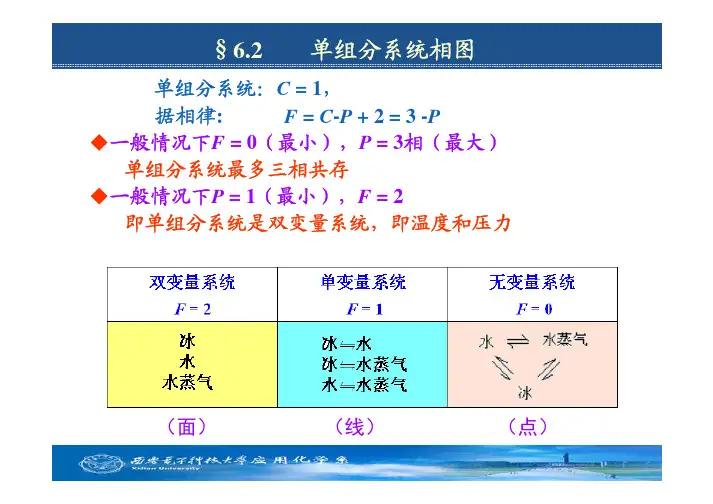
单元系统:c=1
相律
c -=+-=32p
p f 温度压力温度、压力2,1max min ==f p 不可能出现4相3
,0max min ==p f 或更多相平衡
4
斜率为负值
H dP ∆冰的熔融曲线V T dT ∆=
f=0,无变量冰融化吸热:∆H>0体积收缩:∆V<0
的饱汽曲线点:三相点水型物质
水的饱和蒸汽压曲线(蒸发曲线)
273.16o C, 0.61Kpa 硫型物质冰的饱和蒸汽压曲线
(升华曲线)
中冰、水、汽三相平衡
个自由度:温度、压力
5
•水的相图
()
•(1)OC线斜率为负:
即随着压力的增加,
水的熔点将降低;
6
这是由于克拉贝龙方程:
∆H dP 水
冰→∆=
,m m
f V T dT
2)熔点随压力的变
化而变化:外压剧
化变化外压剧
增,冰的熔点仅略
有降低,大约是每
增加1atm,熔点
下降0.0075℃。
8
3)三相点与冰点的区别:冰点是指敞露于空气中的冰~水平衡温度。
1)冰~水已被空气中的气体组分饱和使水的冰点降水度分饱和,使水的冰点下降0.00242℃;
2)压力从0.61kPa 增大到101.325kPa ,冰点温度又降低0.00747℃;
0.00989℃即共降低,使得水的冰点从原来的三相点处即0.00989℃0℃下降到通常的(或273.15K )。
9
4)临界点、临界
状态:水的蒸
气压曲线OA
向右上不能无
限地延伸,只
能延伸到:
374 C,220atm 。
此点以外,汽-水分界
面不再能确定,液体水不能存在。
面不再能确定液体水不能存在
10
5)同质多晶现象:OC线向上可延伸到2000 atm和-20︒C左右,如果压力再高,则将出
左右如果压力再高则将出现其它的固态冰晶型了。
11
12
6)OB线向左下可延
伸到无限接近绝
对零度。
•根据克拉贝龙方程冰
程,冰-汽平衡曲
线符合:
∆K
RT H P m
v +-=ln 时即•当T →0时,ln P →-∞,即P →0,
)
7)过冷水:OA
线往左下延伸
至相点以下
至三相点以下
的OF线是可能
的,这时的水
为过冷水。
•OF线为不稳定的液-汽平衡线(亚稳态)。
•从图中可以看出,OF高于OB线,此时水的饱从图中可以看出线此时水的饱
和蒸气压大于同温下的冰的饱和蒸汽压
和蒸气压大于同温下的冰的饱和蒸汽压。
15
•即过冷水的化学势高于同温度下冰的化学势,只要稍受外界因素的干扰(如振动或有小冰块或杂质放入),立即会出现冰。
有小冰块或杂质放入)立即会出现冰
16
过热冰
(8)过热冰?
“点延伸因为不存在•OB线向右上不能超过O”点延伸,因为不存在过热冰
过热冰。
17
•冰→水,熵增过程,混乱度增加过程,无时间滞后,所以不存在过热冰。
•水→冰,熵减过程,有序度增加过程,有可能时间滞后,所以存在过冷水。
能时间滞后以存在过冷水
18
硫的相图
三个三相点:
A(正,单,g),
B(单,l, g),
C(正,单,液)
l)的三相点
而缺少(正l, g)的三相点。
19
•AG段为过热正交硫
的蒸气压曲线
•CG段为过热正交硫的熔
化曲线,极易变成单斜
硫。
•BG段为过冷液硫的蒸气
压曲线。
•均易形成单斜硫。
20
可逆和不可逆多晶转变的单元相图
4个单相区
晶型II 熔融曲线
熔体的汽曲线晶型转变线
熔体的蒸汽压曲线
3相平衡点:晶型II 、晶型II 的升华曲线
熔体和气相
晶型I 的升华曲线
3相平衡点:晶型I 、晶型II 和气相
21
BFGH :过热晶型I 的介稳单相区HGCE :过冷熔体的介稳单相区
介稳两相平衡过热晶型I熔融曲线
G :介稳三相点
crystal II
G
KBF :过冷晶型II 的介稳单相区
BG:过热晶型I升华曲线
GC :过冷熔体蒸汽压曲线
BGC 和ABK :过冷蒸汽的介稳单相区
KB :过冷晶型II 蒸汽压曲线
图中虚线表示系统中可能出现的介稳平衡状态22
特点:晶型转变温度低于二
个晶相的熔点晶型过热晶型β蒸汽压曲个晶相的熔点,晶型转变温度点处在稳定相区之内。
线与过冷熔体蒸汽压曲线的交点:
晶型β的熔点
G C
转变关系为:
B
晶型α的熔点
L
⇔⇔αβ可逆转变
晶型β和晶型α可逆多晶转变的单元相图
的转变点
23
特点:晶型转变温度高于二
个晶相的熔点晶型晶型β和α的转变点个晶相的熔点,晶型转变温度点处在稳定相区之内。
实际上不能得到点3晶型α的熔点
31
2
转变关系为:
L
晶型β的熔点
⇔βα
不可逆转变
不可逆多晶转变的单元相图
24
SiO 2系统
介稳状态实例6个单相区、9条界线、4个三相点
实例:
硅砖蒸汽
不希望
磷石英含量多方石英含量少
解决的方法:硅砖的原料
加入矿化剂CaO 、Fe 2O 325
26
SiO2多晶转变时的体积变化
27
重构型相变与位移型相变
28
ZrO 2系统
3个晶型
稳定立方化ZrO 2
加入矿化剂CaO Y O :形成立和23形成方晶型的固溶体
冷却过程中,四方ZrO 2往往不在1200︒C 转变成单斜ZrO 2,而在1000︒C 转变成稳定的单斜ZrO 2
29
7%~9%
体积效应7%9%
30
31
32。