物理化学4-1-相律及单组分系统相图
- 格式:pdf
- 大小:717.93 KB
- 文档页数:21




第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。





第二节单组分系统相图克拉佩龙方程与单组分系统相图是相平衡的重要组成部分,从理论指导化工生产,例如干冰制备,升华操作,减压蒸馏等。
制药过程中常采用冷冻干燥工艺是将含水物料在低温条件下冷冻成微小颗粒,然后减压直接让水升华,从而制得细颗粒的粉剂。
此工艺的关键是要控制好系统的温度和压力。
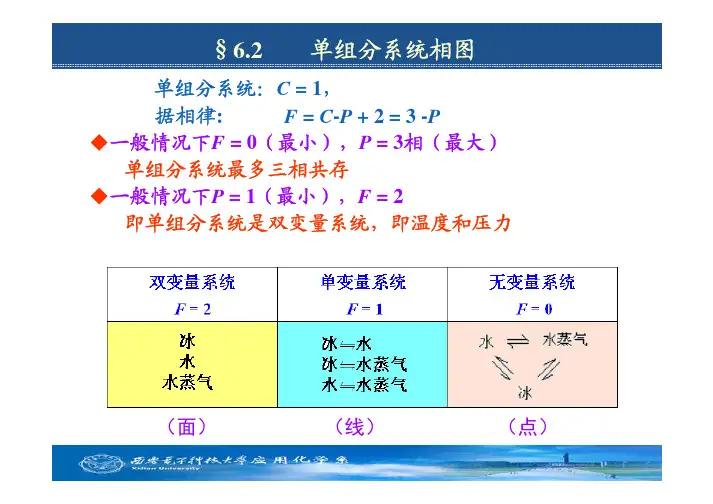
一、单组分系统相律分析对于单组分系统,其组分数K=1,根据相律有f=K-Φ+2=3-Φ因此,单组分系统自由度为零时,最多可有三相平衡共存。
相数最少为一相,此时,系统自由度最大,为2,即温度和压力。
三、单组分系统的相图表示相平衡关系的图称为相图。
1.相图的绘制以水为例,根据实验结果绘制的水的相图(示意图)2.水的相图及分析(1) 区:(单相区)气相区(AOB)液相区(AOC)和固相区(COB)。
各相区中,相数Φ=1,由相律得f=2。
即在这三个区域,可以在一定范围内,任意改变温度或压力,不会引起相变化。
(2)线:(两相平衡线)OA线是水和水蒸气的两相平衡线,即是水的饱和蒸气压曲线。
OB线是冰和水蒸气的两相平衡线,即是冰的升华压(蒸气压)曲线。
(蒸气压的概念)OC线是冰和水的两相平衡线,即是冰的熔点(水的凝固点)曲线。
由于是两相平衡共存,相数Φ=2,由单组分系统相律分析f=3-2=1(3)点(三相点)O点是三条两相平衡线的交点,称为三相点。
在该点三相平衡共存。
Φ=3,由相律得f=0。
这说明三相点的温度和压力为一固定值(273.16K,610.6Pa),不能改变,否则就会引起相变的发生。