人名反应 吲哚合成方法大全
- 格式:docx
- 大小:350.83 KB
- 文档页数:3

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
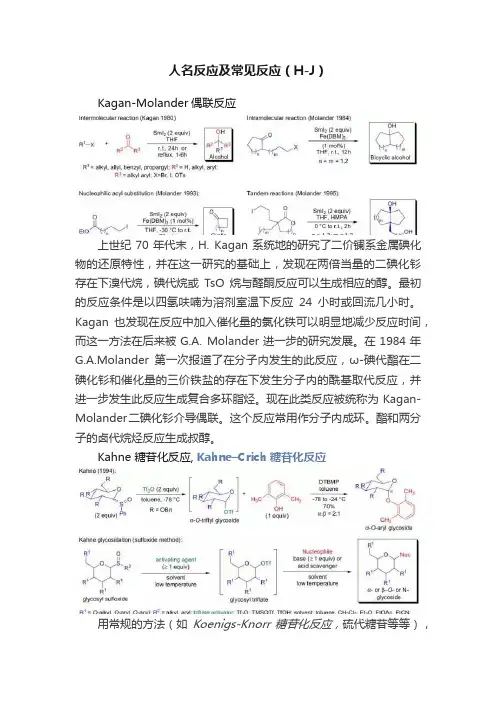
人名反应及常见反应(H-J)Kagan-Molander偶联反应上世纪70年代末,H. Kagan系统地的研究了二价镧系金属碘化物的还原特性,并在这一研究的基础上,发现在两倍当量的二碘化钐存在下溴代烷,碘代烷或TsO烷与醛酮反应可以生成相应的醇。
最初的反应条件是以四氢呋喃为溶剂室温下反应24小时或回流几小时。
Kagan也发现在反应中加入催化量的氯化铁可以明显地减少反应时间,而这一方法在后来被G.A. Molander进一步的研究发展。
在1984年G.A.Molander第一次报道了在分子内发生的此反应,ω-碘代酯在二碘化钐和催化量的三价铁盐的存在下发生分子内的酰基取代反应,并进一步发生此反应生成复合多环脂烃。
现在此类反应被统称为Kagan-Molander二碘化钐介导偶联。
这个反应常用作分子内成环。
酯和两分子的卤代烷烃反应生成叔醇。
Kahne 糖苷化反应, Kahne–Crich糖苷化反应用常规的方法(如Koenigs-Knorr糖苷化反应,硫代糖苷等等),从位阻较大的糖或活性较低的糖制备糖苷是很困难的。
直到1989年,D.Kahne及其课题组发现了一种新的制备糖苷的方法,他们将糖基亚砜和三氟甲磺酸酐溶于甲苯中,降至低温,加入一些亲核试剂(如醇,酚或胺)的甲苯溶液,反应得到相应的O-或N-糖苷。
可以在没有邻基参与的情况下可以得到α-立体选择性的产物或在没有化学助剂的情况下得到β-立体选择性的产物。
通过活化的糖基亚砜制备高立体选择性的O-, S-,或N-糖苷的反应被称为Kahne糖苷化反应(亚砜法)。
Keck自由基烯丙基化反应G.E. Keck及其团队在全合成perhydrohistrionicotoxin的过程中,遇到了将卤素置换为烯丙基的问题,他们通过卤代烃和烯丙基三丁基锡进行自由基反应很好的解决了此难题。
此反应在催化量的AIBN作为自由基引发剂在80℃的苯中进行。
此报道之后,卤代烃和烯丙基三丁基锡在自由基条件下偶联烯丙基化的反应被称为Keck自由基烯丙基化反应。

吲哚的合成方法
嘿,朋友们!今天咱就来唠唠吲哚的合成方法。
这吲哚啊,可是个很有意思的东西呢!
你想想看,就好像搭积木一样,我们要把各种小零件巧妙地组合在一起,才能搭出我们想要的吲哚这个“小城堡”。
先说一个常见的方法,就像做菜一样,我们有了各种食材,通过一定的步骤就能做出美味佳肴。
比如费歇尔合成法,把苯肼和醛或酮放在一起,经过一系列反应,嘿,吲哚就慢慢出现啦!这就好像魔法一样神奇,不是吗?
还有一种方法呢,就像是走一条特别的小路。
通过邻硝基乙苯的反应,经过一些奇妙的变化,也能得到吲哚呢。
你说这是不是很有趣?就好像在一个神秘的化学世界里探险一样。
再说说从苯胺出发的方法,这就好比是从一个起点出发,沿着特定的路线前进,最终到达吲哚这个目的地。
这一路上啊,有各种反应和变化,就像我们在旅途中会遇到不同的风景一样。
有时候我就在想啊,这合成吲哚的过程,不就跟我们生活中的很多事情一样嘛。
需要耐心,需要技巧,还需要那么一点点运气。
就像我们要做成一件大事,得一步一个脚印,精心准备,才能迎来最后的成功。
而且啊,研究吲哚的合成方法,就像是打开了一扇通往奇妙世界的大门。
你能看到各种化学反应在那里奇妙地发生,就像一场精彩的演出。
咱可不能小瞧了这些合成方法,它们可是科学家们经过无数次尝试和探索才找到的呢。
就好像我们在生活中不断努力,才能找到属于自己的成功之路。
总之呢,吲哚的合成方法充满了神奇和魅力,让我们一起在这个化学的世界里尽情探索吧!不用去管什么复杂的步骤和困难,只要我们有热情,有好奇心,就一定能发现更多关于吲哚的奥秘!这就是我想说的,朋友们,你们觉得呢?。

经典化学合成反应标准操作吲哚的合成目录2. Fischer 吲哚合成 (2)2.1 Fischer 吲哚合成反应示例 (2)3. 从硝基苯的衍生物出发合成吲哚 (3)3.1 邻甲基硝基苯衍生物合成吲哚 (4)3.1.1 邻甲基硝基苯衍生物合成吲哚示例 (4)3.2 邻甲酰基硝基苯衍生物合成吲哚 (4)3.1.2 邻甲酰基硝基苯衍生物合成吲哚示例 (5)3.3 邻氰甲酰基硝基苯衍生物合成吲哚示例 (5)3.4 邻乙烯基硝基苯衍生物合成吲哚示例 (6)3.5 邻位有氢的硝基苯衍生物直接用乙烯格氏试剂合成吲哚(Bartoli反应)示例74. 从苯胺的衍生物出发合成吲哚 (7)4.1苯胺经佛克烷基化再还原关环合成吲哚 (7)4.2 N-羟基苯胺DMAP催化下与丙炔酸酯缩合合成3-羧酸吲哚衍生物 (9)4.3 Nenitzescu吲哚合成 (9)5. 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物 (10)5.1 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物示例 (11)1. Introduction吲哚及其衍生物是一类非常有效的药物中间体。
已有不少相关综述报道其合成方法1。
我们将一些常用的合成方法简单的列举了出来,供大家在合成此类化合物的时候参考。
1 (a) G. W. Gribble, Contemp. Org. Synth., 1994, 145. (b) U. Pindur and R. Adam, J. Heterocycl. Chem., 1988, 25, 1. (c) C. J. Moody, Synlett , 1994, 681. (d) R. J. Sundberg, Indoles , Academic Press, San Diego, CA, 1996. (e) T. L. Gilchrist , J. Chem. Soc., Perkin Trans. 1, 1999, 2849. (f) G. W. Gribble, J. Chem. Soc ., Perkin Trans. 1, 2000, 1045.2. Fischer 吲哚合成Fischer 吲哚合成法是一个常见的吲哚合成方法。

常见吲哚合成反应汇总旧文重发,温故知新一、2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物通过叠氮基乙酸酯与芳香醛缩合可以得到 2-叠氮基-3-芳基丙烯酸酯,其加热环合生成吲哚2-羧酸酯衍生物,一般而言只有富电子的芳环(带推电子苯环,呋喃,噻吩,吡咯)可通过该方法环合。
由于反应放出氮气,在环合时一定要严格控制2-叠氮基-3-芳基丙烯酸酯滴加速度及反应瓶敞口,否则很容易喷发出来。
(Hemetsberger indole synthesis)二、Bartoli吲哚合成反应1989年,意大利化学家G. Bartoli等人报道了取代硝基苯和过量的格氏试剂在低温下反应,然后在水溶液中后处理得到取代吲哚,邻取代的硝基苯产率很高。
由邻取代的硝基苯(或亚硝基苯)和烯基格氏试剂制备7-取代吲哚的反应被称为Bartoli吲哚合成法。
在这反应被开发之前,其实有很多用于合成吲哚骨架的类似反应,如Leimgruber-Batcho吲哚合成,在这些反应中,确唯独没有一种能够合成7位取代吲哚的反应,此反应是制备 7-取代吲哚的较好方法。
Bartoli 吲哚合成的优点在于这个反应可以在碳环和杂环上都引入取代基。
三、Batcho–Leimgruber吲哚合成反应邻硝基甲苯类化合物和甲酰胺缩醛(如DMFDMA)缩合得到trans-β-二烷基胺基-2-硝基苯乙烯,接着还原得到吲哚类化合物的反应。
此反应原料邻硝基甲苯(衍生物)易得,反应条件温和,产率较高,因此常用作Fischer吲哚合成的替代方法。
还原方法一般通过加氢,但当分子内有敏感官能团(比如:Br,I都可或烯烃等)存在时可通过化学还原如:NH2NH2-RaneyNi, 铁粉,TiCl3, 锌粉还原得到吲哚。
四、Bischler–Möhlau吲哚合成反应α-芳胺基酮和过量的芳香胺环化得到2-芳基吲哚的反应。
五、Cadogan–Sundberg吲哚合成Cadogan反应是指邻硝基苯乙烯1或邻硝基芪类化合物和亚磷酸三酯或三烷基膦反应生成氮宾2,接着环化生成吲哚3的反应。

吲哚及其衍生物的合成和性质吲哚是一种含氮的芳香化合物,分子结构中含有一个五元环和一个侧链。
它是一种无色晶体,极易溶于有机溶剂,常用于有机合成反应中。
吲哚及其衍生物具有多种生物活性,如抗肿瘤、抗炎、抗菌、抗寄生虫等,因此在药物研究和医学领域中具有广泛的应用价值。
一、吲哚的合成方法1. Strecker合成法:用亚磷酸氢钠和氰化铁作为氮源,沸腾的环丙酮经过氰化、如下:2. Skraup合成法:将苯、甲酸和浓硫酸混合反应,生成薄荷醛,之后与苯胺反应生成吲哚3. Fischer合成法:将苯并甲酸酐和甲磺酸反应,生成甲苯磺酸酐,将其加热后与苯胺反应生成吲哚。
上述三种方法是制备吲哚的常用方法。
相比之下,Skraup合成法和Fischer合成法的产率较高,但存在环境污染和反应条件苛刻的问题。
二、吲哚的性质1. 化学性质吲哚具有类似苯的化学性质,如下:(1)芳香性:吲哚中的五元环含有4个π电子,可以形成稳定的芳香环结构;(2)亲电取代反应:可以进行取代反应,如硝化、氢化、卤代等反应;(3)求核取代反应:可以进行求核取代反应,如酰化、磺化、醚化等反应。
2. 生物学性质吲哚及其衍生物是研究的热点之一,具有多种生物活性,如下:(1)抗肿瘤活性由于吲哚分子结构中含有特定的分子基团,如双键、芳香环和取代基团等,使其可用于治疗肿瘤。
例如,病毒胸腺嘧啶(IBT)是一种吲哚衍生物,具有抗癌活性,在人类肝癌和肺癌中显示出显著的抑制作用。
(2)抗炎活性吲哚和其衍生物在体内具有抗炎活性,如抑制白细胞介素-1的表达和细胞因子产生,降低炎症反应的程度。
吲哚-3-醋酸和吲哚-3-甲酸是两种经常被用于抗炎治疗的吲哚衍生物。
(3)抗菌和抗寄生虫吲哚和其衍生物具有很好的抗菌和抗寄生虫活性,特别是在鱼类疾病治疗中具有广泛应用。
例如,吲哚-3-甲酸酯在低浓度下具有杀灭金黄色葡萄球菌和大肠杆菌的作用;在高浓度下,可杀灭对贝类产生的一些寄生虫。
三、吲哚衍生物的合成1. N-烷基吲哚的合成N-烷基吲哚是一类重要的化合物,在药物合成中具有很大的应用价值。

吲哚一词来源于印度的英文单词(India ):在十六世纪从印度进口的蓝色染料被称作靛篮。
将此染料化学降解可得到氧化的吲哚-吲哚酚和羟基吲哚。
吲哚在1866年通过在锌粉作用下蒸馏羟基吲哚第一次被制备出来。
吲哚可能是自然界中分布最广的杂环化合物。
色氨酸是必需的氨基酸,也是大多数蛋白质的组成部分。
它还可作为各种色胺、吲哚和2,3-二氢吲哚的生物合成前体。
2N H NH 2在动物中,存在于血液中的5-羟基色胺(5-HT )是中枢神经系统中非常重要的神经递质,在心血管和胃肠道中也起很大作用。
结构类似的激素褪黑素被认为能控制生理功能的昼夜节律。
NNH 2OH N H NHAcCH 3O植物王国中色胺酸衍生物包括3-吲哚基乙酸,它是一种有效的植物生长调节激素;以及大量不同结构的二级代谢产物-吲哚类生物碱,这一类化合物由于其有效的生理活性被广泛作为药物使用。
吲哚的结构单元也大量出现在许多人工合成的药物中,如具有消炎镇痛作用的环氧酶抑制剂吲哚美辛,止吐作用的5-HT 3受体拮抗剂昂丹司琼等。
NCH 3CH 3OOClCOOHNHON NMe由于吲哚在天然产物全合成和药物合成中的重要性,有机合成领域不断有大量关于吲哚环的全新合成方法和改进方法出现,已经形成了一个相当系统的合成框架,以下是一些目前可行的最重要的合成方法及示例。
1.通过醛和酮的苯腙的制备方法 (1) Fischer 合成法Fischer吲哚合成法发明于1883年,利用苯腙在酸或Lewis酸催化下通过重排反应,亲核关环,再消除氨而形成吲哚环N H NCH3NHPh1事实上,有时将醛或酮与苯肼在乙酸中一起加热即可发生“一锅煮”的反应2,生成的苯腙可不经分离直接发生重排反应。
甲基苯磺酸、阳离子交换树脂及三氯化磷都可有效地催化环化反应,有时在室温或更低的温度下反应也可进行3。
苯环上的供电基能提高Fischer环化反应的速率,而吸电基则降低反应速率。
但带有硝基的苯腙在合适的酸和反应条件下也可较好地发生反应,如甲苯与多聚磷酸的两相混合物4或三氟化硼的乙酸溶液5。

1.Hunsdriecke反应:羧酸银盐和溴或碘反应;脱去二氧化碳;生成比原反应物少一个碳原子的卤代烃..2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下;将芳香重氮盐转化成卤代芳烃..3.Gattermann反应:将上面改为铜粉和氢卤酸..4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐;或芳胺直接用亚硝酸纳和氟硼酸进行重氮化;此重氮盐再经热分解有时在氟化钠或铜盐存在下加热;就可以制得较好收率的氟代芳烃..5.Williamson合成:醇在碱钠;氢氧化钠;氢氧化钾存在下与卤代烃反应生成醚..6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺;利用氮上氢的酸性;先与氢氧化钾生成钾盐;然后与卤代烃作用;得N-烃基邻苯二甲酰亚胺;肼解或酸水解即可得纯伯胺..7.Delepine反应:用卤代烃与环六亚甲基四胺乌洛托品反应得季铵盐;然后水解可得伯胺..8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化;得各类胺..9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物..10.Friedel-Crafts反应:在三氯化铝催化下;卤代烃及酰卤与芳香族化合物反应;再环上引入烃基及酰基..11.Meerwein芳基化反应:芳基自由基可与烯反应;引致烯键的碳原子上..12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应;得到联苯..方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺;在经水解则得具有羟基或烷氧基的芳香酮..14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应..15.Vilsmeier-Haack反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下;在芳核或杂环上引入甲酰基..16.Rimer-Tiemann反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应..17.Claisen反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合..若两个酯在同一分子之内;在上述条件下可发生分子内缩合;得环状β-酮酸酯;此反应称为Dieckmann反应..18.Aldol缩合:含有α-活泼氢原子的醛或酮;在碱或酸的催化下发生自身缩合;或与令一分子的醛或酮发生缩合;生成β-羟基醛或酮类化合物..该类化合物易脱水生成α;β-不饱和醛酮..19.Claisen-Schimidt反应:芳醛与含有α-活泼氢的醛、酮之间的缩合..芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应..20.Tollens缩合:甲醛在碱的催化下;可与含有α-活性氢的醛、酮进行醛醇缩合;在醛、酮的α-碳原子上引入羟甲基;产物是β-羟基醛或其脱水物——α;β-不饱和醛酮..21.Cannizzaro反应:22.Robinson环和:酯环酮与α;β-不饱和酮的共轭加成产物所发生的分子内缩合反应;可以再原来环结构基础上在引入一个环..23.Prins反应:烯烃与甲醛或其他醛在酸催化下加成而得1;3-丙二醇或其环状缩醛1;3-二氧六环及α-烯醇的反应..安息香缩合:芳醛在含水乙醇中;以氰化钾为催化剂;加热后发生双分子缩合生成α-羟基酮的反应..24.Reformatsky反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α;β-不饱和酸酯的反应..25.Grignard反应:由有机卤素化合物卤代烃、活性卤代芳烃等与金属镁在无水乙醚存在下生成格式试剂;后者在与羰基化合物醛、酮等反应而得相应的醇类的反应..26.Blanc反应:芳烃在甲醛、氯化氢及无水二氯化锌三氯化铝、四氯化锡或质子酸等缩合剂的存在下;在芳环上引入卤烷基--CH2Cl的反应..27.Mannich反应:具有活性氢的化合物与甲醛或其他醛、胺进行缩合;生成胺甲基衍生物的反应..28.Pictet-Spengler反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1;2;3;4-四氢异喹啉的反应..29.Strecker反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨或胺类作用生成α-氨基腈;再经酸或碱水解得到dl-α-氨基酸类的反应..30.Michael反应:活性亚甲基化合物和α;β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合;生成β-羰烷基类化合物..31.Wittig反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应;醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代;生成相应的稀类化合物及氧化三苯膦;此类反应称为羰基稀化反应..32.Horner反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应..33.Knoevenagel反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下;与醛、酮发生醛醇型缩合;脱水得α;β-不饱和化合物的反应..34.Stobbe反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下;与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应..常用碱性试剂有醇钠;叔丁醇钾;氰化钠和三苯甲烷钠等35.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合;生成β-芳基丙烯酸类化合物的反应..36.Darzens缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α;β-环氧羧酸酯的反应..37.Diels-Alder反应:共轭二烯烃与烯烃、炔烃进行环加成;生成环己烯衍生物的反应..38.Wagner-Meerwein重排:在质子酸或lewis酸催化下生成的碳正离子中;烷基、芳基、或氢从一个碳原子通过过渡态;迁移至相邻带正电荷碳原子的反应..39.Pinacol重排:在酸催化下;邻二叔醇失去一分子水;重排成醛或酮的反应..40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排;生成α-羟基乙酸盐..41.Fovorski重排:α-卤代酮在碱氢氧化钠;醇钠;HNRR’催化下脱去卤原子;重排为羧酸或其衍生物的反应..42.Wolff重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应..烯酮经进一步反应;生成羧酸、酯、酰胺或酮..43.Arndt-Eistert反应:酰氯与重氮甲烷反应得α-重氮酮;再经Wolff重排;生成比原来酰氯多一个碳原子的羧酸..44.Beckmann重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应..45.Hofmann重排:氮上无取代基的酰胺用卤素溴或氯及碱处理;脱羧生成伯胺的反应..由于产物比反应物少一个碳原子;所以又称为Hofmann降解..46.Curtius重排:酰基叠氮化合物加热分解生成异腈酸酯的反应..47.Schmidt反应:在酸催化下;酸和酮或醛与氨或叠氮化钠反应生成伯胺、酰胺或腈的反应..48.Baeyer-Villiger氧化:在酸催化下;醛或酮与过氧酸作用;在烃基与羰基之间插入氧生成酯的反应..49.Stevens重排:α-位上具有吸电子基Z的季铵盐在强碱作用下;脱去一个α活泼氢生成叶立德;然后季氮上的烃基进行分子内1;2-迁移;生成叔胺的反应..50.Sommelet-Hauser重排:苄基季铵盐在强碱催化下;重排成邻位烃基取代的苄基叔胺的反应..51.Wittig重排:醚类化合物经强碱处理;分子中一个烃基发生迁移;生成醇的反应..52.Claisen重排:烯醇或酚的烯丙基醚加热;通过3;3-σ迁移使烯丙基自氧原子迁移到碳原子上的反应..53.Cope重排:1;5-二稀连二烯丙基经过3;3-σ迁移;异构化成另一双烯丙基衍生物的反应..54.Fischer吲哚合成:醛或酮的芳腙在适当催化剂存在下;脱氨基生成吲哚类化合物的反应..55.Oppenauer氧化:仲醇与丙酮在烷氧基铝存在下一起回流;将仲醇氧化成酮..56.Dakin反应:在芳香醛中;当醛基的邻、对位有羟基等供电子基团时;与有机过氧酸反应;醛基经甲酸酯阶段;最后转换成羟基..57.Sharpless环氧化反应:58.Wacker反应:在氯化钯、氯化铜存在下;利用空气中的氧气使烯烃转化成醛或酮的过程..59.Birch还原:芳香族化合物在液氨中用钠还原;生成非共轭二烯的反应..60.Clemmensen反应:在酸性条件下;用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应..61.Wolff-кижер-黄鸣龙还原反应:醛酮在强碱条件下;与水合肼缩合成腙;进而放氮分解转化成甲基和亚甲基的反应..62.Meerwein-Ponndorf-Verley反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热;可还原得到相应的醇;同时将异丙醇氧化成丙酮..63.Leuckart反应:在甲酸及其衍生物存在下;羰基化合物与氨、胺的还原胺化反应..64.Rosenmund反应:酰卤在适当的反应条件下;用催化氢化或金属氢化物选择性的还原为醛的反应..65.Bouveault-Blanc反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇;主要用于高级脂肪酸酯的还原..66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应;生成α羟基酮..67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等;均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物..68.Heck反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C偶联反应..69.Suzuki交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃..。

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。

吲哚酮的合成方法吲哚酮是有机化学中一种重要的多环芳香酮化合物,具有很高的研究和应用价值。
它是合成其他重要有机化合物的关键中间体,特别是在药物合成中扮演着重要角色。
本文将介绍吲哚酮的一些常见的合成方法,希望能够为有机化学领域的研究者和学生提供一些指导和启发。
一、吲哚酮的经典合成方法1. 化合物重排法:吲哚酮的合成最早可以追溯到19世纪末和20世纪初,这是通过化合物重排法实现的。
该方法一般是通过氧化还原反应、脱水反应或氢化反应等将适当的前体化合物转化为吲哚酮。
2. 环化反应法:另一种常用的合成方法是通过环化反应合成吲哚酮。
其中一种经典方法是通过酮酸类化合物的环化反应,如用二羟基酮酸链延长环状结构的合成方法。
这种方法相对简单,而且适用范围广。
二、吲哚酮的最新合成方法1. 催化合成方法:近年来,随着有机催化技术的迅速发展,吲哚酮的催化合成方法成为研究热点之一。
例如,Pd催化的吲哚化反应具有高效、高选择性和广谱性的特点,成为合成吲哚酮的有力工具。
2. 天然产物合成方法:吲哚酮也可以通过天然产物合成方法合成,通常使用具有吲哚酮结构的天然化合物作为起始物。
这种方法的优点是可以利用天然产物丰富的结构多样性,降低合成难度和成本。
三、吲哚酮的应用1. 药物合成:吲哚酮是合成药物和生物活性分子的重要中间体。
许多药物分子中含有吲哚酮结构,如阿司匹林、吲哚类抗生素等。
通过合理设计和合成吲哚酮中间体,可以有效提高药物的产量和活性。
2. 光电材料:吲哚酮及其衍生物也具有良好的光电性能,被广泛应用于有机发光二极管(OLED)、有机太阳能电池等光电器件中。
其合理设计和合成方法对于开发高性能光电材料具有重要意义。
综上所述,吲哚酮的合成方法涵盖了许多经典和最新的化学反应和合成策略。
研究者可以根据具体需要选择适合的方法,合成吲哚酮化合物,并通过进一步的结构改造和修饰,发展出更多具有特定功能和应用的有机化合物。
希望本文能够为有机化学研究和应用提供一些有益的指导和启发。
人名反应1氧化:1。
Baeyer —Villiger 氧化:酮过酸氧化成酯 迁移规则:叔>仲>环己基〉苄〉伯>甲基>氢2。
Corey —Kim 氧化:醇在NCS/DMF 作用后,碱处理氧化成醛酮3.Criegee 邻二醇裂解:邻二醇由Pb (OAc )4氧化成羰基化合物4.Criegee 臭氧化:烯烃臭氧化后水解成醛酮5。
Dakin 反应:对羟基苯甲醛由碱性H 2O 2氧化成对二酚6.Dess -Martin 过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming 氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker 氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt 氧化(Pfitzner -Moffatt )氧化:用DCC 和DMSO 氧化醇,形成醛酮10。
Oppenauer 氧化:烷氧基催化的仲醇氧化成醛酮11。
Riley 氧化:活泼亚甲基(羰基α位等)被SeO 2氧化成酮12.Rubottom 氧化:烯醇硅烷经过m -CPBA 和K2CO 3处理后α-羟基化13。
Sarett 氧化:CrO 3·Py 络合物氧化醇成醛酮14。
Swern 氧化:用(COCl )2,DMSO 为试剂合Et 3N 淬灭的方法将醇氧化成羰基化合物15.Tamao -Kumada 氧化:烷基氟硅烷被KF ,H 2O 2,KHCO 3氧化成醇16.Wacker 氧化:Pd 催化剂下,烯烃氧化成酮还原:1.。
Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3。
Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7。
larock吲哚合成机理LaRock吲哚合成机理LaRock吲哚合成反应是一种经典的环化反应,用于合成吲哚类化合物。
此反应以其温和的反应条件、宽泛的底物适用性和高区域选择性而闻名。
机理LaRock吲哚合成反应的机理涉及以下几个步骤:1. 酰亚胺的形成:反应起始于一种芳基或杂芳基伯胺与酰氯或酸酐的缩合反应,生成酰亚胺。
酰亚胺是反应的中心中间体。
2. 亲核芳香取代:酰亚胺的氮原子作为亲核试剂,攻击带有离去基团的亲电芳香环(通常是卤代芳烃)。
此步骤导致取代产物的形成,其中酰亚胺基团与芳香环相连。
3. 环化:取代产物中的酰亚胺基团发生内部分子环化,形成六元环的吲哚骨架。
此环化是通过亲核加成反应发生的,其中酰亚胺中的碳原子进攻芳香环上的氮原子。
4. 脱去环化后的中间体发生脱去反应,除去质子或其他离去基团,生成最终的吲哚产物。
催化剂LaRock吲哚合成反应通常使用强路易斯酸催化剂,例如三氟甲磺酸(TfOH)。
催化剂通过活化亲电芳香环,促进亲核芳香取代步骤。
底物范围LaRock吲哚合成反应对底物具有高度的耐受性,可用于合成各种取代的吲哚类化合物。
芳香伯胺和杂芳伯胺均可作为反应的氨基组分,而亲电芳香环则可以是一个广泛的芳基或杂芳基卤代物。
区域选择性LaRock吲哚合成反应具有很高的区域选择性,优先在亲电芳香环的邻位发生取代。
此区域选择性归因于催化剂配位对芳香环的激活。
应用LaRock吲哚合成反应已广泛用于各种有机合成中,包括:天然产物的合成药物化学材料科学分子探针的设计该反应的温和条件和高选择性使其成为合成吲哚类化合物的宝贵工具。
bartoli吲哚合成反应机理
巴托利吲哚合成反应(Bartoli indole
synthesis)是一种合成吲哚化合物的方法,具有广泛的应用价值。
该反应通过芳香性亲核取代反应实现,以芳香胺和亲电试剂为原料,经过多步反应途径生成吲哚化合物。
下面是该反应的一种常见机理,以芳香胺和亲电试剂为例:
1.亲电试剂攻击:亲电试剂(如氰化物、硝酰氯等)首先
攻击芳香胺的氮原子,形成一个临时的键合中间体。
2.脱去氢离子:由于中间体的不稳定性,会发生一个质子
转移的过程,脱去氢离子形成间位的碳正离子。
3.亲电取代:中间体的碳正离子接受亲电试剂的攻击,形
成一个新的键,并释放出负离子。
4.负离子重排:负离子经过重排,使得芳香环上的氢原子
迁移到合适的位置。
5.生成吲哚环:芳香环上的氢原子再次参与反应,与负离
子发生亲电反应,生成吲哚环。
需要注意的是,巴托利吲哚合成反应的具体机理可能会因反应条件和底物结构的不同而有所变化。
此外,反应中可能还涉及中间体的形成和消失等步骤,具体的反应路径可能较为复杂。
因此,在实际应用中,针对具体的底物和反应条件,可能需要更加详细和具体的机理研究。
人名反应及常见反应(F-G)Favorskii重排可以烯醇化的α-卤代酮在烷氧基,羟基或胺催化下重排分别生成酯,羧酸或酰胺的反应。
环状底物的Favorskii重排Feist–Bénary呋喃合成反应在碱性条件下,由α-卤代酮和β-酮酸酯反应制备呋喃的反应。
常用的催化剂有胺或吡啶。
Ferrier碳环化反应路易斯酸催化下一锅法高效地将5,6-不饱和呋喃糖转化为取代环己酮类化合物的反应。
此反应也被称为Type II Ferrier rearrangement(与之相对的Ferrier重排反应-Type I Ferrier reaction),此反应可以用于合成手性的肌糖类化合物,如胺基肌糖,脱氧肌糖,不和肌糖,选择性-O-取代肌糖和肌糖膦酸酯等等。
Ferrier重排反应在Lewis酸催化下O-取代的烯糖衍生物通过烯丙位重排与O-, S-, C- N-, P-和卤代亲核试剂反应得到2,3-不饱和糖苷类化合物的反应。
1914年Emil Fischer在水中加热三-O-乙酰基-D-烯糖时发现了此反应。
后来经过Robin Ferrier等人的系统研究,扩展到O-, S-, C- N-, P-和卤代等亲核试剂。
通常情况下,此类反应要用路易斯酸催化,三氟化硼乙醚是最常用的催化剂,另外InCl3,SnCl4,ZnCl2等也会用于此反应。
常用溶剂有:二氯甲烷和甲苯等。
生成的糖苷化合物主要是直立键产物(α:β=7:1)。
Fétizon氧化剂Fétizon氧化剂,以Celite为载体的碳酸银(I),该试剂是一种十分温和的氧化试剂,适用于对酸和碱都敏感的化合物的氧化,1968年由Marcel Fétizon首先发现。
可以氧化伯醇和仲醇,特别是可以选择性的把半缩醛氧化成内酯,效果十分好。
而该氧化反应也被称为Fétizon氧化。
反应体系中的极性基团和醇的α-H附近的大位阻基团对反应活性有很大的抑制作用。
Bartoli吲哚合成反应机理1. 引言Bartoli吲哚合成反应是一种重要的有机合成方法,用于合成吲哚类化合物。
吲哚是一种重要的杂环化合物,具有广泛的生物活性和药理活性。
因此,开发高效、可控的吲哚合成方法具有重要意义。
Bartoli吲哚合成反应以芳香醛和N-甲酰亚胺为起始原料,通过经典的催化反应步骤,生成目标产物——吲哚。
该反应具有高选择性、高产率和广泛适用性。
本文将详细介绍Bartoli吲哚合成反应的机理,并对其相关步骤进行深入探讨。
2. 反应机理Bartoli吲哚合成反应包括以下几个关键步骤:芳香醛与N-甲酰亚胺的底物生成、催化剂生成、催化剂与底物的配位、氧化加氢等。
下面将对这些步骤进行详细介绍。
2.1 芳香醛与N-甲酰亚胺底物生成首先,芳香醛与N-甲酰亚胺底物发生反应,生成中间体。
这一步骤通常在碱性条件下进行,碱的存在有助于催化剂的生成和底物的活化。
2.2 催化剂生成接下来,催化剂生成是整个反应的关键步骤。
催化剂通常由金属盐和配体组成,常用的金属盐包括CuCl、CuBr等,而配体则可以选择吡啶、二甲基亚砜等。
催化剂生成过程中,金属盐与配体发生配位作用,形成活性催化剂。
这些活性催化剂具有良好的稳定性和高度选择性,能够促进后续的反应步骤。
2.3 催化剂与底物的配位在此步骤中,活性催化剂与底物发生配位作用。
底物中的芳香醛与N-甲酰亚胺分子结合到活性催化剂上形成配合物。
2.4 氧化加氢最后一个关键步骤是氧化加氢。
在此步骤中,通过加入过量的氧气和氢源(如乙二醇),催化剂促进底物的氧化加氢反应。
这一步骤发生后,产生的中间体经过一系列的重排和消除反应,最终生成目标产物——吲哚。
3. 实例分析为了更好地理解Bartoli吲哚合成反应机理,我们以具体的实例进行分析。
以苯甲醛和N-甲酰亚胺为起始原料,通过碱性条件下的反应,生成苯甲醛和N-甲酰亚胺底物。
接着,在存在CuCl和吡啶的条件下,催化剂生成,并与底物进行配位。