胶质瘤影像诊断
- 格式:ppt
- 大小:17.28 MB
- 文档页数:69
视神经胶质瘤的影像学诊断视神经胶质瘤(又称视神经通路胶质瘤)是视神经最常见的原发肿瘤。
视神经胶质瘤是一种良性肿瘤,可归类为毛细胞星形细胞瘤。
占视神经原发肿瘤的50%,占眼眶肿瘤的1.5 ~ 4%。
随着受累眼睛视力的下降,肿瘤在生长时有时会产生额外的症状。
这种肿瘤的一种低级别形式,良性视神经胶质瘤,最常发生在儿童患者。
另一种形式,侵袭性胶质瘤,在成人中最常见;它经常是致命的,即使治疗。
许多视神经胶质瘤患儿也有1型神经纤维瘤病(NF-1),或在某些情况下,有混合性错构瘤病。
请看下面的图片。
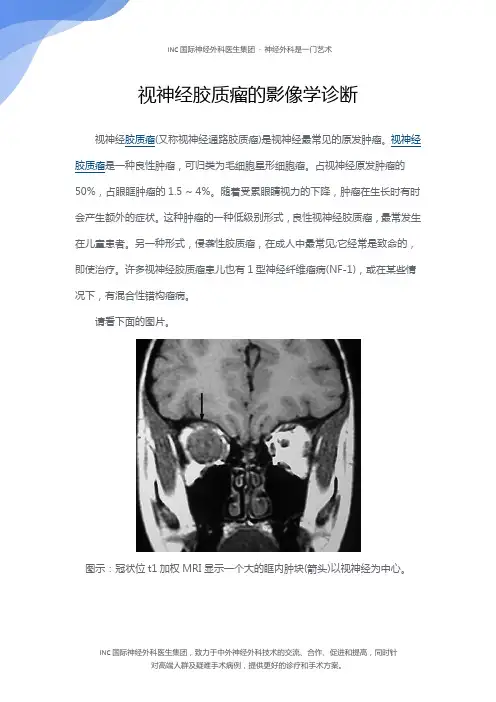
图示:冠状位t1加权MRI显示一个大的眶内肿块(箭头)以视神经为中心。
图示:46岁男性轴向t2加权MRI显示丘脑外侧膝状核肿块,起因于患者已知视神经胶质瘤的连续延伸。
首选的检查对比计算机断层扫描(CT)可以用来描述视神经胶质瘤在眼眶内的局部受累。
然而,磁共振成像(MRI)更好地显示病变颅内生长的程度。
虽然MRI可以发现视神经的细微病变,但CT扫描可以发现视神经管的轻微侵蚀或扩张。
此外,细小钙化可能有助于识别病变为脑膜瘤而不是胶质瘤,最好通过CT扫描来观察。
当诊断有问题时,通常可以通过CT扫描发现颅内肿块。
然而,MRI是诊断视神经胶质瘤的首选方法。
通过MRI可以有效地表征眶内病变及其颅内范围。
在评估眼眶时,钆增强t1加权图像脂肪饱和度可以确定侵袭性胶质瘤的范围。
在颅内,MRI能比CT更好地评估视神经、交叉、束、膝状体和视神经放射。
钆基造影剂与肾源性系统性纤维化(NSF)或肾源性纤维化皮肤病(NFD)的发展有关。
该疾病发生在中度至终末期肾病患者中,患者接受钆基造影剂增强MRI 或MRA扫描。
NSF/NFD是一种使人衰弱,有时是致命的疾病。
特征包括皮肤出现红色或深色斑块;皮肤灼烧、发痒、肿胀、硬化、紧致;眼白上有黄色斑点;关节僵硬,难以移动或伸直手臂、手、腿或脚;在髋骨或肋骨深处的疼痛;和肌肉无力。



脑胶质瘤影像学表现脑胶质瘤是一种常见的中枢神经系统原发性肿瘤,通常由脑部的胶质细胞发展而来。
脑胶质瘤可以在不同的脑部区域形成,并且其影像学表现也可能各不相同。
通过影像学检查,可以帮助医生诊断脑胶质瘤的类型、位置、大小以及周围组织受累情况,从而制定合适的治疗方案。
MRI是最常用的影像学检查手段之一,对于脑胶质瘤的检测和定位起着至关重要的作用。
在MRI图像上,脑胶质瘤通常呈现为高信号灶,与正常脑组织相比较黑暗或明亮。
瘤内可见囊实交替排列的异常信号,以及周围水肿、瘤周梗死、囊变、出血等不同的改变。
而在造影MRI图像上,脑胶质瘤往往显示出强化效应,即肿瘤周围的血管对比剂明显浓缩,从而帮助医生更加清晰地观察肿瘤的周围情况。
除了MRI,CT扫描也是常用的影像学检查手段之一。
CT扫描能够提供关于脑部结构的更加详细的信息,有助于医生判断脑胶质瘤的位置和范围。
在CT图像上,脑胶质瘤呈现为不规则的软组织密度区域,与周围正常组织有明显的对比。
有时,脑胶质瘤内还可见有钙化或出血灶,进一步印证了肿瘤的存在。
除了MRI和CT扫描,脑胶质瘤的影像学表现还可以通过PET-CT、脑血管造影、超声检查等多种检查手段来进一步确认。
这些检查手段各有优势,能够从不同的角度全面观察脑胶质瘤的形态和特点,为临床诊疗提供重要的参考信息。
总的来说,脑胶质瘤的影像学表现是多种多样的,需要结合多种影像学检查手段来综合评估。
及早发现脑胶质瘤,对于制定合理的治疗方案、提高治疗效果至关重要。
因此,在临床实践中,医生应当根据患者的临床症状和检查结果,合理选择合适的影像学检查手段,及时明确诊断,为患者的治疗和康复提供有力支持。


本文对少突胶质细胞肿瘤的流行病学、病理、CT、MRI表现及鉴别诊断进行梳理,对其影像表现进行分析和总结。
Ⅱ级少突胶质细胞瘤的传统影像学表现为位置表浅,肿瘤呈团块状,密度/信号不均匀,钙化是其主要特征,可囊变,出血、瘤周水肿轻,增强表现呈无强化或轻度强化,同时要与胚胎发育不良性神经上皮瘤、脑炎、脑梗塞做鉴别;Ⅲ级间变型少突胶质细胞瘤常表现为坏死、囊变、出血、瘤周水肿明显,呈明显不均匀强化,应与胶质母细胞瘤及单发转移瘤鉴别。
全面掌握少突胶质细胞肿瘤的影像诊断要点,有助于术前分级诊断和鉴别。
少突胶质细胞肿瘤(oligodendrogliomas, OGS)是成人常见的胶质瘤之一,患病率仅次于星形细胞瘤,肿瘤具有弥漫浸润生长特点,影像表现多样,术前诊断和鉴别存在困难。
近年来,有关OGS的较多研究表明,肿瘤的分级、分型与患者对化疗药物的敏感性和预后密切相关,因此术前评估OGS级别意义重大。
本文对不同分级OGS 的流行病学、病理、影像学表现和鉴别诊断做出梳理总结,旨在提高对该类肿瘤分级诊断的认识。
1.病因:OGS起源于神经上皮组织,是成熟少突胶质细胞或未成熟的神经胶质前体细胞的肿瘤转化。
WHO将OGS分为Ⅱ级少突胶质细胞瘤(oligodendroglioma, OD)和Ⅲ级间变型少突胶质细胞瘤(anaplastic oligodendroglioma, AO)。
需要特别提出的是,Ⅲ级AO为原发或由Ⅱ级OD进展而来。
2.临床:OGS占原发性颅内肿瘤的5%~10%,WHOⅡ级OD好发于40~50岁成年人,WHO Ⅲ级AO 平均发病年龄较OD更大,幕上额叶皮层或皮层下白质区是其好发部位。
临床表现为头痛、癫痫和局部神经功能缺损。
该肿瘤的治疗以手术切除为主,术后应辅以放、化疗。
3.预后:该类肿瘤的预后与分级有关,也与分子分型相关。
2016年新版WHO分型将OGS增加了分子分型,分为异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)突变和1p/19q共缺失型和非特殊类型。





胶质瘤的影像学表现胶质瘤起源于神经胶质细胞,包括星形细胞瘤、脉络丛乳头状瘤、少突胶质瘤和室管膜瘤等。
最常见的原发性脑肿瘤,约占颅脑肿瘤的40%-50 %。
星形细胞瘤为胶质瘤中最常见的一类肿瘤(占40%),占颅内肿瘤的17%。
成人多见于幕上,儿童多见于小脑。
「影像学表现」CT:(1)幕上I、Ⅱ级星形细胞瘤:大部分表现为脑内低密度病灶,少数为混合密度灶,部分患者瘤内可见钙化。
肿瘤边界不清晰,瘤周水肿少见且较轻。
增强后扫描常无明显强化,少数表现为肿瘤或囊壁和囊内间隔的略微强化,有的有壁结节甚至花环状强化。
(2)幕上Ⅲ、Ⅳ级星形细胞瘤:病灶密度不均匀,以低密度或等密度为主的混合密度最多。
肿瘤内的高密度常为出血。
低密度为肿瘤的坏死或囊变区。
肿瘤多有脑水肿。
增强扫描几乎所有的肿瘤均有强化,可呈不规则的环状或者花环状强化,在环壁上还可见强化不一的瘤结节。
若沿胼胝向对侧生长则呈蝶状强化,占位征象明显。
(3)小脑星形细胞瘤:囊性者平扫为均匀水样低密度,边界清晰,囊壁可有钙化,增强扫描囊壁结节不规则强化。
壁结节较大,在1 cm 以上。
实性者平扫为以低密度为主的混合密度,多数有坏死囊变区,肿瘤实性部分变化可有明显强化。
多有水肿,第四脑室受压移位、闭塞,上位脑室扩大,脑干受压前移,桥脑小脑角池闭塞。
热文:各种脑肿瘤在PET-CT中显像脑胶质瘤在PET-CT与MRI图像MRI:(1)幕上星形细胞瘤:T1WI 略低信号,T2WI 高信号。
肿瘤的信号常不均匀,与其坏死、出血、囊变、钙化和肿瘤血管有关。
肿瘤内出血多数在T1WI、T2WI 像上均为高信号。
钙化在T1WI、T2WI 像上均为低信号,但其敏感性不如CT。
Gd—DTPA 增强扫描:偏良性的肿瘤多无增强;偏恶性的肿瘤多有增强,表现多种多样,可呈均匀一致性增强,亦可呈不均匀或花环状增强。
肿瘤四周水肿时,T1WI为低信号,T2WI为高信号。
增强扫描因肿瘤强化明显,可区别水肿与肿瘤。
脑胶质瘤的MRI诊断与鉴别诊断胶质瘤(glioma)是中枢神经系统最为常见的原发性肿瘤,脑肿瘤中胶质瘤发病率最高,约占半数,其中75%为星形细胞瘤。
1 材料与方法收集--哈密红星医院放射科2010年7月~2012年12月及河南省人民医院放射科2013年5月~2013年11月经手术及病理证实的53例脑胶质瘤,包括弥弥漫型星形细胞瘤13例、胶质母细胞瘤10例、少突胶质细胞瘤7例、室管膜瘤6例、脉络丛乳头状瘤及毛细胞型星形细胞瘤各5例、混合性胶质瘤4例、间变型星形细胞瘤2例、间变型室管膜瘤1例。
年龄:3岁~73岁,平均45岁,性别:男30例,女23例。
采用GE1.5T及3.0T超导型磁共振扫描仪,常规行SE序列T1WI和T2WI轴切位、矢状位及冠状位扫描,DWI及ADC图。
扫描参数T1WI:TR 400ms,TE 14ms;T2WI:TR 5000ms,TE 128ms;视野(FOV)24cm,层厚6mm,间距2mm,矩阵256256,激励次数(NEX)2。
所有病例均行MRI平扫和增强扫描。
增强扫描使用Gd-DTPA,剂量为0.2ml/kg体重,注射流率为3ml/s。
2 结果2.1 30例星形细胞瘤2.1.1 13例弥漫型星形细胞瘤MRI表现为2例T1WI低信号,T2WI高信号,瘤周水肿明显,2例为薄壁环状强化(其中1例为多环状,1例为单环状),11例为T1WI等低信号,T2WI等高信号,水肿不明显,增强扫描6例无强化,3例不均匀斑点、片状轻中度强化,2例斑片状明显强化。
2.1.2 5例毛细胞型星形细胞瘤MRI表现为2例为囊实性,2例为大囊壁伴壁结节,T1WI 呈等低信号,T2WI等高信号,瘤周无水肿,增强扫描实性部分、壁结节明显强化,最大囊壁直径达5.5cm,1例为T1WI呈低信号,T2WI高信号,瘤周无水肿,增强扫无强化。
2.2 7例少突胶质细胞瘤MRI表现为均T1WI等低信号,T2WI高信号,均含囊变及钙化灶,瘤周轻中度水肿,增强扫描呈轻中度斑点状、线条状强化。