液相平衡常数的测定
- 格式:docx
- 大小:11.51 KB
- 文档页数:2

液相平衡实验报告篇一:液相平衡常数的测定华南师范大学实验报告学生姓名学号专业化学教育年级、班级 2011级课程名称物理化学实验实验项目液相平衡常数的测定实验类型试验时间 2013年10月30日实验指导老师实验评分液相平衡常数的测定【实验目的】1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解热力学平衡常数的数值与反应物起始浓度无关。
【实验原理】Fe3+与SCN在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
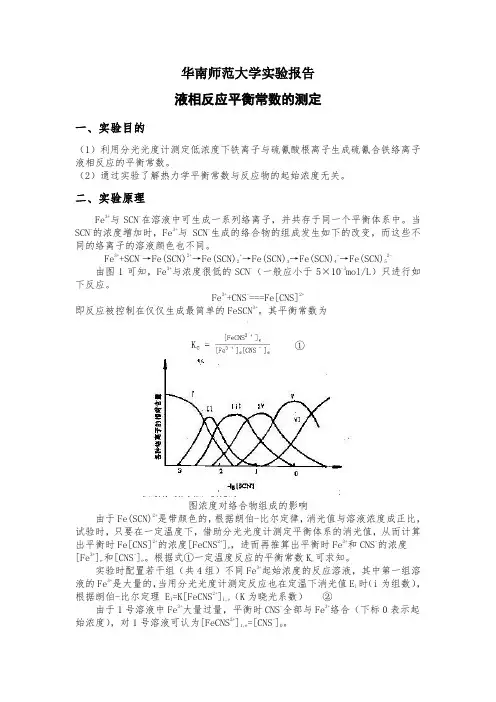
当SCN离子的浓度增加时,Fe3+离子与SCN离子生成的络合物的组成发生如下的改变,而这些不同的络合物的溶液颜色也不同:Fe3++SCN→Fe(SCN)2+→Fe(SCN)2+→Fe(SCN)3→Fe(SCN)4→Fe(SCN)52 而这些不同的络离子色调也不同。
由图Ⅲ112可知,当Fe3+离子与浓度很低的SCN离子(一般应小于5×103mol·L)时,只进行如下反应:Fe3+ + SCN ≒ Fe[SCN]2+ ①即反应被控制在仅仅生成最简单的FeSCN3+络离子。
其平衡常数表示为:②由于Fe[SCN]2+是带有颜色的,根据朗伯比尔定律,可知消光值与溶液浓度成正比。
因此,可借助于分光光度计测定其光密度,从而计算出平衡时Fe[SCN]2+的浓度[FeSCN2+]e,再推算出Fe3+和SCN的浓度[Fe3+]e,[SCN]e进而求出该反应的平衡常数KC。
实验分为4组,不同组的Fe3+浓度不同,其中第一组的浓度极大,使用分光光度计时,根据朗伯比尔定律E1=K[FeCNS2+]1,e(K为消光系数)由于1号溶液中Fe3+浓度极大,平衡时CNS与Fe3+完全络合,对于一号溶液可认为[FeCNS2+]1,e=[CNS]0 则E1=K[CNS]0对于其它溶液,则Ei=K[FeCNS2+]1,e 两式相除并整理得[FeCNS2+]1,e=E1/E1[CNS]0达到平衡时,在体系中:[Fe3+]i,e=[Fe3+]0[FeSCN2+]i,e ③[CNS]i,e =[CNS]0[FeSCN2+]i,e④将③、④二式带入②式,可以计算出除第一组外各组(不同Fe3+起始浓度)反应溶液的在丁问下的平衡常数Ki,e值。

化学反应中的平衡常数测定方法化学反应平衡常数是描述反应在平衡态时物质浓度的数值。
它是理解反应物质转化程度和反应条件对反应平衡的影响的重要参数。
本文将介绍几种常用的化学反应平衡常数测定方法。
一、液相平衡常数测定方法1. 酸碱滴定法酸碱滴定法适用于酸碱中和反应。
首先,将酸或碱溶液与一定量的指示剂混合,然后滴加对应的酸或碱溶液,直到指示剂颜色发生变化,记录滴加的酸或碱溶液的体积。
通过体积比例可以确定酸碱反应平衡时的物质浓度比例,从而计算平衡常数。
2. 比色法比色法适用于反应物和产物在反应溶液中有明显的颜色差异的反应。
通过光谱仪或分光光度计测定反应溶液在特定波长下的吸光度,利用反射率与溶液中物质浓度之间的定量关系,可以计算出平衡常数。
二、气相平衡常数测定方法1. 压力法压力法适用于气体反应。
在恒定温度下,将反应物加入容器,测量容器内的压力。
反应达到平衡后,根据部分压力与摩尔比例之间的关系,可以计算出平衡常数。
2. 体积法体积法通常用于液体蒸气压上涨反应。
将反应物和辅助剂加入封闭的容器中,反应平衡后测量体积。
根据反应物与产物之间的摩尔比例,可以计算出平衡常数。
三、计算机模拟方法计算机模拟方法是利用计算机技术和物理化学理论模型对化学反应进行模拟和计算。
通过建立化学反应的动力学方程和平衡常数方程,采用数值计算方法求解,可以得到平衡常数的数值。
四、温度法可以利用温度对平衡常数的影响进行测定。
在不同的温度下进行反应,通过测量平衡时物质浓度或压力的变化,推导出平衡常数随温度的变化关系,从而得到真实的平衡常数。
总结:化学反应中的平衡常数测定方法有液相平衡常数测定方法、气相平衡常数测定方法、计算机模拟方法和温度法。
不同的反应系统和实验条件下,可以选择适合的方法进行测定。
这些方法提供了测定平衡常数的有效手段,可以帮助我们更好地理解化学反应平衡,并为相关工业过程和实验研究提供指导。
对于化学工作者来说,掌握和应用这些测定方法是十分重要的。

液相反应平衡常数的测定一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解热力学平衡常数的数值与反应物起始浓度无关。
二、实验原理Fe3+离子与SCN-离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN-离子的浓度增加时,Fe3+离子与SCN-离子生成的络合物的组成发生如下的改变:Fe3++SCN-→ Fe(SCN)2+→ Fe(SCN)2+→ Fe(SCN)3→ Fe(SCN)4-→ Fe(SCN)52-而这些不同的络离子色调也不同。
由图3-12可知,当Fe3+离子与浓度很低的SCN-离子(一般应小于5×10-3mol·L-1)时,只进行如下反应:Fe3+ + SCN- FeSCN2+即反应被控制在仅仅生成最简单的FeSCN3+络离子。
其平衡常数表示为:(3-14)由于Fe[CNS]2+是带有颜色的,根据朗伯-比尔定律,消光值与溶液浓度成正比,实验时,只要在一定温度下,借助分光光度计测定平衡体系的消光值,从而计算出平衡时Fe[CNS]2+的浓度[FeCNS 2+]e 。
根据式(3-14)一定温度下反应的平衡常数K c 求可知。
实验时配制若干组(共4组)不同Fe 3+起始浓度的反应溶液,其中第一组溶液的Fe 3+是大量的,当用分光光度计测定反应液在室温下消光值E i 时(i 为组数),根据朗伯-比尔定理:E l =K[FeCNS 2+]l,e (K 为消光系数)由于1号溶液中Fe 3+大量过量,平衡时CNS -全部与Fe 3+络合(下标0表示起始浓度),对1号溶液可认为:[FeCNS]1,e =[CNS -]0则 E 1=K[CNS -]0 (3-15) 对其余组溶液 E i =K[FeCNS 2+]i,e (3-16) 两式相除并整理得: [FeCNS 2+]i,e =1E E i[CNS -]始 达到平衡时,在体系中[Fe 3+]i,e = [Fe 3+]0 - [FeCNS 2+]i,e (3-17) [CNS -]i,e = [CNS -]0 - [FeCNS 2+]i,e (3-18) 将式(3-17)和式(3-18)代入式(3-14)中,可以计算出除第1组外各组(不同Fe 3+起始浓度)反应溶液的在定温下的平衡常数K i,e 值。

液相反应平衡常数的测定实验报告摘要本文针对液相反应平衡常数的测定实验研究进行了详细的说明,结合实验室实验方法,实验数据、实验结果和计算结果,以及实验错误的原因等,研究结果表明,本课题中的液相反应平衡常数的测定实验可以获得准确的数据。
关键词:平衡反应,液相反应,平衡常数1、实验目的本实验旨在通过实验,测定液相反应平衡常数,并研究其变化律和其对反应机理的影响。
2、实验原理液相反应的平衡常数是描述反应的激活能量的量度。
当在不同温度下测量液相反应的平衡常数K,可以得出液相反应的反应机理和活化能。
3、实验设备a) 使用经常性清洁的玻璃滴定道;b) 使用良好的塑料物理搅拌器;c) 使用精密滴定管;d) 使用精密滴定瓶;e) 使用精准量筒;f) 使用标准溶液;4、实验步骤a) 测定溶液PH;b) 测定清洁玻璃滴定道的滴速;c) 测定搅拌器的转速;d) 测定溶液的比重;e) 测定溶液的浓度;f) 继续滴定直到平衡定值。
5、实验结果a) 测定溶液pH:PH=7.3b) 测定清洁玻璃滴定道的滴速:14.7毫升/分钟c) 测定搅拌器的转速:4000转/分钟d) 测定溶液的比重:1.000 g/mLe) 测定溶液的浓度:1.00 mol/Lf) 测定溶液的平衡定值:K = 0.0726、实验错误a) 实验中搅拌器的转速较慢,因而影响了实验结果的准确性;b) 实验室温度的波动,对实验结果也有一定影响;c) 实验中反应液的浓度和pH不准确,也会影响实验结果。
7、结论本液相反应平衡常数的测定实验通过实验数据、实验结果和计算,实验结果表明,本实验中测定的液相反应平衡常数k为0.072。
实验八液相反应平衡常数1.实验目的及要求1)掌握一种测定弱电解质电离常数的方法。
2)掌握分光光度计的测试原理和使用方法。
3)掌握pH计的原理和使用。
2.实验原理根据Beer-Lambert定律,溶液对于单色光的吸收,遵守下列关系式:(1)式中A为吸光度;I/I。
为透光率;k为摩尔吸光系数,它是溶液的特性常数;l为被测溶液的厚度;c为溶液浓度。
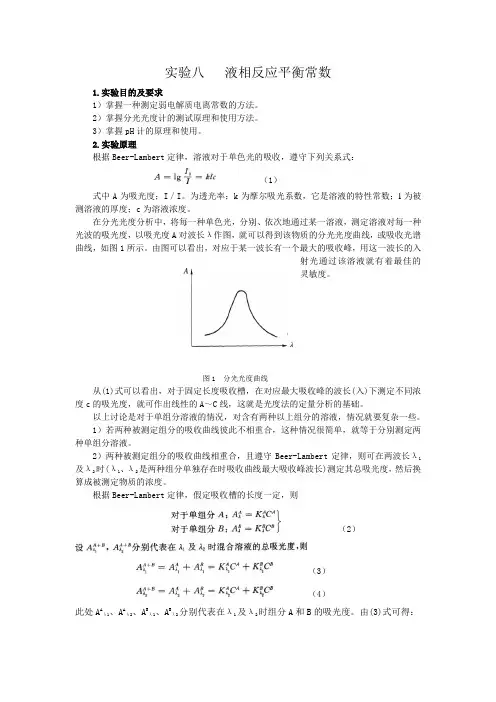
在分光光度分析中,将每一种单色光,分别、依次地通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A对波长λ作图,就可以得到该物质的分光光度曲线,或吸收光谱曲线,如图1所示。
由图可以看出,对应于某一波长有一个最大的吸收峰,用这一波长的入射光通过该溶液就有着最佳的灵敏度。
图1 分光光度曲线从(1)式可以看出,对于固定长度吸收槽,在对应最大吸收峰的波长(入)下测定不同浓度c的吸光度,就可作出线性的A~C线,这就是光度法的定量分析的基础。
以上讨论是对于单组分溶液的情况,对含有两种以上组分的溶液,情况就要复杂一些。
1)若两种被测定组分的吸收曲线彼此不相重合,这种情况很简单,就等于分别测定两种单组分溶液。
2)两种被测定组分的吸收曲线相重合,且遵守Beer-Lambert定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。
根据Beer-Lambert定律,假定吸收槽的长度一定,则(2)(3)(4)此处A Aλ1、A Aλ2、A Bλ1、A Bλ2分别代表在λ1及λ2时组分A和B的吸光度。
由(3)式可得:(5)将(5)式代入(4)式得:(6)这些不同的K值均可由纯物质求得,也就是说,在纯物质的最大吸收峰的波长λ时,测定吸光度A和浓度c的关系。
如果在该波长处符合贝尔一郎比定律,那么A~C为直线,直线的斜率为K值,是混合溶液在λ1、λ2时测得的总吸光度,因此根据(5)、(6)式即可计算混合溶液中组分A和组分B的浓度。

5.三元液液平衡常数测定实验数据处理方法
三元液液平衡常数测定实验数据处理通常包括以下几个步骤:
1. 将实验数据绘制成图表:将实验数据以适当的形式绘制成图表,如X-Y图、Y-T图等,以便进行更直观的分析和处理。
2. 计算摩尔分数:对实验数据进行处理,计算出各组分的摩尔分数。
摩尔分数可以通过实验测定得到的物质质量或体积,按摩尔质量或体积比例计算得到。
3. 构建液相平衡方程:根据实验数据和摩尔分数,可以构建液相平衡方程。
平衡方程可以通过质量守恒或化学反应平衡方程得到。
4. 利用平衡常数公式计算平衡常数:根据液相平衡方程和平衡常数公式,可以计算出三元液液平衡常数。
5. 分析结果:对实验数据处理和计算得到的平衡常数进行分析,判断实验数据的可靠性,并作出相应的结论。
需要注意的是,三元液液平衡常数的测定实验数据处理方法可能因具体实验条件和所测物质的不同而有所差异。
在实际操作中,还需要根据实验条件的要求和实验目的进行相应的数据处理和分析方法的选择。

华南师范大学实验报告液相反应平衡常数得测定一、实验目得(1) 利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子液相反应得平衡常数。
(2) 通过实验了解热力学平衡常数与反应物得起始浓度无关。
二、实验原理Fe3+与SCN 在溶液中可生成一系列络离子,并共存于同一个平衡体系中。
当SCN得浓度增加时,Fe3+与SCN 生成得络合物得组成发生如下得改变,而这些不同得络离子得溶液颜色也不同。
Fe3++SCN→Fe(SCN2)+→Fe(SCN2)+→Fe(SCN3)→Fe(SCN4)→Fe(SCN5)2由图1 可知,Fe3+与浓度很低得SCN一( 般应小于5×103mol/L)只进行如下反应。
Fe3++CNS===Fe[CN2S+] 即反应被控制在仅仅生成最简单得FeSCN3+。
其平衡常数为图1、SCN浓度对络合物组成得影响由于Fe(SCN2)+就是带颜色得,根据朗伯比尔定律,消光值与溶液浓度成正比,试验时,只要在一定温度下,借助分光光度计测定平衡体系得消光值,从而计算出平衡时Fe[CNS2]+得浓度[FeCNS2+]e,进而再推算出平衡时Fe3+与CNS得浓度[Fe3+]e 与[CNS]e。
根据式①一定温度反应得平衡常数K c 可求知。
实验时配置若干组(共4组)不同Fe3+起始浓度得反应溶液,其中第一组溶液得Fe3+就是大量得,当用分光光度计测定反应也在定温下消光值E i时(i 为组数),根据朗伯比尔定理E1=K[FeCNS2+]1,e(K为晓光系数) ②由于1号溶液中Fe3+大量过量,平衡时CNS全部与Fe3+络合(下标0表示起始浓度),对1号溶液可认为[FeCNS2+]1,e=[CNS]0。
则E1=K[CNS0] ③对其余组溶液E i=K[FeCNS2+]I,e ④两式相除并整理得⑤达到平衡时,在体系中[Fe3+]i,e=[Fe3+]i,e=[Fe3+]0[FeCNS2+]i、e ⑥[CNS i],e=[CNS0] [FeCNS2+]i、e ⑦将式⑥、⑦代入①,可以计算出除第1组外各组(不同Fe3+起始浓度)反应溶液得在定温下得平衡常数K i,e=值。



华南师范大学实验报告学生姓名学号专业年级、班级课程名称实验项目液相反应平衡常数的测定实验类型□验证□设计■综合实验时间年月日实验指导老师实验评分一、实验目的1、利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子液相反应的平衡常数。
2、通过实验了解热力学平衡常数的数值与反应物起始浓度无关。
二、实验原理Fe3+离子与SCN-离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN-离子的浓度增加时,Fe3+离子与SCN-离子生成的络合物的组成发生如下的改变:Fe3++SCN-→Fe(SCN)2+→Fe(SCN)2+→Fe(SCN)3→Fe(SCN)4-→Fe(SCN)52-而这些不同的络离子色调也不同。
由图Ⅲ-11-2可知,当Fe3+离子与浓度很低的SCN-离子(一般应小于5×10-3mol·L)时,只进行如下反应:Fe3+ + SCN- ≒FeSCN2+即反应被控制在仅仅生成最简单的FeSCN3+络离子。
其平衡常数表示为:根据朗伯-比尔定律,可知光密度与溶液浓度成正比。
因此,可借助于分光光度计测定其光密度,从而计算出平衡时FeSCN2+络离子的浓度以及Fe3+离子和SCN-离子的浓度,进而求出该反应的平衡常数K C。
实验分为4组,不同组的Fe3+浓度不同,其中第一组的浓度极大,使用分光光度计时,根据朗伯-比尔定律E1=K[FeCNS2+]1,e(K为消光系数)由于1号溶液中Fe3+浓度极大,平衡时CNS-与Fe3+完全络合,对于一号溶液可认为[FeCNS2+]1,e=[CNS-]0 则E1=K[CNS-]0对于其它溶液,则E i=K[FeCNS2+]1,e 两式相除并整理得[FeCNS2+]1,e=E1/E1[CNS-]0三、仪器与药品1、仪器722型分光光度计1台;50mL容量瓶8只;100mL烧杯4个;刻度移液管10mL2支5mL1支;25移液管1支;50mL酸式滴定管1支;洗耳球、洗瓶等2、试剂1×10-3mol·L KSCN(分析纯配置,需准确标定);0.1mol·LFeNH4(SO4)2(需准确标定Fe3+浓度,并加HNO3使H+浓度0.1mol·L);1mol·LHNO3;1mol·LKNO3(试剂均用分析纯配制)四、实验步骤1、取8个容量瓶,按照下表编号,并按下表配置溶液并进行定容。
华南师范大学实验报告学生姓名学号专业化学(师范)年级、班级课程名称物理化学实验实验项目实验类型实验时间年月日实验指导老师实验评分一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解热力学平衡常数的数值与反应物起始浓度无关。
二、实验原理Fe3+离子与SCN-离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN-离子的浓度增加时,Fe3+离子与SCN-离子生成的络合物的组成发生如下的改变:Fe3++SCN-→Fe(SCN)2+→Fe(SCN)2+→Fe(SCN)3→Fe(SCN)4-→Fe(SCN)52-而这些不同的络离子颜色也不同。
由上图可知,当Fe 3+离子与浓度很低的SCN -离子(一般应小于5×10-3mol ·dm -3)时,只进行如下反应:Fe 3+ + SCN - ≒ Fe(SCN)2+即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。
其平衡常数表示为:根据朗伯-比尔定律,可知光密度与溶液浓度成正比。
因此,可借助于分光光度计测定其光密度,从而计算出平衡时FeSCN 2+络离子的浓度以及Fe 3+离子和SCN -离子的浓度,进而求出该反应的平衡常数K C 。
由于1号溶液中Fe 3+大量过量,平衡SCN -全部和Fe 3+络合(下标0表示起始浓度),对一号溶液可认为()21,eFe SCN +⎡⎤⎣⎦= SCN -⎡⎤⎣⎦0,则1E K SCN -⎡⎤=⎣⎦0 对其余组溶液 ()2,i i eE K Fe SCN +⎡⎤=⎣⎦两式相除并整理得()20,1[]i i e E Fe SCN SCN E +-⎡⎤=⎣⎦ 达到平衡时,在体系中332,0,[][][]e i e e e i e F F F SCN +++=- 32,0,[][][]i e e e i e SCN F F SCN -++=-故由以上各式即可计算出(除第1组外)各组反应溶液的在定温下的平衡常数,i e K 值。
化学平衡常数的液相反应中的测定与分析在化学反应中,平衡常数是描述化学反应平衡状态的一个重要指标。
对于液相反应而言,测定和分析其平衡常数是非常关键的,因为它可以帮助我们了解反应的偏向性以及反应条件对平衡转化的影响。
本文将探讨液相反应中化学平衡常数的测定与分析方法。
1. 反应方程的表示在液相反应中,我们首先需要确定反应的化学方程式。
这个方程式需要清晰地表示出反应物和生成物的化学式,并标明反应的物质摩尔比例。
在确定方程式时,还要考虑到反应的物理性质和反应条件,确保方程式的准确性和完整性。
2. 平衡常数的定义平衡常数(K)描述了反应在平衡状态下生成物与反应物之间的浓度关系。
对于液相反应而言,平衡常数通常用浓度表达,可以表示为各反应物及生成物浓度的乘积之比。
根据反应方程式,我们可以得到平衡常数的表达式。
3. 测定平衡常数的方法为了确定液相反应的平衡常数,我们可以采用不同的实验方法。
以下是几种常用的方法:3.1. 反应物消失法在该方法中,我们测量反应物浓度随时间的变化情况。
通过追踪反应物消失的速率,我们可以计算出平衡常数。
该方法适用于反应物消失较为明显或者反应速率较快的反应。
3.2. 生成物生成法在该方法中,我们测量生成物浓度随时间的变化情况。
通过追踪生成物生成的速率,我们可以计算出平衡常数。
该方法适用于生成物生成较为明显或者反应速率较快的反应。
3.3. 比色法该方法基于反应物或生成物具有不同的颜色或吸收特性。
通过测量反应物或生成物的吸光度或颜色强度,可以计算出平衡常数。
3.4. pH计测定法pH计测定法适用于涉及酸碱反应的液相反应。
通过测量反应过程中溶液的pH值变化,可以推导出平衡常数。
4. 数据处理与分析在测定平衡常数后,我们需要对实验数据进行处理和分析。
通常,我们会使用计算机软件或数学算法来进行数据拟合和计算。
通过拟合得到的数据,可以得出反应的平衡常数及其误差。
5. 平衡常数的意义与应用平衡常数可以告诉我们反应的偏向性,即向生成物或反应物方向倾斜的程度。
华师14级实验报告-液相反应平衡常数的测定液相反应平衡常数的测定学生姓名:大芒果 学生学号:学生专业:化学教育 年级班级:2014级 指导老师:林晓明 实验时间:2016.11.21一、实验目的(1)利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子液相反应的平衡常数。
(2)通过实验了解热力学平衡常数与反应物的起始浓度无关。
二、实验原理3F e +与SCN -在溶液中可生成一系列络离子,并共存于同一个平衡体系中。
当SCN -的浓度增加时,3F e +与SCN -生成的络合物的组成发生如下的改变,而这些不同的络离子的溶液颜色也不同。
322345()()()()Fe SCN Fe SCN Fe SCN Fe SCN Fe SCN +-+--+→→→→当3F e +与浓度很低的SCN -(一般应小于3510/mol L -⨯)只进行如下反应。
32()Fe SCN Fe SCN +-++=即反应被控制在仅仅生成最简单的2()Fe SCN +。
其平衡常数为23[()][][]ec e eFe SCN K Fe SCN ++-=由于2()Fe SCN +是带有颜色的,根据朗伯-比尔定律,消光值与溶液浓度成正比,实验时,只要在一定条件下,借助分光光度计测定平衡体系的消光值,从而计算出平衡时的2()Fe SCN +的浓度2[()]e Fe SCN +,进而再推算出平衡时3Fe +和SCN -的浓度3[]e Fe +和[]e SCN -,进而再推算一定温度下反应的平衡常数c K 。
实验时配制若干组(共4组)不同3F e +起始浓度的反应溶液,其中第一组溶液的3F e +是大量的,当用分光光度计测定反应液在定温下消光值i E (i 为组数),根据朗伯-比尔定律211,[()]()e E K Fe SCN K +=为消光系数由于1号溶液中3F e +大量过量,平衡时SCN -全部与3F e +络合(下标0表示起始浓度),对1号溶液可认为21,0[()]=[]e Fe SCN SCN +-则10[]E K SCN -=对于其余组溶液,2,[()]i i e E K Fe SCN += 两式相除并整理得21,1[()][]ie E Fe SCN SCN E +-=始 达到平衡时,在体系中332,,[][][()]i e i i e Fe Fe Fe SCN +++=- 2,,[]=[][()]i e i i e SCN SCN Fe SCN --+-将3,[]i e Fe +、,[]i e SCN -、2,[()]i e Fe SCN +代入2,,3,,[()][][]i e i c i e i eFe SCN K Fe SCN ++-=,则可计算出除第1组外各组(不同3F e +起始浓度)反应溶液在定温下的平衡常数,i c K 值 三、仪器与试剂 (1)实验仪器722型分光光度计 1台 50mL 容量瓶8个刻度移液管 10mL (2支)、5mL (1支) 25mL 移液管(1支) 50mL 酸式滴定管1支 洗耳球、洗瓶 (2)实验试剂3110/mol L -⨯KSCN ().A R0.1/mol L ()()42Fe SO 4NH ().A R 0.1/mol L 3HNO ().A R 1/mol L 3KNO ().A R四、实验步骤1.取8个50mL 容量瓶,贴上标签。
液相反应平衡常数的测定学生学号:年级班级:2014级 实验时间:2016.11.21一、 实验目的(1) 利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子 液相反应的平衡常数。
(2) 通过实验了解热力学平衡常数与反应物的起始浓度无关。
二、 实验原理Fe 3与SCN 在溶液中可生成一系列络离子,并共存于同一个平衡体系中。
当SCN 的浓度增加时,Fe 3与SCN 生成的络合物的组成发生如下的改变,而 这些不同的络离子的溶液颜色也不同。
32Fe SCN Fe(SCN )2Fe(SCN )3 Fe(SCN* Fe(SCN )5当Fe 3与浓度很低的SCN (一般应小于5 103mol/L )只进行如下反应Fe 3 SCN Fe(SCN)2即反应被控制在仅仅生成最简单的Fe(SCN)2。
其平衡常数为[Fe(SCN)2 ]e[Fe 3 ]e [SCN ]e由于Fe(SCN)2是带有颜色的,根据朗伯-比尔定律,消光值与溶液浓度成 正比,实验时,只要在一定条件下,借助分光光度计测定平衡体系的消光值,从 而计算出平衡时的Fe(SCN)2的浓度[Fe(SCN)2 ]e ,进而再推算出平衡时Fe 3和SCN 的浓度[Fe 3 ]e 和[SCN ]e ,进而再推算一定温度下反应的平衡常数 ©实验时配制若干组(共4组)不同Fe 3起始浓度的反应溶液,其中第一组溶 液的Fe 3是大量的,当用分光光度计测定反应液在定温下消光值 E i ( i 为组数), 根据朗伯-比尔定律E K[Fe(SCN)2 h,e (K 为消光系数)由于1号溶液中Fe 3大量过量,平衡时SCN 全部与Fe 3络合(下标0表示 起始浓度),对1号溶液可认为[Fe(SCN)2 ]1,e =[SCN ]0学生姓名:大芒果 学生专业:化学教育 指导老师:林晓明贝U E i K[SCN ]o对于其余组溶液,E i K[Fe (SCN )2肌 两式相除并整理得[Fe (SCN )2 ]1,e 弓_[SCN ]始E i达到平衡时,在体系中[Fe 3 ]i,e [Fe 3]j [Fe(SCN)2h e [SCN ]i,e =[SCN ]i [Fe(SCN)2 ]*除第1组外各组(不同Fe 3起始浓度)反应溶液在定温下的平衡常数 K i,c 值三、仪器与试剂 (1) 实验仪器722型分光光度计1台 50mL 容量瓶8个刻度移液管10mL (2支)、5mL ( 1支) 25mL 移 液管(1 支) 50mL 酸式滴定管1支洗耳球、洗瓶 (2) 实验试剂1 10 3mol / L KSCN AR 0.1mol/L Fe NH 4 SO 42 A.R0.1mol/L HNO 3 A.R 1mol/L KNO 3 A.R四、实验步骤1. 取8个50mL 容量瓶,贴上标签。
实验一 分光光度计法测溶液化学反应的K一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解K 与反应物起始浓度无关。
3.掌握分光光度计的正确使用方法。
二、实验原理Fe 3+离子与SCN -离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN -离子的浓度增加时,Fe 3+离子与SCN -离子生成的络合物的组成发生如下的改变:()()232SCN SCN SCN SCN FeFe SCN Fe SCN ----+++--()()()234SCN SCN SCN SCN Fe SCN Fe SCN Fe SCN ----+---()()()23456SCN SCN SCN SCN Fe SCN Fe SCN Fe SCN ---------而这些不同的络离子颜色也不同。
由图可知,当Fe 3+离子与浓度很低的SCN -离子(一般应小于5×10-3mol·dm -3)时,只进行如下反应:()23Fe SCN Fe SCN ++-+即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。
其标准平衡常数23()///Fe SCN C K Fe C SCN C++-⎡⎤⎣⎦=⎡⎤⎡⎤⎣⎦⎣⎦ 根据朗伯-比尔定律,吸光度与溶液中Fe(SCN)2+络离子浓度成正比。
()20lg I A KL Fe SCN I+⎡⎤==⎣⎦(A 为吸光度,K 为常数, L 为液层厚度)。
借助于分光光度计测定溶液的吸光度,可计算出平衡时Fe(SCN)2+络离子的浓度以及Fe 3+离子和SCN -离子的浓度,从而求出该反应的平衡常数K 。
由于:(1) Fe 3+离子在水溶液中存在下列水解平衡11232322k k K Fe SCN FeSCN Fe H OFeOHH-+-+++++++快334222k k K FeOH SCN FeOHSCN FeOHSCN HFeSCNH O-+-+++++++快达平衡时22331134()/[][]//Fe SCN CK k k k k K H K H Fe C SCN C+--+++-⎡⎤⎛⎫⎛⎫⎣⎦=+÷+= ⎪ ⎪⎡⎤⎡⎤⎝⎭⎝⎭⎣⎦⎣⎦平平 K 与酸度有关。
液相平衡常数的测定
液相平衡常数的测定是化学热力学研究中的重要方面之一。
它指的是一种化学反应中
产物和反应物之间在液相中达到平衡时它们之间的浓度或活度比值。
液相平衡常数(Kc)
是描述一定温度和压力下化学反应平衡时反应物和生成物浓度比值的一种评价指标。
在化
学反应中,反应物与生成物在平衡状态下的浓度比值恒定,这个比值就是液相平衡常数。
在本文中,我们将介绍液相平衡常数的测量方法和其实验过程。
1. 理论基础
液相平衡常数(Kc)是一种描述反应在液相中的平衡程度的物理量。
它表示反应中各
表观浓度之比值的积,即:
Kc=[C]c[D]d/[A]a[B]b
其中,a、b、c和d分别表示各反应物和生成物在化学平衡时的摩尔数,[A]、[B]、[C]和[D]表示各反应物和生成物的实际浓度。
反应物和生成物之间的化学反应达到平衡时,Kc的值不随时间而改变。
换句话说,反应物和生成物的浓度比例是一个求定比例的平衡状态而非一种实时反应,这些下回再详细述。
Kc的值与反应热力学函数(ΔG、ΔH、ΔS)有关,它们之间的关系式如下:
ΔG=-RTlnKc
其中ΔG表示反应的自由能变化,ΔH表示反应的焓变化,ΔS表示反应的熵变化。
R
为气体常数,T为温度,Kc为液相平衡常数。
2. 实验设计
本实验中,我们将选取一种酸(H+)和碱(OH)反应制备水。
反应式为:
H+(aq)+OH-(aq)=H2O
反应平衡常数可以由反应物和生成物之间的摩尔比例关系得出。
首先,我们准备一定
量的酸和碱,再用洗净的滴定管逐滴加入水中,用酸碱滴定法测定其浓度。
我们可以在不
同温度下进行实验来测定液相平衡常数的值。
在本实验中,我们使用两种方法来测定液相平衡常数:酸碱滴定法和光度法。
3. 实验步骤
3.1 酸碱滴定法
(1)准备一定浓度的盐酸和氢氧化钠溶液。
(2)取紫色试剂(酚酞)标定溶液,将其中的一滴滴入pH为7的背景溶液中,转变为红色显示溶液中的氢离子浓度。
(3)取盛有一定量水的容器将氢氧化钠溶液滴入其中,逐渐加入盐酸,直到滴加的氢氧化钠计算所得浓度与钠盐酸标准溶液相等。
这时在试验容器中有氢氧化钠和盐酸共存,并正在消耗氢氧化钠。
(4)测试液体的pH和摩尔浓度,由此求出氢氧化钠消耗量和剩余量,进一步求出酸和碱的摩尔比率。
(5)通过此比率以及已知反应式根据反应物和生成物的摩尔数计算出液相平衡常数。
3.2 光度法
(2)以紫外光谱法测定水中的氢氧根离子浓度。
(3)下述某一温度下测定水中的氢氧化钠浓度,这是实验最主要的目的。
(4)稀释一定比例的溶液,测定其中氢氧根离子的吸收程度。
4. 结论。