临床试验流程图精编版
- 格式:doc
- 大小:42.50 KB
- 文档页数:2
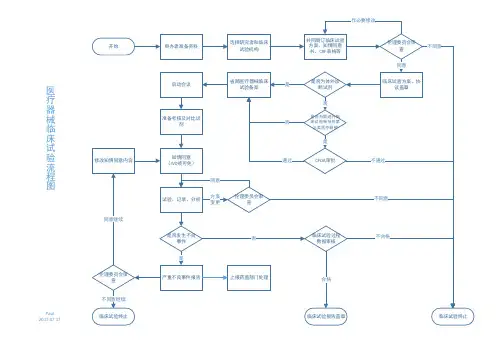


药物临床试验流程 申办者提岀药物临床试验申请
申办者提供SFDA 签发的临床
药物临床试验机构办公室审查、登记
探讨试验方案
专业组了解试验背景等情况
专业组根据情况决定是否接受试验, 填写《药物临床试验申请表》 药物临床试验机构办公室评估试验可行性,审核专业组的申请。
机构主任评估,决定是否接受试验
组织或参与试验方案研讨会
商讨试验费用,起草研究合同
机构主任与申办者签定合同
召开伦理委员会
伦理委员会表决通过
进行试验
:专业组 I :
机构办公室组织 试验启动会 匚 :申办者、协作科室
:检查场地、抢救设施
L : 专业组启动会议 :确定本次试验SOP 、流程 J _ _ _ _ _ _ -1
研究者手册、初步
试验药物检验报告
进行试验
机构办公室向申办者提交 CRF 第一联,退回试验用药物 项目负责人根据统计结果撰写小结 报告,组长单位撰写总结报告
机构办公室审核小结报告,最
后交申办者,小结报告归档
E
组长单位与申办者组织召开临床试验总结会
总结报告归档,与申办者办理相关手续
机构办公室提交财务报告,机构主任
审批,财务科发放劳务费或统一划帐 知情同意过程、签知情同意书 中期试验 协作会 试验数据记录 监查员、机构办公室的监查 <—[文件收集、归档 [ * "1 <3- 1项目负责人监督试验质量 <= 不良事件监查、处理、记录。

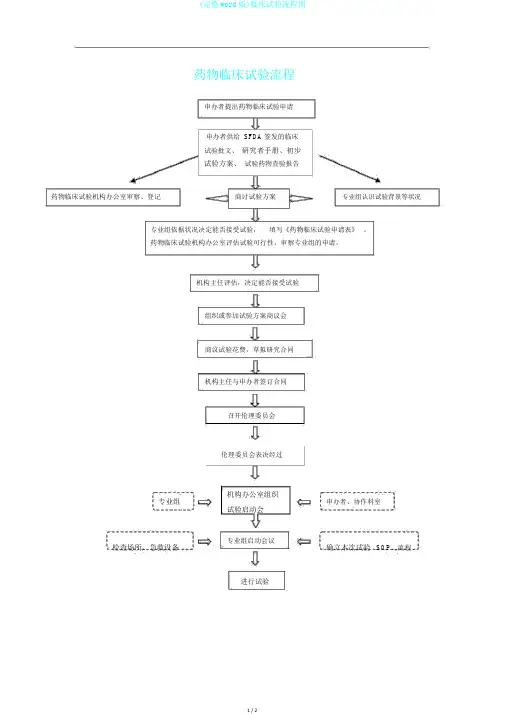
药物临床试验流程
申办者提出药物临床试验申请
申办者供给SFDA 签发的临床
试验批文、研究者手册、初步
试验方案、试验药物查验报告
药物临床试验机构办公室审察、登记商讨试验方案专业组认识试验背景等状况
专业组依据状况决定能否接受试验,填写《药物临床试验申请表》。
药物临床试验机构办公室评估试验可行性,审察专业组的申请。
机构主任评估,决定能否接受试验
组织或参加试验方案商议会
商议试验花费,草拟研究合同
机构主任与申办者签订合同
召开伦理委员会
伦理委员会表决经过
机构办公室组织
专业组申办者、协作科室
试验启动会
检查场所、急救设备专业组启动会议
确立本次试验SOP、流程进行试验
进行试验
受试者挑选药品管理
知情赞同过程、签知情赞同书中期试验文件采集、归档
协作会
试验数据记录项目负责人监察试验质量
监查员、机构办公室的监查不良事件监查、办理、记录
试验结束
向机构和有
严重不
良事件关单位报告
专业组整理、自查、审察CRF,移交
CRF及其余文件资料,退回试验用药
解盲
机构办公室审察CRF,整理、归档文件资料
机构办公室向申办者提交CRF 第一联,退回试验用药物
项目负责人依据统计结果撰写小结
报告,组长单位撰写总结报告
机构办公室审察小结报告,最
后交申办者,小结报告归档
组长单位与申办者组织召开临床试验总结会
总结报告归档,与申办者办理有关手续
机构办公室提交财务报告,机构主任
审批,财务科发放劳务费或一致划帐。


临床试验运行管理流程图
临床试验运行管理流程图
提供资料
资料登记、编码、建档、初审确定专业项目负责人、研究组成员CFDA 批件、试验药物药检报告、初步试验方案、研究者手册、临床前研究资料、文献资料
研究现场评估
查阅试验相关资料、参与设计研究方案
机构办公室组织专家库评估
申办者机构办公室
机构办主任、专业负责人及申办者
专业项目负责人及研究组成员
试验正式启动
临床试验前培训
药物准备、包装、设盲、编组、编号入选、排除标准进行受试者初筛选执行知情同意并获取知情同意书
定期访视受试者、及时填写CRF/SAE
试验结束
收回病例报告表并审核数据管理、统计分析
项目总结会,撰写并讨论总结报告整理、打印总结报告,原始资料归档
总结报告上报CFDA
发表试验结果
试验资料申报伦理委员会审议、批准
IEC 批件归档,试验用表印制
签署合同、发启动通知
研究组
急救设施、人员结构、在研项目情况、药物管理条件等的评估
试验项目全体相关人员
申办者及统计人员
专业项目负责人及申办者
机构办公室及申办者
机构主任及申办者
专业项目负责人及研究组
统计人员
专业项目负责人拟稿,主任或专家审定
机构办公室申办者
专业项目负责人及研究组
包括CRF/知情同意书、相关SOP 等的设计确定各岗位人员分工
临床试验方案、应急预案及
相关技术的培训,GCP 等相关法规、本院医疗护理质量管理文件、临床试验管理文件的强化培训
机构内部质量管理及外部质量管理共同对试验进程和数据记录监查、核实和评估;
期间组长单位负责组织中期协调会、总结会及回答协作单位疑问
签字立项。