微生物原始记录(大肠杆菌)
- 格式:doc
- 大小:46.00 KB
- 文档页数:4
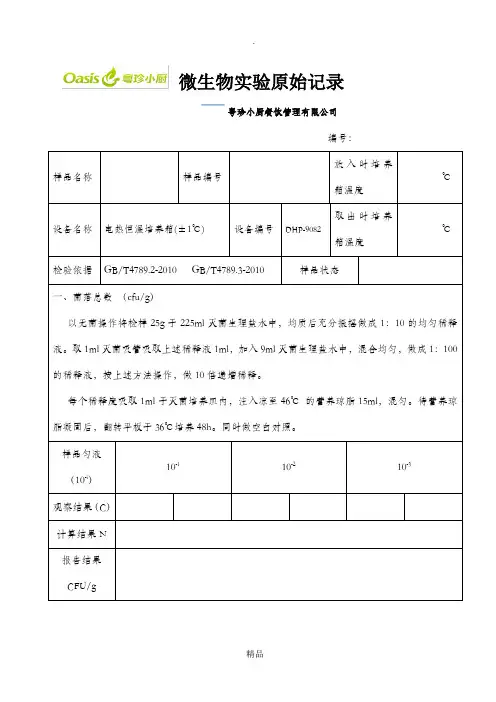
微生物实验原始记录
粤珍小厨餐饮管理有限公司
编号:
放入时培养
℃样品名称样品编号
箱温度
取出时培养
设备名称电热恒温培养箱(±1℃)设备编号DHP-9082
℃
箱温度
检验依据GB/T4789.2-2010 GB/T4789.3-2010样品状态
一、菌落总数(cfu/g)
以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释
液。
取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100
的稀释液,按上述方法操作,做10倍递增稀释。
每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。
待营养琼
脂凝固后,翻转平板于36℃培养48h。
同时做空白对照。
样品匀液
10-110-210-3(10-i)
观察结果(C)
计算结果N
报告结果
CFU/g
主检:审核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
邹平县产品质量监督检验所检验原始记录
共页第页
主检:校核:检验日期:年月日
如有侵权请联系告知删除,感谢你们的配合!。

利用分子生物学方法鉴定食品中的致病微生物(大肠杆菌)实验设计实验目的:利用分子生物学方法鉴定食品中的致病微生物(大肠杆菌)。
实验材料和仪器:1.食品样品(可能受到大肠杆菌污染的食品样品)2.大肠杆菌纯培养物3.DNA提取试剂盒4.PCR试剂盒5.扩增仪6.DNA凝胶电泳仪7.DNA标记物8.电泳凝胶9.UV透射仪实验步骤:1.向含有大肠杆菌的培养物中添加适量的无菌水,制备测定标准曲线用工作溶液。
通过适量稀释,确保能获得包含一定数量大肠杆菌的工作溶液。
2.称取加热灭活的食品样品,如肉类或蔬菜,使用细菌培养基作为负对照。
3.提取食品样品中的细菌DNA。
使用DNA提取试剂盒,按照生产商的说明书操作,从食品样品中提取总DNA。
4. 设计适用于大肠杆菌的引物。
从GenBank数据库中检索适合大肠杆菌的引物序列并合成引物。
5.进行PCR扩增反应。
在PCR反应管中加入模板DNA,引物和PCR试剂盒提供的反应液,将其放入扩增仪中进行PCR扩增。
6.准备凝胶和电泳条件。
在适当的浓度下制备琼脂糖凝胶,并根据引物大小和预期DNA片段大小调整电泳条件。
7.进行PCR产物的电泳检测。
取PCR反应混合液5μL,以及DNA标记物,放入琼脂糖凝胶槽中进行电泳。
8.照相检测结果。
使用UV透射仪照射电泳凝胶,检查PCR产物的大小和带。
如果有大小适合的带出现,则该食品样品中存在大肠杆菌。
9.分析结果。
根据电泳凝胶的结果,判断食品样品中大肠杆菌的存在与否。
实验注意事项:1.实验过程中保持操作环境的高度无菌。
2.准备PCR反应混合液时,避免污染和交叉污染。
3.扩增后的产物严禁回收,以避免引入假阳性结果。
4.进行凝胶电泳时,注意电泳条件的调整,确保PCR产物可以清晰可见。
总结:该实验利用分子生物学方法对食品中的致病微生物(大肠杆菌)进行鉴定。
通过提取食品样品中的细菌DNA,并使用PCR扩增大肠杆菌特异序列,通过电泳检测分析PCR产物的大小和带,判断食品样品中是否存在大肠杆菌。

一、实验目的1. 掌握大肠杆菌检测的基本原理和方法;2. 学会使用国标法测定大肠杆菌样本的细菌总数;3. 提高微生物实验操作技能,为后续相关实验奠定基础。
二、实验原理大肠杆菌(Escherichia coli)是一种革兰氏阴性菌,广泛存在于人类和动物肠道中,属于条件致病菌。
本实验采用国标法测定大肠杆菌样本的细菌总数,主要利用大肠杆菌在LB培养基上生长繁殖的特性,通过计数菌落数来估算大肠杆菌的浓度。
三、实验器材1. 培养箱;2. 移液管(10只);3. 锥形瓶(250ml,12只);4. 大试管(5只);5. 试管架;6. 平皿(45个);7. 大烧杯(500ml,1个);8. 电子天平;9. 纱布;10. 脱脂棉;11. 灭菌锅;12. pH计或pH试纸;13. 电炉;14. 石棉网;15. 铁架台;16. 量筒(100ml,1个);17. 橡皮手套;18. 超净台。
四、实验药品1. 磷酸盐缓冲液;2. 蒸馏水;3. LB培养基;4. 琼脂;5. 5%NaOH;6. 5%HCl。
五、实验步骤1. 培养基制备(1)称取成品LB 3.1241g和琼脂1.8756g放入250ml的洁净锥形瓶中;(2)用量筒量取125ml的蒸馏水加入锥形瓶中,制成培养基;(3)用棉花堵住锥形瓶的瓶口,用牛皮纸包住瓶口,用橡皮筋扎牢;(4)将培养基放入灭菌锅中,在121摄氏度下灭菌20min;(5)灭菌后放入超净台中备用。
2. 样本处理(1)取适量样本(如食品、水等);(2)用无菌生理盐水进行梯度稀释;(3)取适量稀释液加入平皿中,制成平板;(4)将平板放入培养箱中,在37摄氏度下培养24h。
3. 菌落计数(1)观察平板,找出菌落数在30-300之间的平板;(2)用移液管吸取适量菌液,加入锥形瓶中;(3)在锥形瓶中加入适量的5%NaOH溶液,充分振荡;(4)将锥形瓶放入培养箱中,在37摄氏度下培养24h;(5)观察锥形瓶中的菌落生长情况,记录菌落数。

⼤肠杆菌微⽣物培养实验报告及评价标准实验1 微⽣物的分离、培养及计数实验原理纯化分离:⼈为提供适宜的菌落⽣长的条件(包括营养、温度、Ph 等)。
⽤平板划线法,通过接种环在琼脂固体培养基表⾯连续划线的操作,将聚集的菌种逐步稀释分散到培养基的表⾯。
在数次划线后培养,可以分离到由⼀个细胞繁殖⽽来的⾁眼可见的⼦细胞菌落。
筛选:转基因⼤肠杆菌有抗氨苄青霉素基因,所以在含有氨苄青霉素的LB 培养基中可以正常繁殖长成菌落。
⽽普通的⼤肠杆菌没有抗氨苄青霉素基因,咋含有氨苄青霉素的LB 培养基中不能繁殖。
由此可进⾏⼤肠杆菌的筛选。
梯度稀释并计数:通过浓度梯度稀释把液体培养基培养的⼤肠杆菌稀释到⼀定浓度,⽤稀释涂布平板法,然后将不同稀释度的菌液分别涂布到琼脂固体培养基的表⾯进⾏培养。
在稀释度⾜够⾼的菌液⾥,聚集在⼀起的微⽣物将被分散成单个细胞,从⽽能在培养基表⾯形成单个的菌落。
由此可计数计算⼤肠杆菌的数量。
实验⽬的1. 通过制备LB 固体培养基,对平板进⾏划线等,学会使⽤固体LB 平板。
2. 通过⽤液体培养基,学会对微⽣物进⾏扩⼤培养。
3. 通过稀释,学会⽤计数器对微⽣物进⾏计数。
实验材料和药品待分离的⼤肠杆菌菌液、⾼压蒸汽灭菌锅、LB 固体培养基、LB 液体培养基、接种环、玻璃涂布器、培养⽫、恒温培养箱、摇床、酒精灯、⽆菌⽔、移液枪、EP 管实验步骤(⽤简单的流程图表⽰)实验数据的记录与分析(如照⽚、表格等)稀释倍数104105⼤肠杆菌单个菌落个数837799111812平均数86.313.7浓度 1.726×1070.274×107实验结果与讨论结果:稀释了105计算出来的结果约为1.726×107ml/cm^3稀释了104计算出来的结果约为0.274×107ml/cm^3全组数据计算出来结果为2.233×107ml/cm^3讨论:在稀释倍数为104的试验中⼤肠杆菌菌落较少,原因可能是在稀释过程操作中,震荡不够,⽽且由于不⼩⼼洒了半管104稀释液,所以取液接种的时候底层的⼤肠杆菌数量偏少了。


第三章大肠菌群测定一、大肠菌群检验( 一) 检验方法( 二) 培养基( 三 ) 检验时应注意事二、大肠菌群的卫生学意义大肠菌群是评价食品卫生质量的重要指标之一,目前已被国内外广泛应用于食品卫生工作中。
该菌群主要来源于人及温血动物粪便,一般多用来作为食品中的粪便污染指标。
过去我国在大肠菌群的检验方面经验不多,对该菌群的认识也不够充分。
1974 年全国修订食品卫生细菌检验方法座谈会和1976 年全国食品卫生标准会议建议以大肠菌群作为粪便污染指标菌,并提出进行有关大肠菌群方面的科研工作。
为此,我们成立了大肠菌群科研协作组,对犬肠菌群的检验方法( 包括快速检验方法) 及其卫生学意义进行了广泛的科学研究和实践,取得了一定成绩,为制订大肠菌群检验方法提供了科学依据。
在这次修订l976年版食品卫生检验方法的过程中,大肠菌群科研协作组又于1983 ~1985 年对大肠菌群检验方法进行了实验研究,并作了对比观察,同时对国内常用的大肠菌群快速检测方法也进行了研讨,为这次修订国家标准食品卫生检验方法微生物学部分中的大肠菌群测定提供了科学依据。
大肠菌群不是细菌学上的分类命名,而是根据卫生学方面的要求,提出来的一组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致。
其定义为:系指一群需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。
有些科学工作者又用靛基质、甲基红、 V~ P、柠檬酸盐、硫化氢、明胶、动力和 44.5℃乳糖分解等试验,将这群细菌再分为大肠艾希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。
不论分法如何,对大肠菌群的判定,均应以上述定义为基础。
一、大肠茵群检验( 一) 检验方法1.乳糖发酵试验。
以无菌操作采取样品,采取量及稀释倍数,依据国家或当地卫生标准要求及样品污染情况而定。
将待检样品接种于乳糖胆盐发酵管内,接种量在 l m J 以上者,用双料乳糖胆盐发酵管, lm1 及 1mI 以下者,用单料乳糖胆盐发酵管。

微生物检测原始记录一、目的本文档旨在规定微生物检测的原始记录格式和内容,以确保检测过程和结果的准确性和可追溯性。
二、记录格式1、记录纸张:使用A4纸,横向排列,页边距至少留有2cm。
2、记录标题:在页面顶部居中书写“微生物检测原始记录”。
3、日期和实验室名称:在页面右下角书写检测日期和实验室名称。
4、检测样品信息:在页面中部或适当位置填写样品信息,包括样品名称、编号、来源、处理方式等。
5、检测项目和指标:在页面中部或适当位置列出检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等。
6、检测方法和仪器:在页面中部或适当位置描述检测所采用的方法和使用的仪器设备。
7、检测结果记录:在页面中部或适当位置详细记录每个检测项目的实验数据,并确保数据准确、清晰、可追溯。
8、结论和建议:在页面底部或适当位置总结检测结果,并给出相应建议或处理意见。
9、检测人员签名:在页面右下角或适当位置由检测人员签名,以示负责。
10、备注:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
三、记录内容1、样品信息:样品名称、编号、来源(如生产批次、产地等)、处理方式(如取样、前处理等)。
2、检测项目和指标:根据实际需要确定检测项目和指标,如菌落总数、大肠杆菌、沙门氏菌等微生物指标,以及可能的化学指标等。
3、检测方法:描述微生物检测所采用的方法,如国标法、第三方检测方法等。
同时应注明所用方法的版本号和发布机构。
4、仪器设备:列出在检测过程中使用的所有仪器设备的名称、型号、编号和使用状态等信息。
5、实验数据记录:详细记录每个检测项目的实验数据,包括观察结果、计数结果、吸光度值等。
数据应准确、清晰、可追溯,并附上必要的图表和曲线图。
6、结论和建议:根据检测结果给出相应的结论和建议,如是否符合标准要求,是否需要进一步处理或跟进等。
7、其他信息:根据需要添加其他相关信息,如样品异常情况说明、引用标准、注意事项等。
8、检测人员签名:由检测人员签名,以示负责。

微生物检验原始记录日期:20XX年X月X日实验人员:XXX实验目的:1.研究不同物质对微生物生长的影响;2.测定微生物在不同条件下的生长速率;3.探究微生物在不同温度下的生长变化。
实验材料:1.维生素B1溶液(10g/L);2.蔗糖溶液(10g/L);3.葡萄糖溶液(10g/L);4.酪蛋白溶液(10g/L);5.红藻提取物溶液(10g/L);6.无菌琼脂培养基;7.无菌平板;8.无菌试管。
实验步骤:1.制备无菌培养基1)加热琼脂培养基至溶解;2)将溶解的琼脂培养基加入试管内;3)用无菌胶头滴管将培养基均匀地分注于无菌平板上;4)将平板培养基放置于室温下,待其凝固。
2.将维生素B1溶液、蔗糖溶液、葡萄糖溶液、酪蛋白溶液和红藻提取物溶液分别加入无菌试管中,每种物质各占10个试管。
3.将每个试管中的液体用无菌胶头滴管均匀地分注于不同编号的无菌平板上。
4.打开消毒柜门,将作用于琼脂培养基的紫外灯打开并进行照射,确保平板完全消毒。
5.在实验室的洁净工作台上,用无菌移液器将各个试验组织的接触培养基的无菌操作。
6.将分配彼此间较远、避免相互干扰的生长时间的培养基标上编号,放入恒温箱中。
7.将标注为控制组的培养基放置于室温下,其余的培养基分别放置在不同温度的恒温箱(30℃、37℃、4℃)中,进行培养。
8.在培养基上观察微生物生长情况,并记录观察结果。
实验结果:在维生素B1溶液的培养基中,观察到微生物在两天后有较好的生长情况,在第四天生长速率达到最高峰。
在蔗糖溶液的培养基中,微生物在一天后开始生长,并在第二天迅速增加,但随后生长速率略有下降。
在葡萄糖溶液的培养基中,微生物在一天后开始生长,但生长速率较缓慢,在第三天达到峰值。
在酪蛋白溶液的培养基中,微生物在一天后开始生长,并在第二天显著增加,但在第三天数量趋于稳定。
在红藻提取物溶液的培养基中,微生物在两天后开始生长,生长速率相对较慢,但在第五天达到最高峰值。
在不同温度下的培养基中,观察到微生物在30℃的恒温箱中生长速率最快,37℃次之,而在4℃的恒温箱中微生物生长速率非常缓慢。

从饮水中分离大肠杆菌①制作伊红美蓝培养基,趁热注入培养皿中,凝成平板,待用。
②用灭过菌的锥形瓶盛取河水或沟水,按1:10稀释。
③取0.1毫升稀释液接种于伊红美蓝培养基上。
用平板划线分离法进行分离。
④将划线后的培养皿倒置37℃温箱中培养18~24小时。
培养基中会出现大肠杆菌菌落,菌落中心呈暗蓝黑色,发金属光泽。
⑤将菌落接种于斜面培养基上(由营养琼脂培养基制成)。
大肠杆菌的微生物学检查细菌的分离鉴定肠道外感染取中段尿、血液、脓液、脑脊液等,腹泻者取粪便。
粪便标本直接接种肠道杆菌选择性培养基。
血液需先经肉汤增菌,再转种血琼脂平板。
其他标本可同时接种血琼脂平板和肠道杆菌选择性培养基。
37℃孵育18~24小时后,观察菌落并涂片染色镜检。
采用一系列生化反应进行鉴定。
肠致病性大肠杆菌须先作血清学定型试验。
必要时检定肠霉毒素。
泌尿系统除确定大肠杆菌外,还应计数,每毫升尿含菌量≥100,000时,才有诊断价值。
卫生细菌学检查大肠杆菌不断随粪便排出体外,污染周围环境和水源、食品等。
取样检查时,样品中大肠杆菌越多,表示样品被粪便污染越严重,也表明样品中存在肠道致病菌的可能性越大。
故应对饮水、食品、饮料进行卫生细菌学检查。
细菌总数:检测每毫升或每克样品中所含细菌数,采用倾注培养计算。
我国规定的卫生标准是每毫升饮水中细菌总数不得超过100个。
大肠菌数指数:指每立升中大肠菌群数,采用乳糖发酵法检测。
我国的卫生标准是每1000ml饮水中不得超过3个大肠菌群;瓶装汽水、果汁等每100ml大肠菌群不得超过5个。
实验二大肠菌群(M.R.N.)检验1 目的了解大肠菌群在食品卫生检验中的意义学习并掌握大肠菌群的检验方法2 原理大肠菌群系指一群能发酵乳糖,产酸产气,需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。
2、实验结果与分析2.1、细菌总数检测结果2.1.2、细菌总数的计算与报告根据菌落总数的计算方法:1、若只有一个稀释度平板上的菌落术在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每克(或毫升)中菌落总数结果。
2、若有两个连续稀释度的平均菌落数载适宜计数范围内时,按下式计算:N=∑c/[(n1+0.1n2)d]式中:N—样品中菌落数;∑C—平板(含适宜范围菌落数的平板)菌落数之和;n1—第一个适宜稀释度平板上的菌落数;n2—第二个适宜稀释度平板上的菌落数;d—稀释因子(第一稀释度)为1.75x107;在浓度10—6(g/ml)的时候,大肠杆菌的细菌总数约为1.60x107;在浓度10—7(g/ml)的时候,大肠杆菌的细菌总数约为2.01x107。
分析数据可知,在浓度10—7(g/ml)的时候,细菌总数远大于其他两个梯度,这与常理不符。
那么有可能是实验过程中的错误导致,可能是稀释不够、密封不紧、没有进行无菌操作等因素有关。
2.2、大肠菌群检测结果2.1.1、初发酵各浓度梯度阳性管数统计附:检验原始记录检验原始记录检测记录与结果培养基配制:样品配制:1、 固体样品,无菌称取25g 样品加225ml 生理盐水,均质。
2、 液体样品,需稀释的,吸取25ml 于225生理盐水,混匀。
菌落总数:检验依据:GB/T4789.2-2008大肠杆菌:检验一句GB/T4789.3-2003大肠杆菌:检验一句GB/T4789.3-2003注:“P ”表示阳性结果,“N ”表示阴性结果检验起止时间:2011年09月25日至2011年09月27日检测人:复核人:。
食品中大肠埃希氏菌计数(MPN法)原始记录
编号: WJK/JL-W-
061
共页第页
样品名称批
号:样品编
号:
样品性
状数
量
收样日
期年月日检测日期年月日
检测项
目
检测地点:微生物洁净室检测环境(温、湿度等)
检测依据(方法): GB/T4789.38-
2012
检测仪器编
号:
检验记录与结果
自总大肠菌群LST肉汤试验中的阳性管(产气)中取1滴培养物转种于EC肉汤管中,置44.5℃水浴箱内,培养24±2h~48±2h,如有产气者分离EMB平板培养。
经36℃±1℃培养18~24h,有典型菌落生长,进行革兰氏染色和生化试验,根据鉴定LST肉汤阳性管数查MPN表,报告每克(或毫升)样品中大肠杆菌MPN 值。
大肠杆菌计数
EC培养基(产气管数)
EMB平板
革兰氏染色镜检
靛基质(阳性管数)
甲基红(阳性管数)
VP试验(阳性管数)
柠檬酸盐(阳性管数)
结果
检测人:复核人:
年月日年月日。
第三篇主要的病原微生物第十三章病原细菌第三节大肠杆菌大肠杆菌(Escherichia coli)是动物肠道的正常菌群,一般不致病,并能合成维生素B和K,产生大肠杆菌素,抑制致病性大肠杆菌生长,对机体有利。
但致病性大肠杆菌能使畜禽发生大肠杆菌病。
一、生物学特性(一)形态与培养大肠杆菌是中等大小,两端钝圆的革兰氏阴性杆菌(图13-7),无芽孢,大多数菌株有周鞭毛和菌毛。
本菌为兼性厌氧菌。
对营养要求不高,在肉汤中呈均匀浑浊生长,管底有黏性沉淀物,液面管壁有菌环。
在营养琼脂培养基上形成中等大小光滑型菌落;一些致病菌株在绵羊血琼脂平板上呈β溶血;在伊红美蓝琼脂平板上形成紫黑色带金属光泽的菌落(图13-8);在麦康凯琼脂上18~24h后形成红色菌落(图13-9);在远滕氏培养基上形成红色带金属光泽的菌落。
在SS琼脂上一般不生长或生长很差,生长者呈红色(图13-10)。
大肠杆菌能分解葡萄糖、乳糖、麦芽糖、甘露醇产酸产气,靛基质试验阳性,MR试验阳性,V—P试验阴性,不能利用枸橼酸盐,不产生硫化氢。
(二)抗原类型大肠杆菌具有O抗原、K抗原和H抗原三种主要抗原。
目前O抗原有171种,H抗原60种,K抗原103种。
K抗原位于细胞壁外层,根据K抗原的物理性质又可分为L、A和B三种主要型别,表示大肠杆菌血清型的方式是O138:K88(B):H12。
(三)抵抗力大肠杆菌的抵抗力较其他肠道杆菌强,加热60℃15min仍有部分细菌存活。
在自然界生存力较强,土壤、水中可存活数周至数月。
胆盐和煌绿等对大肠杆菌有抑制作用。
二、致病性大多数大肠杆菌在正常条件下是不致病的共栖菌,存在于人和动物的肠道内,在特定条件下可致大肠杆菌病。
但少数大肠杆菌与人和动物的大肠杆菌病密切相关,它们是病原性大肠杆菌,在正常情况下,极少存在于健康机体内。
根据毒力因子与发病机制的不同,可将与动物疾病有关的病原性大肠杆菌分为五类:产肠毒素大肠杆菌(ETEC)、产类志贺毒素大肠杆菌(SLTEC)、肠致病性大肠杆菌(EPEC)、败血性大肠杆菌(SEPEC)及尿道致病性大肠杆菌(UPEC)。
、实验方案设计实验数据原始记录:随时间的变化大肠杆菌液吸光度的数据(括号内数字表示稀释倍数)曲线图时间/h01 3.756788.5910OD6000.0730.0730.0790.2820.456 1.105 1.168 1.662 2.284时间/h1112131418.3320.52324OD600 2.564 2.016 3.020 2.605 3.315 2.860 3.024 3.324时间/h01 3.756788.5910111318.3320.5 0应00.0730.0730.0790.2820.456 1.105 1.168 1.662 2.284 2.564 3.020 3.315 2.86时间/h01 3.756788.591011OD6b00.0730.0730.0790.2820.456 1.105 1.168 1.662 2.284 2.564六•参考文献[1] .牛天贵•食品微生物学实验技术•第1版•北京:科学出版社,2010.[2] .杨革.微生物学实验教程.第2版.北京:科学出版社,2010.[3] .何国庆,贾英民,丁立孝等.食品微生物学.第2版.北京:中国农业大学出版社,2009.[4] .周德庆,胡宝龙.微生物学实验教程.第2版.北京:高等教育出版社,2006.前12小时的大肠杆菌的生长曲线图七•教师对实验方案设计的意见签名:二、实验报告实验现象:随着培养时间的增加,培养基里的液体变得越来越混浊,所散发出来的味道也越来越浓,味道很难闻。
实验结果:大肠杆菌在培养基里生长繁殖,数量越来越多,达到一定数量后,增长速度变慢,后大肠杆菌进行营养和空间的竞争,有些大肠杆菌死亡,最后数量不断减少,直至变为2 •对实验现象、实验结果的分析及其结论分析:①随着培养时间的增加,培养基里的液体变得越来越混浊,所散发出来的味道也越来越浓,味道很难闻,是因为大肠杆菌增长迅速,后来数量达到顶峰,此时培养基内的营养物质已被消耗殆尽,大肠杆菌进行营养和空间的竞争,有些大肠杆菌死亡,最后数量不断减少,直至变为0。
微生物检验原始记录
受理编号检()号第页/共页
检验依据GB15979—2002 《一次性使用卫生用品卫生标准》
一、实验器材
1. 试验菌株名称:大肠杆菌,菌株号:8099,培养代数代,琼脂斜面培养基培养,培养条件:
2. 试剂及培养基配制、灭菌见《试剂及培养基配制记录C》:
第1次;
第2次;
第3次。
3.恒温水浴箱:编号。
4. 恒温培养箱:编号。
5.秒表:编号
6.样品名称:。
有效成份:,含量:,批号:。
二、方法
1. 操作步骤:按GB15979—2002 附录C4溶出性抗(抑)菌产品抑菌性能试验方法操作程序进行。
受理编号:()号第页/共页
三、结果
1. 第1次试验对大肠杆菌的抑菌效果
作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%) 2
5
10
20
阳性对照:接种稀释倍数:
平皿生长菌数: cfu/皿
菌液浓度: cfu/ml。
阴性对照:阴性对照:菌生长。
受理编号:检()号第页/共页
2. 第2次试验对大肠杆菌的抑菌效果
作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%) 2
5
10
20
阳性对照:接种稀释倍数:
平皿生长菌数: cfu/皿
菌液浓度: cfu/ml。
阴性对照:阴性对照:菌生长。
3. 第3次试验对大肠杆菌的抑菌效果
作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%)2
5
10
20
阳性对照:接种稀释倍数:
平皿生长菌数: cfu/皿
菌液浓度: cfu/ml。
阴性对照:阴性对照:菌生长。
受理编号:检()号第页/共页
4. 结果处理: 三次试验平均结果
对大肠杆菌的抑菌效果
作用时间 菌药管菌数 抑菌率 (min ) (cfu/ml ) (%) 2
5
10
20
阳性对照:菌液浓度: cfu/ml 。
阴性对照: 菌生长。
5.计算公式:
(1)接种稀释倍数=(V1/V2)×A/B= (5.0/0.5)×A/0.5=20A
式中V1为接种管(PBS4.5mL+菌药混合液0.5mL )液体体积;V2为接种管中菌药混合液体积(0.5mL );A 为接种前中和管液体稀释倍数;B 接种样液体积(0.5mL )。
(2)菌药管菌数或阳性对照菌液浓度(cfu/mL )=平皿平均生长菌数(cfu/皿)×接种稀释倍数
(3)
(1)100=-⨯菌药管菌数
抑菌率%阳性对照
(以下空白)
检验者: 复核者:。