chap.5 手性分子(有机化学)
- 格式:ppt
- 大小:2.34 MB
- 文档页数:46

有机化学手性分子与手性药物材料与化学工程系12级应化(1)班左旋海螺的螺壳都是右旋的,出现左旋螺壳的概率是百万分之。
我们吃的如甘蔗汁制的或甜莱汁制的糖,它们的分子都是右旋的。
人体内氨基酸分子都是左旋的,而淀粉的分子都是右旋的,传递遗传信息的脱氧核糖 核酸(DNA),95%以上呈右旋。
星系的运动都呈圆形、椭圆形或涡旋形运动,多是左旋。
多数藤本植物如牵牛花、扁豆等的茎蔓是右旋的。
然界中的手性 右旋长瓣兜兰花两侧长瓣的螺旋是左右对称的,右侧是左旋,左侧是右旋。
《科学》化学概念中的手性镜象不能重合的现象。
称为手性分子,手性分子都具有旋光性;不具有手性的分子称为非手性分子,无旋光性。
由于含一个不对称碳原子的化合物具有手性,这与其呈现手性特征的中心碳原子有关,因此这个中心碳原子称为手性中心,称其不对称碳原子为手性碳原子。
手性碳不不手性分子的特征所谓手性碳原子,是指饱和碳原子上连有四个完全不同的原子或原子团,常用火号予以 标注。
* H_C_Cl非手性分子两者可以重合什么是手性 手互为手性碳标记2.含有一个手性碳原子的分子往往具有手性。
含有多个手性碳原子的分子 不一定都具有手性。
例如:2,3-丁二醇的三种立体结构III 的结构具有对称中心,为非手性分子,与I 和n 均不成镜像,互为非对映异构体。
互为镜像,不能重合,均为手性分子。
I 和n 互为对映异构体 小结:手性分子与非手性分子不能与镜象叠合的分子叫手性分子,而能叠合的叫非手性分子。
综上所述:物质分子凡在结构上具有对称面或对称中心的,均不具有手性,则无旋光性;反之,在结构上既不具有对称面,也不具对称中心的,在这种分子具有手性,它与镜像互为对映异构体,不能重叠,故具有旋光性。
除了含有一个手性碳原子的化合物具有手性,还有含其他手性因素的化合物如含手性氮原子等化合物,以及某些不含手性碳原子但具有手性的化合物。
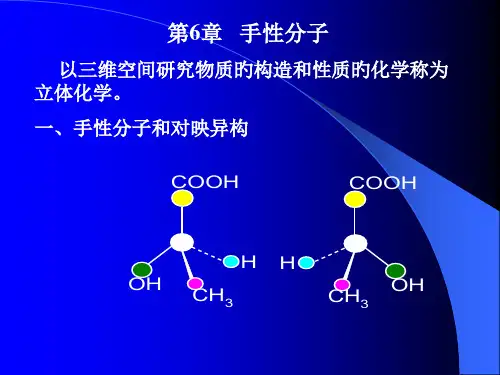
CH 33H ——OHHO ——H CH 3 HO-U-H H —OHC H 3II翻转180°,完全重合 帆川,明 III对映体的表示方法两种方法:1.透视法直观,但书写麻烦,不适用于复杂化合物2.Fischer投影式使用方便,适用于简单和复杂化合物1.透视法实线纸面上的键虚线伸向纸后方的键锲形线伸向纸前方的键COOHCOOHO2、Fischer投影式①碳链竖置,且编号小者置于上端;②上下朝里,左右朝外;COOH观察COOH■HC OH OHC H.3COOHHOHY透视式CH3Fische r投影式命名规则:R、S标记法的规则①找出手性C原子②C原子上的基团依从大到小次序排列③若为顺时针排列,叫做R-构型;若为逆时针排列,叫做S-构型。

有机化学基础知识手性与不对称合成有机化学基础知识:手性与不对称合成在有机化学中,手性和不对称合成是两个重要的概念。
手性是指分子或化合物具有非重叠的镜像对称结构,分为左旋(S)和右旋(R)两种构型。
不对称合成则是指通过反应使得手性化合物生成的过程。
手性与不对称合成的重要性在于它们在生物学、药物学和有机合成领域具有广泛应用。
手性分子在生物体中扮演重要的角色,药物分子的手性性质直接影响其在体内的活性和毒性。
此外,许多有机合成过程中需要获得高立体选择性的产物,这就需要使用不对称合成方法。
一、手性的定义与属性手性(chirality)是指分子或化合物不能与其镜像完全重合的性质。
简单来说,手性分子就像是左右手,无法完全重叠,这是由于手性分子的立体结构具有非对称性。
手性的性质包括以下几个方面:1. 手性分子无旋转轴或镜面反射面:旋转或镜面反射一个手性分子,无法使其和源分子完全重合,这就是左旋和右旋构型的来源。
2. 左旋(S)和右旋(R)构型:对于手性分子,以手的方式分别沿顺时针和逆时针方向围绕分子中心生成立体结构,可得到左旋(S)和右旋(R)构型,确定手性分子的构型是有机化学的重要内容。
3. 光学活性:左旋和右旋构型的手性分子之间可以通过手性光学活性来区分,其中旋光(optical rotation)是一种常用的手性分析方法。
二、手性分子的来源手性分子的来源多种多样,包括以下几种常见的方式:1. 手性衍生物:通过对不对称化合物的反应进行处理,引入手性基团,从而生成手性产物。
2. 手性诱导:在合成过程中,通过使用手性诱导剂,使得产物具有手性结构。
3. 手性模板:在有机合成中,通过使用手性模板,使得反应生成具有手性结构的产物。
4. 生物来源:许多生物体内产生的分子都是手性的,因此通过利用生物体提取或合成方式,可以获得手性分子。
三、不对称合成方法不对称合成是指通过有选择性地控制反应条件、底物结构或合成步骤,使得手性化合物生成的合成方法。

有机化学基础知识点手性化合物的分离与合成有机化学基础知识点:手性化合物的分离与合成手性化合物在有机化学领域中扮演着重要的角色,它们具有两种非对称的镜像异构体,即左旋和右旋。
手性化合物的分离与合成是有机化学中的一项重要技术和研究内容。
本文将探讨手性化合物的分离与合成的基础知识点。
一、手性化合物的分离方法1. 基于手性配体的手性柱层析法手性柱层析法是一种基于手性配体与目标分子之间的亲和性进行分离的方法。
通过选择适当的手性配体,可以实现对手性化合物的分离纯化。
例如,利用氨基酸衍生物作为手性配体,可以成功地分离出手性氨基酸和手性药物等。
2. 经典拆分结晶法经典拆分结晶法是一种通过晶体生长的方式分离手性化合物的方法。
通过合适的溶剂和配体选择,可以在晶体生长过程中实现手性化合物的拆分和纯化。
这种方法适用于一些具有较高拆分度的手性化合物。
3. 手性萃取法手性萃取法是一种利用手性选择性较大的手性萃取剂对手性化合物进行分离的方法。
通常通过控制温度、pH值和萃取剂浓度等条件,实现对手性化合物的选择性萃取。
手性萃取法在手性酮、手性醇以及手性药物等的分离中得到了广泛应用。
二、手性化合物的合成方法1. 左旋-右旋互换法左旋-右旋互换法是一种将一种手性化合物转化为其对映异构体的方法。
通常可通过二氧化硫气体的作用,将左旋手性化合物转化为右旋手性化合物,或者通过酸碱反应进行互换。
这种方法在手性药物和手性农药的合成中得到了广泛应用。
2. 手性催化剂的应用手性催化剂是一种能够选择性地促使手性化合物发生反应的催化剂。
通过催化剂的选择,可以实现手性化合物的不对称合成。
例如,手性金属配合物催化剂在不对称氢化和不对称还原反应中起到了关键作用。
3. 有机合成中的修饰法有机合成中的修饰法是一种通过对已有手性分子进行化学修饰,合成新的手性分子的方法。
通过对已有手性分子的保留或改变官能团,可以得到一系列具有不同手性的化合物。
这种方法在新药开发和杂环合成中得到了广泛应用。


大学有机化学立体化学基础手性分子讲义一、教学内容1. 手性碳原子:介绍手性碳原子的定义、判断方法以及手性碳原子的性质。
2. 手性分子:介绍手性分子的定义、分类以及手性分子的性质。
3. 手性分子的光谱性质:介绍手性分子在不同光谱范围内的表现形式,如红外光谱、紫外光谱等。
4. 手性分子的化学反应:介绍手性分子在化学反应中的特性,如不对称催化、手性分子的选择性反应等。
5. 手性分子的应用:介绍手性分子在医药、农药、材料科学等领域的应用。
二、教学目标1. 了解手性碳原子的定义和判断方法,掌握手性碳原子的性质。
2. 掌握手性分子的定义和分类,了解手性分子的性质。
3. 了解手性分子的光谱性质,认识手性分子在不同光谱范围内的表现形式。
4. 理解手性分子在化学反应中的特性,如不对称催化、手性分子的选择性反应等。
5. 了解手性分子在医药、农药、材料科学等领域的应用。
三、教学难点与重点重点:手性碳原子的判断方法、手性分子的性质、手性分子的光谱性质、手性分子的化学反应。
难点:手性分子的分类、手性分子在不同光谱范围内的表现形式、手性分子在化学反应中的特性。
四、教具与学具准备教具:PPT、黑板、粉笔。
学具:笔记本、彩色笔、课本。
五、教学过程1. 实践情景引入:通过展示一些日常生活中常见的的手性分子,如氨基酸、糖类等,引发学生对手性分子的兴趣。
2. 手性碳原子的定义和判断方法:通过PPT讲解手性碳原子的定义和判断方法,让学生掌握手性碳原子的性质。
3. 手性分子的定义和分类:通过PPT讲解手性分子的定义和分类,让学生了解手性分子的性质。
4. 手性分子的光谱性质:通过PPT讲解手性分子在不同光谱范围内的表现形式,让学生认识手性分子的光谱性质。
5. 手性分子的化学反应:通过PPT讲解手性分子在化学反应中的特性,让学生理解手性分子的化学反应。
6. 手性分子的应用:通过PPT讲解手性分子在医药、农药、材料科学等领域的应用,让学生了解手性分子的实际应用价值。

有机化学基础知识分子的立体化学有机化学是研究含碳的化合物的分子结构、性质、合成、反应以及它们在生物体系中的作用的科学。
其中,分子的立体化学是有机化学中至关重要的一部分。
本文将介绍有机化学中分子的立体化学基础知识,包括手性,立体异构体及其命名以及手性分子的光学活性。
一、手性分子的手性是指其镜像不能重合的特性。
由于碳原子可以形成四个互不相同的键,大部分有机化合物都可以具有手性。
手性分子包括两种类型:手性中心和轴手性。
1. 手性中心手性中心是指分子中的一个碳原子,它与四个不同的基团连接。
手性中心的碳原子通常以S(拉丁语 sinister )和R(拉丁语 rectus)表示,分别代表左旋和右旋的空间构型。
2. 轴手性轴手性是指分子中存在一个对称轴,该对称轴可以将分子分为两个不可重合的镜像体。
轴手性是由于分子的非完全对称所导致的,在立体异构体中较为常见。
二、立体异构体及其命名立体异构体是指分子在空间排列上存在不同的构型,从而导致其化学性质和生物活性的差异。
立体异构体包括构象异构体和对映异构体。
1. 构象异构体构象异构体是指分子在空间上能够互相转换,但又不能通过化学反应相互转化的异构体。
最常见的构象异构体是旋转受限的双键环状化合物,如环烯烃和环烷烃。
2. 对映异构体对映异构体是指分子的镜像体,在化学和物理性质上没有差异,但与其他手性物质的相互作用不同。
对映异构体是由于分子的手性中心或轴手性所引起的。
对映异构体的命名通常使用R/S命名法或者D/L命名法,其中R/S命名法适用于手性中心,而D/L命名法适用于糖类和氨基酸等化合物。
这些方法可以准确地描述分子在空间中的立体排列。
三、手性分子的光学活性手性分子的光学活性是指它们对平面偏振光有选择性地旋转偏振面的性质。
手性分子旋光的方向可以是顺时针旋光(右旋)或逆时针旋光(左旋),分别用(+)和(-)表示。
对于含有手性中心的分子,不对称的环境可以导致光学活性。
手性分子的光学活性在药物、农药、香料等领域具有重要的应用价值。


化学手性有机化合物的合成和应用研究一、手性有机化合物的概念手性有机化合物是指分子中含有手性碳原子(即一个碳原子连接着四个不同的原子或原子团)的有机分子。
手性碳原子使得分子具有非对称的空间结构,因此手性有机化合物具有镜像异构体,称为手性异构体。
二、手性有机化合物的合成方法1.逆合成法:逆合成法是一种根据目标产物设计合成路径的方法。
首先确定目标产物的结构,然后逆向推导出合成该产物的步骤。
这种方法在有机合成中具有广泛的应用。
2.手性催化剂:手性催化剂是指在化学反应中能够诱导出手性选择性的催化剂。
利用手性催化剂可以实现对手性有机化合物的合成,从而获得特定的手性异构体。
3.手性助剂:手性助剂是指在化学反应中与反应物发生作用,从而影响反应选择性的化合物。
手性助剂可以提高手性有机化合物的合成效率和选择性。
4.立体选择性合成:立体选择性合成是指在化学反应中,通过控制反应条件,使反应物分子中的不同基团在空间上发生选择性反应,从而获得特定手性异构体的方法。
三、手性有机化合物的应用1.药物化学:手性有机化合物在药物化学领域具有重要意义。
许多药物分子具有手性异构体,这些异构体在药效、药代动力学和毒副作用方面可能存在显著差异。
因此,研究手性有机化合物的合成和应用,有助于开发新药和优化药物结构。
2.材料科学:手性有机化合物在材料科学领域也有广泛应用。
例如,手性有机分子可以用于制备手性光学材料、手性液晶和手性传感器等。
3.催化领域:手性有机化合物在催化领域具有重要作用。
手性催化剂和手性助剂可以提高化学反应的选择性,从而实现高效、绿色的化学合成。
4.分析化学:手性有机化合物在分析化学领域也有应用。
手性异构体之间的相互作用差异,可以用于检测和分析生物分子、环境污染物等。
综上所述,化学手性有机化合物的合成和应用研究是一个涉及有机合成、手性化学、药物化学、材料科学等多个领域的复杂课题。
通过对手性有机化合物的合成方法及其应用的研究,可以为我国化学工业、医药事业和材料科学的发展提供理论支持和实践指导。

有机化学基础知识点整理有机分子的手性中心和对映体生成的条件有机化学基础知识点整理:有机分子的手性中心和对映体生成的条件在有机化学中,手性中心和对映体是非常重要的概念。
手性中心指的是一个分子中的碳原子,它与四个不同基团连接,导致该碳原子存在两种互为镜像的立体异构体,即对映体。
本文将对有机分子的手性中心和对映体生成的条件进行整理。
手性中心的定义手性中心是指一个分子中的碳原子或其他有机官能团,其与不同基团或官能团的连接方式不相同,从而使得该碳原子或官能团存在两个非重叠的镜像异构体。
一般来说,一个分子中需要有手性中心才能形成对映体。
对映体的定义对映体是指具有相同分子式和结构式,但无法通过旋转重叠叠加的方式使其重合的两个异构体。
对映体具有相同的物理化学性质,如熔点、沸点等,但在光学活性和化学反应性上有明显的差异。
对映体生成的条件1. 手性中心的存在如前所述,对映体的生成需要分子中存在手性中心。
常见的手性中心是由四个不同基团连接的碳原子,简称R/S中心。
2. 空间异构对映体的生成要求分子在三维空间中存在非重叠的镜像异构体。
这要求分子的结构具有立体异构性,即存在非平面性或空间构型限制。
3. 不可旋转键对映体的生成还需要分子中存在不可旋转的化学键。
典型的不可旋转键是双键、环状结构和含有重原子的键(如C-Cl键)等。
4. 化学键的空间构型当分子中含有不可旋转键时,键的空间构型将决定对映体的生成。
常见的键空间构型包括顺式和反式构型、立体异构的卤代烷烃和手性环状化合物等。
应用和研究对映体广泛存在于生物大分子、药物和农药等有机化合物中。
由于对映体在光学活性、药理学和生物学方面的差异,对映体的鉴定和分离成为有机化学和药学领域的重要研究内容。
此外,对映体的制备也是有机合成中的一项重要任务。
常见的对映体合成方法包括手性拆分、手性诱导和手性催化等。
结论有机分子的手性中心和对映体生成的条件是有机化学中的基础知识点之一。
手性中心是导致分子存在对映体的原因,而对映体则在光学活性、药理学和生物学等方面具有重要的应用和研究价值。

有机化学基础教案:手性化合物手性化合物一、基本概念手性化合物,又称为光学异构体,是指一类分子具有非对称的空间结构的化合物,与它们的镜像图像称为对映异构体。
左右手是最为普遍的手性,所以分子的对映异构体也被称为左旋异构体和右旋异构体。
手性化合物在化学领域中占据着重要的地位,因为它们和它们的对映异构体在化学和生物学上表现出截然不同的性质。
一些手性分子被用于味道和气味,如L-和D-型氨基酸和L-和D-型半乳糖等,其对映异构体的话味道、气味也是有很大的差别的。
二、分子手性手性化学的重点在于分子的手性性质,这需要涉及到“不对称中心”的概念。
所谓不对称中心,是指分子中存在一个原子或原子团,它与其他原子或原子团不同,具有不对称性。
当原子或原子团的四个键上的原子或原子团不同时,则该不对称中心对应两个对映异构体。
手性分子相互作用具有非对称性,因此可以与环境中的手性分子有选择性的反应,因此具有广泛的应用。
如下图所示,对于一个分子来说,其手性一般是由其空间构型所决定的。
如上图所示的化合物,由于其中碳上结合有四种不同的基团,可以形成一个不对称中心,使得该分子存在两种对称性不同的构型。
这两种构型之间没有旋转、平移或翻转等操作可以相互转化,因此是两种独立的存在,分别称为对映异构体。
三、手性分子的制备手性分子的制备是化学工业中的重要难题之一。
目前,制备手性化合物的主要方法包括对称合成法、非对称合成法和拆分法三种。
对称合成法是通过利用对称性不同的化合物反应产生手性物质。
这种方法具有化学反应研究的重要价值,但现在不再是制备非常手性化合物的主要方法。
非对称合成法是通过将对映异构体的反应性差异进行利用,直接合成具有一定手性的化合物,从而逐步调节其手性化合物的方法。
这是制备手性化合物最为直接和有效的方法。
拆分法是指以具有不对称结果的手性物质为原料,从中分离出其对映异构体的方法。
该法要求手性物质必须是有光学活性的化合物,如在分子中有不对称碳原子、手性杂环、含手性杂原子等,否则就无法使用此法。
什么是手性分子英文名:chiral molecules我们知道,生命是由碳元素组成的,碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。
由于相连的原子或基团不同,它会形成两种分子结构。
这两种分子拥有完全一样的物理、化学性质。
比如它们的沸点一样,溶解度和光谱也一样。
但是从分子的组成形状来看,它们依然是两种分子。
这种情形像是镜子里和镜子外的物体那样,看上去互为对应。
由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左手和右手那样,所以又叫手性分子。
对于非碳原子手性中心的分子,只要没有对称面和对称中心即为手性分子。
手性分子的基本标志一个化合物的分子与其镜像不能互相叠合,则必然存在一个与镜像相应的化合物,这两个化合物之间的关系,相当于左手和右手的关系,即互相对映。
这种互相对应的两个化合物成为对映异构体(enantiomers)。
这类化合物分子成为手性分子(chiral molecule)。
不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,镜面不对称性是识别手性分子与非手性分子的基本标志。
生物分子手性原则是什么生物分子都有手性,即分子形式的右撇子和左撇子(或左旋、右旋)。
在法国生物学家巴斯德发现酒石酸晶体的镜像后就更激起了科学家的兴趣。
然而,手性分子是如何形成的却一直让人迷惑不解。
过去,生物化学领域趋向于认为,单一手性形式的分子合成通常从一开始就要利用手性本体,也就是说生物分子自身在催化着手性形式的形成。
而且在一些化学反应中手性产物的形成进一步扩大了。
2006年6月16日出版的英国《自然》刊发文章称,最近,美国研究人员发现,物质的固(体)-液(体)相平衡可能参与了生物分子手性的形成。
比如,氨基酸固(体)-液(体)相的平衡,可以由刚开始时的小小的不平衡导致严重偏向一种手性形式,即左旋或右旋。
而这种现象出现在水溶液中,因而也可以解释生命起源以前的左手性和右手性,即为何左右手性数量相当的分子为何会转变成生物分子偏爱一种手性。