分子立体构型讲解第一课时——价层互斥理论
- 格式:ppt
- 大小:3.49 MB
- 文档页数:92



选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。

分子的立体结构———价层电子对互斥理论本溪市一中李妍妍各位老师你们好!今天我要为大家说课的题目是:分子的立体结构———价层电子对互斥理论。
我的说课分为以下几个部分:1.教材分析2.学情分析3.教法分析4.学法分析5.教学过程6.教学反思首先,我对本节教材进行如下分析: 本节课是人教版高中化学选修三第二章第二节第一课时的内容,在学习了共价键的基础上,引导学生进一步认识分子的立体结构,并根据价层电子对互斥理论对分子结构的多样性和复杂性进行解释。
本节是第二章的关键,通过本节的学习,使学生能从结构决定性质的视角解释一些化学现象,预测物质的有关性质,逐步形成科学的价值观,为分子的性质学习奠定基础。
学情分析:知识基础:学生在必修2第一章中已经学过一些分子的简单性质,会用电子式、结构式表示分子的结构,在选修三前一节中学习了主要共价键——σ键和π键,这些都是学习本部分内容的知识基础。
能力基础: 已经具备了搜集资料,分析问题,自主探究的能力,同时具备了一定的空间想象力。
可能遇到障碍:学生的空间想象思维略弱,相关知识的准确度不够将会影响对本部分内容的学习。
根据上述教材分析,考虑到学生已有的认知结构、心理特征,制定如下教学目标:知识与技能:(1)认识共价分子结构的多样性和复杂性;(2)能够根据该理论判断简单分子或离子的结构。
过程与方法:培养分析、归纳能力和空间想象能力;采用比较、讨论的方法学习新知;学习科学探究的基本方法,提高科学探究能力。
情感态度与价值观:培养学生投身科学、追求真理的积极情感,以及勇于创新的科学态度,使学生充分体验科学探究的艰辛与愉悦。
本节课的教学重点是:1.分子的立体构型2. 价层电子对互斥理论难点:1.价层电子对数的计算;2.应用价层电子对互斥理论判断简单分子或离子的空间构型。
为了使学生能够更好的达到本节课设定的目标,突破重、难点,下面我再从教法和学法上谈谈:教法分析:1.首先利用多媒体展示形形色色的分子,激发学生的学习兴趣,对于学生难以理解的问题,可借助球棍模型,将抽象的理论模型化,化难为简,有效教学。



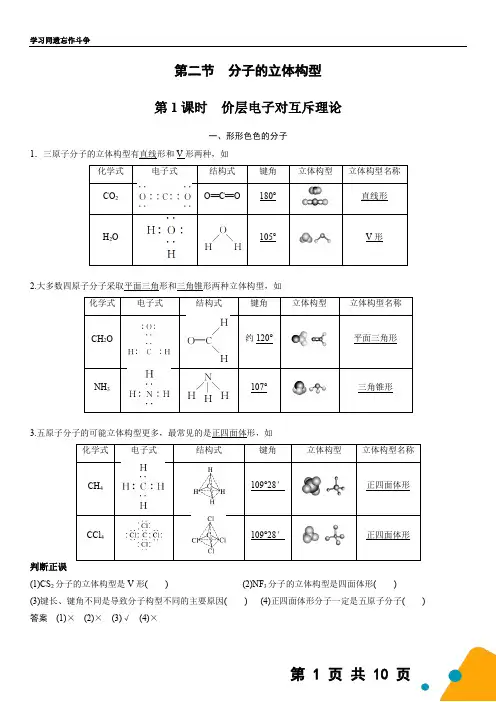
第二节 分子的立体构型 第1课时 价层电子对互斥理论一、形形色色的分子1.三原子分子的立体构型有直线形和V 形两种,如化学式 电子式结构式 键角 立体构型立体构型名称 CO 2O==C==O180°直线形H 2O105°V 形2.大多数四原子分子采取平面三角形和三角锥形两种立体构型,如化学式电子式结构式键角立体构型立体构型名称CH 2O约120°平面三角形NH 3107°三角锥形3.五原子分子的可能立体构型更多,最常见的是正四面体形,如化学式电子式结构式键角立体构型立体构型名称CH 4109°28′正四面体形CCl 4109°28′正四面体形判断正误(1)CS 2分子的立体构型是V 形( ) (2)NF 3分子的立体构型是四面体形( ) (3)键长、键角不同是导致分子构型不同的主要原因( ) (4)正四面体形分子一定是五原子分子( ) 答案 (1)× (2)× (3)√ (4)×应用体验1.下面四种说法①两个键之间的夹角为109°28′ ②C—H 键为极性共价键 ③4个C—H 键的键能、键长相同 ④碳原子的价电子都参与成键能说明CH 4分子中的五个原子不在同一平面而呈正四面体结构的是__①__(填序号)。
2.下列分子构型与分子中共价键键角对应一定正确的是( )A .直线形分子:180°B .平面正三角形:120°C .三角锥形:109°28′D .正四面体形:109°28′ 答案 B 解析 A 项,HCl 是直线形分子,因只有一个共价键,故不存在键角,A 项错误;氨分子呈三角锥形,键角为107°,C 项错误;甲烷与白磷分子均是正四面体形分子,但键角分别为109°28′、60°,D 项错误。
特别提醒(1)四原子分子不一定都是平面三角形或三角锥形。


第二节 分子的立体构型第1课时 形形色色的分子 价层电子对互斥理论▍课标要求▍1.认识共价分子结构的多样性和复杂性。
2.能根据价层电子对互斥理论判断简单分子或离子的构型。
要点一 形形色色的分子1.分子的立体构型:指由两个以上的原子构成的分子中的原子的问题。
2.常见的分子结构分子 类型 化学式 立体构型结构式 键角 比例模型球棍 模型三原子分子CO 2 (CS 2) _____ ________ 180°H 2O (H 2S) _____________105°四原子分子CH 2O _________NH 3 (PH 3)_____________107°五原子分子CH 4 (CCl 4)_________思考1:五原子分子都是正四面体结构吗?要点二 价层电子对互斥理论(VSEPR) 1.价层电子对互斥理论分子中的价层电子对(包括 和 )由于 作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
电子对之间的夹角越大,排斥力越小。
2.价层电子对的确定方法中心原子上的孤电子对数= 。
(1)a表示。
对于主族元素,a=;对于阳离子,a=价电子数离子电荷数;对于阴离子,a=价电子数离子电荷数。
(2)x表示。
(3)b表示与中心原子结合的原子最多能接受的电子数,氢为,其他原子为。
3.VSEPR模型和分子的立体构型(1)由价层电子对的相互排斥,得到含有孤电子对的VSEPR模型,然后略去VSEPR模型中的中心原子上的,便可得到分子的立体构型。
(2)H2O分子和NH3分子的分子构型分子H2O NH3价层电子对数σ键电子对数中心原子孤电子对数VSEPR模型分子立体构型立体构型名称43考点一常见分子的立体构型1.三原子分子的立体构型:直线形,如CO2、CS2等;V形,如H2O、SO2等。
2.四原子分子的立体构型:平面三角形,如甲醛分子等;三角锥形如氨气分子等。
四原子分子立体构型的多样性四原子分子不一定都是平面三角形或三角锥形。
高三化学一轮复习——分子的立体构型知识精讲知识梳理1.价层电子对互斥理论(1)理论要点①价层电子对在空间上彼此相距越远时,排斥力越小,体系的能量越低。
②孤对电子的排斥力较大,孤对电子越多,排斥力越强,键角越小。
(2)①价层电子对互斥理论与分子立体构型用价层电子对互斥理论推测分子的立体构型的关键是判断分子中的中心原子上的价层电子对数。
其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b 是与中心原子结合的原子最多能接受的电子数,x是与中心原子结合的原子数。
②示例分析电子对数σ键电子对数孤电子对数电子对立体构型分子立体构型实例220直线形直线形CO2330三角形平面三角形BF3 21V形SO2440四面体形正四面体形CH4 31三角锥形NH3 22V形H2O2.杂化轨道理论(1)当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。
杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道的三种类型与分子空间结构杂化类型杂化轨道数目杂化轨道空间构型实例间夹角sp2180°直线形BeCl2sp23120°平面三角形BF3sp34109.5°正四面体形CH43.配位键和配合物(1)配位键①孤电子对:分子或离子中没有与其他原子共用的电子对。
②配位键:由一个原子提供一对电子与另一个接受电子的原子形成的共价键。
③配位键的表示方法:如A→B:A表示提供孤对电子的原子,B表示接受孤对电子的原子。
(2)配位化合物①概念:由金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。
②组成③形成条件。
[考在课外]教材延伸判断正误(1)杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对。
(√)(2)分子中中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体结构(×)(3)NH3分子为三角锥形,N原子发生sp2杂化。