气体摩尔体积(三).
- 格式:ppt
- 大小:364.50 KB
- 文档页数:11

第2课时气体摩尔体积[引入]在化学反应中经常遇到气体物质,对于气体物质来说,测量体积往往比称量质量更方便。
那么气体体积与物质的物质的量以及物质的质量之间有什么关系呢?我们应如何建立气体体积与其物质的量的桥梁呢?而这个桥梁这就是我们这一节课所需要解决的问题——气体摩尔体积。
[思考]物质的体积与微观粒子间是否存在着一些关系呢?也就是说体积与物质的量之间能否通过一个物理量建立起某种关系呢?让我们带着这个问题,亲自动手寻找一下答案。
一、影响物质体积大小的因素o5[科学探究]1.为什么1mol不同状态的物质体积不同;2.为什么1mol不同物质的气体体积近似相等,且比固、液物质体积大的多;3.影响物质体积的因素究竟是什么?1.影响物质体积大小的因素有三个:(1)物质所含微粒数多少;(2)微粒间的距离(固态、液态距离小,排列紧密;气态分子间排列疏松);(3)微粒本身的大小;[思考]影响固体或液体及气体体积的因素是什么?[板书]2.影响固体或液体的体积大小的主要因素:①粒子的数目②粒子的大3.影响气体体积大小的主要因素:①粒子的数目②粒子之间的距离[教师强调]1mol固体、液体的体积规律性不强。
无数实验事实证明,外界条件(温度、压强)相同时,物质的量相同的任何气体都含有相同的体积。
这给我们研究气体提供了很大的方便,为此,我们专门引出了气体摩尔体积的概念,这也是我们这节课所要学习的内容。
二、气体摩尔体积1、概念:一定温度、压强下,单位物质的量的气体所占有的体积叫作气体摩尔体积。
2、符号:Vm3、定义式:Vm=V(气体)/n(气体)4、单位:升/摩尔(L/mol或L·mol-1);米3/摩尔(m3/mol或m3·mol-1)。
5、在标准状况下(STP),对于任何气体,Vm约为22.4L/mol注:气体摩尔体积由温度、压强决定。
同温、同压下:任何气体的摩尔体积Vm 都相同,但不一定等于22.4 L·mol-1。
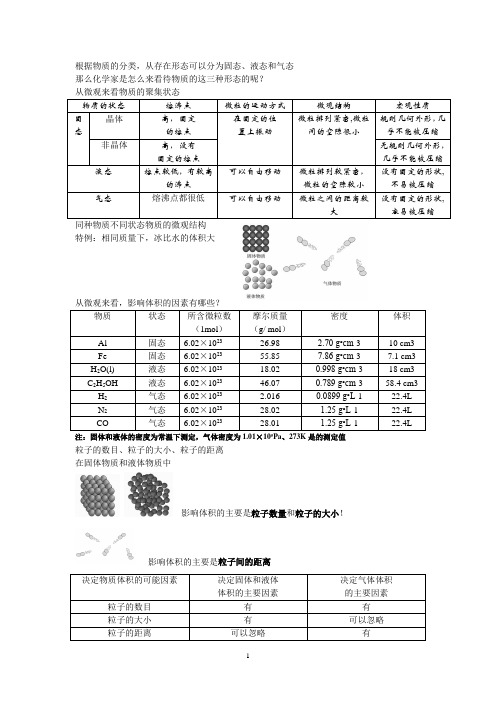
根据物质的分类,从存在形态可以分为固态、液态和气态那么化学家是怎么来看待物质的这三种形态的呢?同种物质不同状态物质的微观结构特例:相同质量下,冰比水的体积大注:固体和液体的密度为常温下测定,气体密度为1.01×10Pa、273K是的测定值粒子的数目、粒子的大小、粒子的距离在固体物质和液体物质中影响体积的主要是粒子数量和粒子的大小!影响体积的主要是粒子间的距离气体摩尔体积根据上表1mol H2、N2、CO的体积都是22.4L是否相同粒子数的气体具有的的体积都相同呢?粒子间的距离相等,体积相等!粒子间的距离受什么影响?温度!温度升高,液体汽化!压强,压强升高,气体液化!使温度、压强相同,任何具有相同微粒数的气体都具有大致相同的体积。
所以当温度,压强一定时,单位物质的量(1mol)的气体所占的体积都相等取T=273K、P=1.01×105 Pa时,1mol 任何气体的体积都大致等于22.4L(在常温常压下呢?) n mol 气体的体积=n×22.4 L根据前面所学,单位物质的量(1mol)物质所具有的的质量,叫做摩尔质量我们把在标准状况(T=273K、P=1.01×105 Pa)下,单位物质的量(1mol)的气体所占的的体积,叫做摩尔体积,用符号V m表示,V m = 22.4L/mol标准状况下:V = n ×V m计算:(1)标准状况下,0.5mol H2占有的体积约是L。
(2)标准状况下,2 mol O2占有的体积约是L。
(3)标准状况下,4.48L CO2的物质的量约是mol。
(4)标准状况下,33.6L H2的物质的量约是mol。
判断正误,并说明理由:1.71g Cl2的体积约是22.4L2.1mol气体的体积约为22.4L。
3.标准状况下,1molO2和N2混合气体的体积约为22.4L。
4.22.4L气体所含分子数一定大于11.2L气体所含的分子数5.标准状况下,气体的摩尔体积都是22.4L。

高一化学教学案(4)第一章第二节化学计量在实验中的应用(第2课时)编者:陈亚山审阅:史小元班级学号姓名【学习目标】1、了解气体摩尔体积的的概念,掌握有关气体摩尔体积的计算。
2、了解阿伏加德定律及应用【学习重点】1、气体摩尔体积的计算。
2、阿伏加德定律及应用【学习难点】阿伏加德定律及应用【教学过程】一、气体摩尔体积1、影响物质体积的因素从微观来看有:(1)(2)(3)2、1mol固体或液体的体积不同的原因:3、对于气体来说,气体粒子间距离很大,通常情况下,是气体粒子直径的倍左右。
因此气体体积取决于粒子间距离,气体粒子间平均距离与温度和压强有关。
当温度和压强一定时,不同气体粒子间的平均距离几乎是相等的。
所以1摩尔任何气体在相同条件下(同温同压)的体积相同,这个体积叫气体摩尔体积,即:单位物质的量的气体所占的体积叫做气体摩尔体积,符号Vm。
数学表达式:。
通常将0℃,1.01×105Pa时的状况称为标准状况。
在标准状况下任何气体的摩尔体积都约是22.4L/mol,这是在特定条件下的气体摩尔体积。
4、在应用气体摩尔体积22.4L/mol时应注意以下三个问题:(1)四要素:(2)“约”字的含义:一是数值不是精确的数值而是个约数;二是实际上气体分子的固有体积不能完全忽略,气体分子间的引力也不能完全不考虑。
所以1mol 不同气体的分子占有的体积是有差别的,不能绝对地说1mol任何气体的体积正好为22.4L。
(3)适用对象:(1)(2)二、阿伏加德罗定律由于在一定温度,一定压强下,气体分子间的平均距离相等,所以同温同压下,气体体积的大小只随分子数的多少而变化,相同体积的气体含有相同的分子数。
1.阿伏加德罗定律:(“四同”定律)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
可以理解为“三同定一同”,即:对任意两组气体,P、T、V、N(n)四个量中只要有三个量相同,则这两组气体的另一个量也相同。

气体的摩尔体积与摩尔质量气体是一种无固定形状和体积的物质,其分子之间存在大量的空隙。
在研究气体性质时,摩尔体积和摩尔质量是两个重要的概念。
摩尔体积是指气体中1摩尔(即约6.02 x 10^23个分子)所占据的体积,摩尔质量则是指1摩尔气体的质量。
本文将从这两个方面介绍气体的摩尔体积和摩尔质量的概念和计算方法。
一、摩尔体积的概念和计算方法摩尔体积是指气体中1摩尔所占据的体积,通常以单位体积中所含摩尔数来表示。
在标准温度和压力下,1摩尔任何气体的摩尔体积是相等的,约为22.4升。
这个数值被称为摩尔体积的标准值。
对于非标准温度和压力下的气体,我们可以利用理想气体状态方程来计算摩尔体积。
理想气体状态方程为P V = n R T,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
从该方程可以推导出摩尔体积的计算公式为V = V' / n,其中V'为气体的体积,n为气体的摩尔数。
举例来说,假设有一定质量的气体,其体积为V',摩尔质量为M。
我们可以通过如下的计算步骤来求得该气体的摩尔体积:1. 计算气体的摩尔数n。
根据摩尔质量M和气体的质量m之间的关系,可以得到n = m / M。
2. 根据理想气体状态方程,利用V = V' / n的公式计算摩尔体积。
通过上述计算,我们可以得到该气体的摩尔体积。
二、摩尔质量的概念和计算方法摩尔质量是指1摩尔气体的质量,单位为克/摩尔。
对于单质气体来说,摩尔质量可以直接由原子量得到。
例如,氧气(O2)的摩尔质量为32克/摩尔,氮气(N2)的摩尔质量为28克/摩尔。
对于化合物气体来说,摩尔质量则是由组成该化合物的各种元素的原子量之和得到。
例如,二氧化碳(CO2)的摩尔质量为44克/摩尔,由碳的原子量12克/摩尔和氧的原子量16克/摩尔之和得到。
在实际计算中,我们可以用化学式和元素原子量的相对数来计算摩尔质量。
通过将各个元素的原子量相加,乘以其在分子中的个数,再将这些结果相加,就可以得到化合物气体的摩尔质量。

第二节 化学计量在实验中的应用学习目标:1.掌握气体摩尔体积的概念。
2.有关气体摩尔体积的计算。
3.物质的量、气体摩尔体积、气体体积三者之间的关系。
学习过程二、气体摩尔体积1.物质体积的大小取决于构成这种物质的 、 和 这三个因素。
2.对于固态或液态物质来讲,粒子之间的距离是 的,这使得固态或液态的粒子本身的“直径”远远大于粒子之间的距离,所以决定固体或液体的体积大小的主要因素是(1) ;(2) 。
3.对于气体来讲,分子之间的距离很大,远远大于分子本身的“直径”。
所以决定气体体积大小的主要因素是(1) ;(2) 。
4.若气体分子数目相同,则气体体积的大小主要取决于 。
而气体分子间的距离的大小主要受 的影响。
当压强一定时,温度越高,气体分子间的距离越 ,则气体体积越 ;当温度一定时,压强越大,气体分子间的距离越 ,则气体体积越 。
科学实验表明:在 和 下,任何气体分子间的平均距离几乎都是 的。
所以在一定条件下气体的体积主要由 的多少决定。
因此在相同条件下 ,这就是阿伏加德罗定律。
5. 叫做气体摩尔体积;符号: 。
定义式: ;单位: 。
6.在标准状况下气体的摩尔体积是 。
7.阿伏加德罗定律 同温同压下体积相同的任何气体都含有相同的分子数即阿伏加德罗定律。
由此可见气体的体积比在同温同压下必等于分子数比。
由此可以导出同温同压下不同气体间的关系:(1)同温同压下,气体的体积比等于物质的量比。
B A B A n n V V //(2)同温同容下,气体的压强比等于物质的量比。
B A B A n n P P //=(3)同温同压下,气体的摩尔质量比等于密度比。
B A B A d d M M //=(4)同温同压下,同体积的气体质量比等于摩尔质量比。
B A B A M M m m //=(5)同温同压下,同质量气体的体积比等于摩尔质量的反比。
A B B A M M V V //= 此外还在运用时要结合物理中的同物质的量的气体在同温时,其体积与压强成反比;气体体积与热力学温度在同压条件下成正比。
