沉淀溶解平衡讲义
- 格式:doc
- 大小:149.50 KB
- 文档页数:4

《难溶电解质的沉淀溶解平衡》讲义一、难溶电解质的沉淀溶解平衡的概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,称为难溶电解质的沉淀溶解平衡。
例如,我们常见的 AgCl 固体在水中存在这样的平衡:AgCl(s) ⇌Ag+(aq) + Cl(aq) 。
此时,Ag+和 Cl不断结合生成 AgCl 沉淀,同时AgCl 也在不断溶解成 Ag+和 Cl,当这两个过程的速率相等时,就达到了沉淀溶解平衡。
需要注意的是,沉淀溶解平衡是一种动态平衡,溶解和沉淀仍在不断进行,只是速率相等。
二、影响沉淀溶解平衡的因素1、内因物质本身的性质是决定沉淀溶解平衡的重要因素。
不同的难溶电解质,它们在相同条件下的溶解度和溶解程度是不同的。
2、外因(1)温度一般来说,大多数难溶电解质的溶解过程是吸热的,升高温度,平衡向溶解方向移动,溶解度增大;反之,降低温度,平衡向沉淀方向移动,溶解度减小。
(2)浓度对于反应离子的浓度,通过加水稀释,平衡向溶解方向移动;若增大离子浓度,平衡向沉淀方向移动。
(3)同离子效应在难溶电解质的饱和溶液中,加入含有相同离子的强电解质,会使平衡向沉淀方向移动,溶解度减小。
例如,在 AgCl 的饱和溶液中加入 NaCl 固体,由于溶液中 Cl浓度增大,平衡向生成 AgCl 沉淀的方向移动。
(4)盐效应在难溶电解质的饱和溶液中,加入不含相同离子的强电解质,会使溶解度增大。
这是因为加入的强电解质增大了溶液中的离子强度,使得离子间的相互作用增强,从而促进了难溶电解质的溶解。
三、沉淀溶解平衡的应用1、沉淀的生成若要使溶液中的离子生成沉淀,可以通过调节溶液的 pH 值、加入沉淀剂等方法,使离子浓度的乘积大于溶度积(Ksp),从而产生沉淀。
例如,向含有 Cu2+的溶液中加入 Na2S 溶液,由于 CuS 的溶度积很小,当 Cu2+和 S2-的浓度乘积超过 CuS 的溶度积时,就会生成 CuS 沉淀。

沉淀溶解平衡一.固体物质的溶解度1.溶解度:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
符号:S,单位:g,公式:S=(m溶质/m溶剂)×100g2.不同物质在水中溶解度差别很大,从溶解度角度,可将物质进行如下分类:3.绝大多数固体物质的溶解度随温度的升高而增大,少数物质的溶解度随温度变化不明显,个别物质的溶解度随温度的升高而减小。
二?沉淀溶解平衡1.溶解平衡的建立讲固态物质溶于水中时,一方面,在水分子的作用下,分子或离子脱离固体表面进入水中,这一过程叫溶解过程;另一方面,溶液中的分子或离子又在未溶解的固体表面聚集成晶体,这一过程叫结晶过程。
当这两个相反过程速率相等时,物质的溶解达到最大限度,形成饱和溶液,达到溶解平衡状态。
2.沉淀溶解平衡绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。
以AgCl为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡:AgCl(s)沉淀 Ag(aq)+Cl(aq) +-3.溶解平衡的特征1)动:动态平衡2)等:溶解和沉淀速率相等3)定:达到平衡,溶液中离子浓度保持不变4)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
三.沉淀溶解平衡常数——溶度积1)定义:在一定温度下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫溶度积常数。
+- 2)表达式:以MmAn(s) mMn(aq)+nAm(aq)为例:mnKsp=[c(Mn+)]·[c(Am-)]3)意义:反应了物质在水中的溶解能力。
对于阴阳离子个数比相同的电解质,Ksp数值越大,电解质在水中的溶解能力越强。
4)影响因素:与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
四.影响沉淀溶解平衡的因素1)内因:难溶电解质本身的性质2)外因:①浓度:加水稀释,沉淀溶解平衡向溶解的方向移动②温度:多数难溶性电解质溶解于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动。

《难溶电解质的沉淀溶解平衡》讲义一、什么是难溶电解质的沉淀溶解平衡在我们的日常生活和化学实验中,经常会遇到各种各样的物质溶解在水中的现象。
有些物质能够很容易地溶解,形成均匀透明的溶液,比如食盐(氯化钠);而有些物质则很难溶解,我们称之为难溶电解质。
难溶电解质并非绝对不溶,只是其溶解的量非常少。
当难溶电解质溶解的速率和沉淀的速率相等时,就达到了一种动态平衡,这就是难溶电解质的沉淀溶解平衡。
比如说,在一定温度下,将一定量的氯化银固体放入水中,氯化银会开始溶解,同时溶解的银离子和氯离子又会结合形成氯化银沉淀。
随着时间的推移,溶解和沉淀的速率会逐渐相等,此时体系就处于沉淀溶解平衡状态。
二、沉淀溶解平衡的特征难溶电解质的沉淀溶解平衡具有以下几个特征:1、动态平衡沉淀溶解平衡是一种动态平衡,意味着溶解和沉淀这两个过程始终都在进行,只是速率相等,使得溶液中各离子的浓度保持不变。
2、等速进行溶解的速率和沉淀的速率相等,这是平衡状态的关键标志。
3、离子浓度不变在平衡状态下,溶液中各种离子的浓度不再发生变化,但这并不意味着离子之间不再发生交换,只是正逆反应的速率相等,使得离子浓度维持稳定。
4、条件改变平衡移动沉淀溶解平衡和其他化学平衡一样,当外界条件(如温度、浓度等)发生改变时,平衡会发生移动,以达到新的平衡状态。
三、沉淀溶解平衡的表达式对于难溶电解质A_{m}B_{n},其沉淀溶解平衡的表达式可以写为:A_{m}B_{n}(s) ⇌ mA^{n+}(aq) + nB^{m}(aq)K_{sp} = A^{n+}^{m}×B^{m}^{n}其中,K_{sp}称为溶度积常数,它反映了难溶电解质在溶液中的溶解能力。
K_{sp}的值越大,说明该难溶电解质在溶液中溶解的程度越大;反之,K_{sp}的值越小,溶解的程度越小。
四、影响沉淀溶解平衡的因素1、温度一般来说,大多数难溶电解质的溶解过程是吸热的,升高温度会使平衡向溶解的方向移动,增大溶解度;而对于少数溶解过程放热的难溶电解质,升高温度则会使平衡向沉淀的方向移动,降低溶解度。

第04讲沉淀溶解平衡目录01考情透视·目标导航..................................................................................................................02知识导图·思维引航..................................................................................................................03考点突破·考法探究...................................................................................................................考点一难溶电解质的溶解平衡..................................................................................................知识点1沉淀溶解平衡............................................................................................................知识点2沉淀溶解平衡的应用.................................................................................................考向1沉淀溶解平衡及影响因素..............................................................................................考向2沉淀溶解平衡的应用.....................................................................................................考点二溶度积常数......................................................................................................................知识点1溶度积和离子积........................................................................................................知识点2K sp 的意义和影响因素................................................................................................考向1溶度积常数及计算.........................................................................................................考向2沉淀溶解平衡图像.........................................................................................................考向3XXXX............................................................................................................................04真题练习·命题洞见...................................................................................................................考点一难溶电解质的溶解平衡知识点1沉淀溶解平衡1.概念在一定温度下,当沉淀溶解和生成的速率_______时,形成_______溶液,达到平衡状态,把这种平衡称为沉淀溶解平衡。


沉淀溶解平衡(讲义)一、知识点睛1.沉淀溶解平衡(1)定义在一定条件下,当难溶电解质溶于水形成饱和溶液时,沉淀_________和_________的速率相等,固体质量和离子浓度不再变化的状态。
(2)溶度积常数(简称溶度积)对于沉淀溶解平衡A m B n A n+(aq)+n B m-(aq),溶度积可表示为K sp=___________________。
如:PbI22+(aq)+2I-(aq),K sp(PbI2)= [Pb2+][ I-]2。
①K sp只与难溶电解质的性质和温度有关。
②K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的组成中阴、阳离子个数比相同时,K sp越大,溶解能力越强。
2.影响沉淀溶解平衡的外界因素(1)温度大多数难溶电解质的溶解是吸热的,升高温度,平衡向______的方向移动。
(2)浓度浓度越稀,溶解程度越大,加水稀释,平衡向______的方向移动。
(3)外加试剂①加入相同难溶电解质,平衡不移动。
②加入某种物质(其中含有难溶电解质的组成离子),平衡向______的方向移动。
③加入能与难溶电解质电离出的离子反应的物质,平衡向______的方向移动。
3.沉淀的溶解与生成(1)溶度积规则(浓度商Q与K sp的关系)Q___K sp溶液中的离子生成沉淀,直至平衡。
Q___K sp沉淀溶解与离子生成沉淀处于平衡状态。
Q___K sp若体系中有足量固体,则固体溶解,直至平衡。
(2)实例分析①做“钡餐”用BaSO4而不用BaCO3②误服可溶性钡盐可用5.0%的Na2SO4溶液洗胃③石笋、钟乳石和石柱的形成④珊瑚的形成4.沉淀的转化(1)实质加入某种能使难溶电解质转化为更难溶电解质的物质,利用沉淀溶解平衡的移动,实现沉淀的转化。
注:两种难溶物的溶解能力差别越大,越容易转化。
(2)实例分析①工业废水中重金属离子的去除用FeS、MnS等难溶物作沉淀剂除去工业废水中的Cu2+、Hg2+、Pb2+等重金属离子。

第58讲 沉淀溶解平衡图像的分析[复习目标] 1.熟知常考沉淀溶解平衡图像的类型,能用沉淀溶解平衡原理解释曲线变化的原因。
2.会选取特殊点利用数据进行有关K sp 的计算。
分析沉淀溶解平衡曲线图像的一般思路 1.明确图像中横、纵坐标的含义。
2.分析曲线上或曲线外的点对应的溶液是否为饱和溶液时,要明确点所对应的溶液中,若Q >K sp ,能形成沉淀,则该点所对应的溶液为过饱和溶液;若Q <K sp ,不能形成沉淀,则该点所对应的溶液为不饱和溶液。
3.分析曲线上指定点的离子浓度时,需根据K sp 计算或抓住K sp 的特点,结合选项分析判断。
溶液在蒸发时,离子浓度的变化分两种情况:原溶液不饱和时,离子浓度都增大;原溶液饱和时,离子浓度都不变。
溶度积常数只是温度的函数,与溶液中的离子浓度无关,在同一曲线上的点,溶度积常数都相同。
类型一 溶解度曲线 1.图像举例如图为A 、B 、C 三种物质的溶解度随温度变化曲线。
2.信息解读(1)曲线上各点的意义:曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
(2)曲线的变化趋势:A 曲线表示溶解度随温度升高而增大;B 曲线表示溶解度随温度升高而减小;C 曲线表示溶解度随温度升高变化不大。
(3)分离提纯:A(C):蒸发浓缩、冷却结晶、过滤、洗涤、干燥;C(A):蒸发结晶、趁热过滤。
(4)计算K sp :对于难溶电解质来说,若知道溶解度的值S g ,可求出难溶电解质饱和溶液时的浓度c =10S Mmol·L -1,进而求出K sp 。
1.(2014·全国卷 Ⅰ,11)溴酸银(AgBrO 3)溶解度随温度变化曲线如图所示,下列说法错误的是( )A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60 ℃时溴酸银的K sp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯2.已知4种盐的溶解度曲线如图所示,下列说法不正确的是()A.将NaCl溶液蒸干可得NaCl固体B.将MgCl2溶液蒸干可得MgCl2固体C.可用MgCl2和NaClO3制备Mg(ClO3)2D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯类型二离子积曲线1.图像举例BaSO4在不同条件下沉淀溶解平衡:2.信息解读a→c 曲线上变化,增大c(SO2-4)b→c 加入1×10-5 mol·L-1 Na2SO4溶液(加水不行)d→c 加入BaCl2固体(忽略溶液的体积变化)c→a 曲线上变化,增大c(Ba2+)曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液1.在T℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
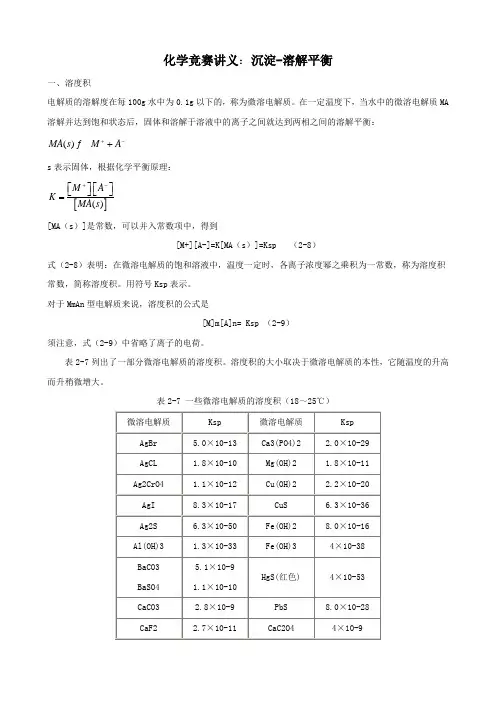
化学竞赛讲义:沉淀-溶解平衡一、溶度积电解质的溶解度在每100g 水中为0.1g 以下的,称为微溶电解质。
在一定温度下,当水中的微溶电解质MA 溶解并达到饱和状态后,固体和溶解于溶液中的离子之间就达到两相之间的溶解平衡:()MA s M A +-+s 表示固体,根据化学平衡原理:[]()M A K MA s +-⎡⎤⎡⎤⎣⎦⎣⎦=[MA (s )]是常数,可以并入常数项中,得到[M+][A-]=K[MA (s )]=Ksp (2-8)式(2-8)表明:在微溶电解质的饱和溶液中,温度一定时,各离子浓度幂之乘积为一常数,称为溶度积常数,简称溶度积。
用符号Ksp 表示。
对于MmAn 型电解质来说,溶度积的公式是[M]m[A]n= Ksp (2-9)须注意,式(2-9)中省略了离子的电荷。
表2-7列出了一部分微溶电解质的溶度积。
溶度积的大小取决于微溶电解质的本性,它随温度的升高而升稍微增大。
表2-7 一些微溶电解质的溶度积(18~25℃)溶度积和溶解度都可以表示物质的溶解能力,所以它们之间可以互相换算。
知道溶解度可以求出溶度积,也可以由溶度积求溶解度。
不过由于影响微溶电解质溶解度的因素很多,如同离子效应、盐效应等,所以换算往往是比较复杂的。
我们只介绍不考虑这些因素时的简单换算方法。
但是要注意不能把它推广应用到任意微溶电解质。
应该指出:溶度积的大小与溶解度有关,它反映了物质的溶解能力。
对同类型的微溶电解质,如AgCL,AgBr,AgI,BaSO4,PbSO4,CaCO3,CaC2O4等,在相同温度下, Ksp 越大,溶解度就越大;Ksp 越小,溶解度就越小。
对于不同类型的微溶电解质,不能认为溶度积小的,溶解度都一定小。
如Ag2CrO4的溶度积(Ksp=1.1×10-12)比CaCO3 的溶度积(Ksp=2.8×10-9)小,但Ag2CrO4的溶解度(6.5×10-5mol .L-1)却比CaCO3的溶解度(5.29×10-5 mol .L-1)大.因此,从Ksp 大小比较溶解度大小时,只有在同类型的电解质之间才能直接比较,否则要通过计算,下面举例说明溶解度和溶度积之间的换算。

——探究氢氧化镁处理工业废水的原理高中化学讲义鲁科版高二化学·选择性必修一学习目标通过实验探究,能正确分析难溶电解质在水中存在沉淀溶解平衡,能描述沉淀溶解平衡的建立过程及特征。
01根据化学平衡常数K写出沉淀溶解平衡常数表达式,能说出Ksp 的意义;学会利用Ksp判断难溶电解质在水中的溶解能力。
02运用已知平衡移动原理类推影响沉淀溶解平衡的因素及如何影响,能解释自然界及生活中的化学问题。
03氢氧化镁为什么可以用于处理废水呢?文献资料:常见的工业废水中含有Mn2+、Cu2+等无机重金属离子。
Mg(OH)2能使水呈弱碱性,并维持pH在9左右,这不仅符合我国污水综合排放标准GB8978—1996对排放污水pH的要求,且能降低Mn2+、Cu2+等离子在废水中的含量。
学习目标1:通过实验探究能够描述沉淀溶解平衡的概念【任务一】实验探究: Mg(OH)2是否溶于水?饱和氢氧化镁上清液2mL 0.2mol/L 氢氧化钠溶液实验现象:产生白色沉淀。
分析实验:基于微粒种类及其变化的角度思考,1.猜测白色沉淀的化学成分是什么?2.说明上清液中有什么离子?3.该离子的来源是什么?习惯上,将溶解度小于0.01克的电解质称为难溶电解质。
难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。
难溶 微溶 可溶 易溶0.01 1 10 (Sg/100g 水)难溶≠不溶总结:沉淀是难溶物,但不是绝对的不溶,只不过溶解度很小。
化学上通常认为残留在溶液中的离子浓度小于10-5mol·L -1即为沉淀完全。
学习目标1:通过实验探究能够描述沉淀溶解平衡的概念学习目标1:通过实验探究能够描述沉淀溶解平衡的概念【任务二】用学过的平衡理论完成下列问题:1.画出Mg(OH)2沉淀溶解平衡的v-t图像2.用化学用语描述Mg(OH)2的沉淀溶解平衡过程Mg(OH)2(s) Mg2+(aq ) + 2OH-(aq )或简写为Mg(OH)2(s) Mg2+ + 2OH-溶解速率沉淀速率时间速率沉淀溶解平衡沉淀溶解平衡的建立目标检测1B1、下列对沉淀溶解平衡的描述正确的是()A.反应开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率与溶解的速率相等C.沉淀溶解达到平衡时,溶液中离子的浓度相等且保持不变D.沉淀溶解达到平衡时,如果再加入该沉淀物,将促进溶解学习目标2:通过类比能说出K sp 的意义,学会利用K sp 判断难溶电解质在水中的溶解能力请填写下表,并依据化学平衡常数试写出沉淀溶解平衡的平衡常数 难溶电解质沉淀溶解平衡方程式平衡常数K AgClFe(OH)2 Fe(OH)3Ksp = [Fe2+][OH -]2K sp= [Ag +][Cl -] K sp = [Fe 3+][OH-]3 Fe(OH)2(s) Fe 2+ + 2OH - Fe(OH)3(s) Fe 3+ + 3OH - AgCl(s) Ag + + Cl -(1)表达式:A mB n (s) m A n +(aq)+n B m -(aq)K sp =[A n+]m .[B m-]n学习目标2:通过类比能说出Ksp 的意义,学会利用Ksp判断难溶电解质在水中的溶解能力【定量论证】若废水中的c(Mg2+)=0.056mol·L-1,计算并判断Mg(OH)2能否使水体pH保持9左右?已知25℃时Ksp[Mg(OH)2]=5.6×10-12(mol3·L-3)沉淀溶解平衡25℃,K sp 溶解度(g )1.8×10-10 mol 2·L -2 1.8×10-45.0×10-13 mol 2·L -28.4×10-68.3×10-17 mol 2·L -2 2.1×10-75.6×10-12 mol 3·L -36.5×10-32.2×10-20 mol 3·L -3 1.7×10-5AgCl(s) Ag + +Cl -AgBr(s) Ag + +Br -AgI(s) Ag + +I-Mg(OH)2(s) Mg 2++2OH - Cu(OH)2(s) Cu 2++2OH- 【证据推理】 利用数据分析能否用K sp 大小直接比较其溶解度的大小分析:1.比较AgCl 、AgBr 、AgI 在常温下的K sp 大小以及溶解度大小。

2025届高三化学一轮专题复习讲义(15)专题三 基本理论3-8 沉淀溶解平衡(1课时)【复习目标】1.认识难溶电解质的沉淀溶解平衡的概念、特征和影响因素。
2.理解难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
3.溶度积常数的概念、表达式及在计算中的应用。
【重点突破】难溶电解质的沉淀溶解平衡在沉淀的生成、溶解、转化中的应用。
【真题再现】 例1.(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM -pH关系图(pM= -lg[c (M)/ ( mol·L -1);c (M) ≤10-5 mol·L -1 可认为M 离子沉淀完全)。
下列叙述正确的是A .由a 点可求得K sp(Fe(OH)3)=10-8.5B .pH=4时Al(OH)3的溶解度为10-103mol·L -1C .浓度均为0.01mol·L -1的Al 3+和Fe 3+可通过分步沉淀进行分离D .Al 3+、Cu 2+混合溶液中c (Cu 2+)=0.2mol·L -1时二者不会同时沉淀解析:A 项,a 点pH=2、pM=2.5,则Ksp[Fe(OH)3]=c (Fe 3+)·c 3 (OH -)=10-2.5×(10-12)3=10-38.5, 错误;B 项,pH=4时Al 3+对应的pM=3,即c (Al 3+)=10-3mol·L -1,故Al(OH)3的溶解度为10-3mol·L -1,错误;C 项,由图可知,c (Fe 3+)=10-5mol·L -1时的pH 小于c (Al 3+)=0.01mol·L -1 时的pH ,则可通过调pH 分步沉淀浓度均为0.01mol·L -1的Al 3+和Fe 3+,正确;D 项,由题图可知,Al 3+沉淀完全时,c (Al 3+)≤10-5mol·L -1,pM≥5,此时pH ≈4.7,此时Cu 2+刚开始沉淀,浓度约为0.1mol·L -1,而题中c (Cu 2+)=0.2mol·L -1>0.1mol·L -1,则Al 3+、Cu 2+会同时沉淀,错误。
编制人:苗春玲刘长波王勇审核:王守营批准: 使用时间2007-12-06
高二化学预习学案编号:17
班级:姓名:
【课题】沉淀溶解平衡
【课标要求】能描述沉淀溶解平衡,知道沉淀转化的本质。
【学习目标】
1.认识什么是沉淀溶解平衡及沉淀溶解平衡是如何建立的,知道哪些外界条件会影响沉
淀溶解平衡。
2.认识溶度积的概念,初步学会利用溶度积计算溶液中各离子的浓度。
3.知道沉淀溶解平衡有哪些应用,会用沉淀溶解平衡原理解决有关化学问题(如沉淀转化、
沉淀生成等)。
【命题趋势】关于沉淀的溶解平衡的知识在今年广东试卷中已有考查,在以后的高考中这里仍将是重点考查的知识。
【使用说明】
1.应用课本中的观察思考,让学生自学得出沉淀溶解平衡的定义。
2.学生练习课本中几种常见难溶电解质的溶解平衡式如PbI2、AgCl 、M g(O H)2等。
3.练习PbI2、AgCl 、M g(O H)2等的K s p表达式。
4.通过思考与讨论中Ca(OH)2固体放入水中达到平衡的影响因素得出影响沉淀溶解平
衡的因素,沉淀的溶解与生成条件。
5.了解课本中的实例:钡餐透视、钟乳石的形成。
6.通过观察思考ZnS转化为CuS,得到沉淀转化在实际的生产生活中的应用。
【个人自学】
一、沉淀溶解平衡的建立和移动
1.以PbI2为例,当Pb2+和I- 的速率与PbI2固体的速率相等时,固体的量,得到溶液,这样就达到了一种平衡状态,称为沉淀溶解平衡,其平衡常数叫做,通常用表示。
2.Ksp只与有关,而与无关,溶液中离子浓度的变化只能,并不改变。
3.Ksp反映了,当
时,Ksp数值的难溶电解质,在水中的溶解能力越强。
[练习1] 根据溶度积判断,Mg(OH)2和Cu(OH)2溶解能力的大小为
[练习
2]
【小组讨论】
将Ca(OH)2固体放入水中,一段时间后达如下平衡:
Ca(OH)2(s)Ca2+(aq) +2OH-(aq),试分析下列变化对沉淀溶解平衡的影响,填表(填增大、减小、不变)
溶液的变化操作平衡移动
的方向
Ca(OH)2固
体的质量
溶液的PH Ca2+的浓度Ca(OH)2
的Ksp
加入少量的水
加热
加入少量的
Ca(OH)2
加入少量CaO
小结:
①升高温度,一般向移动(除外)Ksp大小与温度有关,与
浓度无关。
②加入少量水,沉淀溶解平衡向移动,溶液中离子浓度,固体的质量会。
③加入含有该固体电离出的离子,会使平衡向移动,固体的质量会。
.
④加入少量的该固体,平衡移动,离子浓度。
写出下列难溶电解质的溶解平衡方程式
PbI2: K s p=
AgCl: K s p=
AgBr: K s p=
Mg(OH)2: K s p=
Cu(OH)2: K s p=
BaSO4: K s p=
二、沉淀溶解平衡的应用和有关的计算
写出AmBn(s)的溶解平衡方程式:;其Ksp 表示式为;其浓度商Q的表达式为。
若Q=Ksp,则;
若Q>Ksp,则;
若Q<Ksp,则。
1.生成沉淀的条件和沉淀完全的判断
[练习3]
[练习4]常温下:
[小结]使一种离子沉淀完全的方法是
[练习5]
[练习6]写出钟乳石形成过程所涉及的化学方程式,并从沉淀溶解平衡的角度进行解释
2.沉淀的转化和溶解度的计算
a.沉淀转化的实质是,通常一种沉淀可转化成的沉淀,两种难溶物的越大,这种转化的趋势就越大,处理含有Cu2+、Hg2+、Pb2+的废水,常用的沉淀剂有。
b.运用不同物质的Ksp,即可计算溶解度或某种离子的浓度,像ZnS与CuS的阴、阳离子个数比相同,可以直接用Ksp来比较它们的溶解能力。
[思考1]从沉淀溶解平衡的角度解释ZnS是怎样转化成CuS的?写出转化的反应原理
[思考2]水垢的主要成分是,请解释水垢是如何形成的?
除去水垢的方法是?
[练习7]
[练习8]。