沉淀溶解平衡原理
- 格式:ppt
- 大小:694.00 KB
- 文档页数:19

沉淀溶解平衡原理
1沉淀溶解平衡
沉淀溶解平衡原理是指,在一定的温度和pH环境下,溶质分为沉淀形态和溶质形态。
一般地,一种物质的沉淀率会随溶液的温度或pH 值,以及物质分子间相互作用或催化剂、补助试剂等辅助物质的存在而发生变化。
如同撒水石头一样,如果溶液中化学分子间的斥力弱于粘附力,溶质就有可能析出沉淀物。
2生成溶质沉淀物的条件
从沉淀溶解平衡的原理可以推断,如果满足一定条件,就会发生溶质沉淀物的产现。
这些条件包括:(1)沉淀物含有水溶性的盐类;(2)反应温度和pH值适宜,一般反应温度在室温左右;(3)物质分子间的相互作用或催化剂的存在,促使反应发生;(4)物质的分子量足够大,可以结晶沉淀物。
3萃取、沉淀及析出的关系
沉淀溶解平衡原理提到的溶质沉淀物,包括离子与离子、离子与分子、分子与分子三种类型。
在实际操作中,由于分子之间的性质,选择合适的介质就可以使其中一种物质从另一种物质中脱除,从而做出萃取、沉淀及析出作用,增强或相反降低物料的浓度,达到精炼或分离的目的。
4生物溶解平衡
在生物领域,沉淀溶解平衡也可以应用,例如用沉淀技术来检测耳鼻咽喉疾病的溶血病变细胞。
由于人体血液中多种蛋白质的存在,若反应环境或者溶解过程中到达了某一个极限条件,多种种蛋白质组成的复合物会有一定气泡形成,在这个环境中,溶质就有可能析出沉淀物,就可以做出诊断。
总的来说,沉淀溶解平衡原理是一个非常重要的化学和生物原理,可以有效地用来结合溶液中物质的分子属性,采用沉淀方式做出分离、萃取和溶质的析出等反应,达到我们分离或检测物质的目的。
沉淀溶解平衡在这方面可以说是不可或缺的。

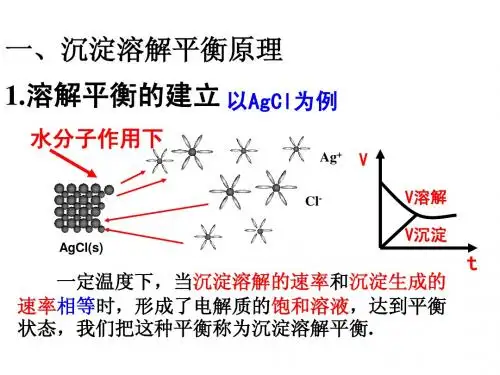
第3节沉淀溶解平衡知识点核心知识点及知识点解读一、沉淀溶解平衡和溶度积1、沉淀溶解平衡的建立:一定条件下,强电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。
2、沉淀溶解平衡常数--溶度积(1)定义:在一定条件下,难溶性物质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数或溶度积。
(2)表达式:以PbI2(s)溶解平衡为例:PbI2(s)Pb2+(aq)+2I-(aq)K sp=[Pb2+][I-]2=7.1×10-9mol3L-3(3)意义溶度积反映了物质在水中的溶解能力。
对于阴阳离子个数比相同的电解质,K sp的数值越大,电解质在水中的溶解能力越强。
(4)影响K sp的因素K sp与其他化学平衡常数一样,只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
3、沉淀溶解的特征:等、动、定、变。
等——v溶解 = v沉淀(结晶)动——动态平衡, v溶解 = v沉淀≠0定——达到平衡时,溶液中离子浓度不再改变。
变——当外界条件改变,溶解平衡将发生移动。
4、影响溶解平衡的因素(1)内因:电解质本身的性质①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
③易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
(2)外因:遵循平衡移动原理①浓度:加水,平衡向溶解方向移动。
②温度:升温,多数平衡向溶解方向移动。
③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动,但K sp 不变。
④其他:向沉淀溶解平衡体系中,加入可与体系中某些离子反应生成更难溶物质或气体的离子,使平衡向溶解的方向移动,K sp不变。
二、沉淀溶解平衡的应用1、溶度积规则通过比较溶度积与溶液中有关离子浓度幂的乘积--浓度商Q C的现对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:Q C>K sp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
沉淀溶解平衡及应用1.难溶、可溶、易溶界定:20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡 (1)溶解平衡的建立溶质溶解的过程是一个可逆过程:固体溶质溶解结晶溶液中的溶质⎩⎪⎨⎪⎧v 溶解>v 结晶 固体溶解v 溶解=v 结晶 溶解平衡v 溶解<v 结晶 析出晶体(2)特点(同其他化学平衡):逆、等、定、动、变(适用平衡移动原理) 3.影响沉淀溶解平衡的因素 (1)内因难溶电解质本身的性质,这是决定因素。
(2)外因①浓度:加水稀释,平衡向沉淀溶解的方向移动;②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动; ③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向生成沉淀的方向移动; ④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。
(3)以AgCl(s)Ag +(aq)+Cl -(aq) ΔH >0为例,填写外因对溶解平衡的影响4.沉淀溶解平衡的应用 (1)沉淀的生成①调节pH 法如:除去NH 4Cl 溶液中的FeCl 3杂质,可加入氨水调节pH 至7~8,离子方程式为 Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH +4。
②沉淀剂法如:用H 2S 沉淀Cu 2+,离子方程式为H 2S +Cu 2+===CuS ↓+2H +。
(2)沉淀的溶解 ①酸溶解法如:CaCO 3溶于盐酸,离子方程式为 CaCO 3+2H +===Ca 2++H 2O +CO 2↑。
②盐溶液溶解法如:Mg(OH)2溶于NH 4Cl 溶液,离子方程式为 Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
③氧化还原溶解法如:不溶于盐酸的硫化物Ag 2S 溶于稀HNO 3。
④配位溶解法如:AgCl 溶于氨水,离子方程式为AgCl +2NH 3·H 2O===[Ag(NH 3)2]++Cl -+2H 2O 。



未知驱动探索,专注成就专业
沉淀溶解平衡
沉淀溶解平衡是指在溶液中存在着溶解物质与沉淀物质之间的平衡。
当溶解物质和沉淀物质之间的反应达到动态平衡时,称为沉淀溶解平衡。
在沉淀溶解平衡中,溶解物质会溶解为离子,在溶液中以溶解度的形式存在。
而沉淀物质则会以固态的形式存在,在溶液中无法溶解。
溶解物质和沉淀物质之间的平衡是受溶液中各种离子浓度和溶液温度等因素的影响的。
当溶液中的离子浓度超过了溶解度时,溶解物质就会发生沉淀,反之,当溶液中的离子浓度低于溶解度时,沉淀物质就会溶解。
沉淀溶解平衡在实际应用中有广泛的应用。
例如,在水处理过程中,我们常常需要控制水中的溶解物质(如钙、镁等)和沉淀物质(如碳酸钙、硫酸钙等)之间的平衡,以防止沉淀物质堆积在管道和设备上,造成堵塞和损坏。
1。




沉淀溶解平衡知识点沉淀溶解平衡是化学平衡的一种,涉及到溶解度的概念和沉淀生成与转化等知识点。
下面将对沉淀溶解平衡知识点进行详细的介绍。
一、沉淀溶解平衡的定义沉淀溶解平衡是指在一定温度下,当溶液中的离子浓度达到平衡状态时,沉淀溶解反应停止,形成的固体和溶液中各离子的浓度保持不变的状态。
此时,溶液中的阴阳离子浓度满足溶度积常数,并且溶液中的沉淀和溶解反应速率相等。
二、沉淀溶解平衡的特点1、动态平衡:沉淀溶解平衡是一个动态平衡,即沉淀和溶解反应不断进行,但速率相等,因此溶液中的离子浓度保持不变。
2、溶解度与温度有关:物质的溶解度随温度变化而变化。
一般来说,温度越高,溶解度越大。
3、溶度积常数:在一定温度下,沉淀溶解平衡时,溶液中的阴阳离子浓度满足溶度积常数。
这个常数只与温度有关,与溶液的浓度无关。
4、沉淀的生成与转化:当溶液中某离子的浓度超过其溶度积常数时,会形成沉淀。
然而,形成的沉淀可以转化为更难溶的物质,或者转化为可溶性的化合物。
三、沉淀溶解平衡的应用1、判断沉淀的生成与转化:通过比较溶液中的离子浓度和溶度积常数,可以判断是否会形成沉淀以及沉淀的生成与转化。
2、计算溶解度:已知某物质的溶度积常数和溶液中的离子浓度,可以计算该物质的溶解度。
3、处理工业废水:在处理含有重金属离子的工业废水时,可以利用沉淀溶解平衡的原理,将重金属离子转化为难溶性的化合物,从而降低对环境的危害。
4、药物制备:在药物制备过程中,可以利用沉淀溶解平衡的原理,将药物中的有效成分转化为难溶性的化合物,以提高药物的疗效和稳定性。
总之,沉淀溶解平衡是化学平衡的一种重要类型,涉及到溶解度的概念和沉淀生成与转化等知识点。
理解并掌握沉淀溶解平衡的概念和特点对于解决相关问题具有重要意义。
“沉淀溶解平衡”的单元整体教学设计一、教学内容与目标本单元将带领学生探究沉淀溶解平衡的原理及其在日常生活中的应用。
通过实验和实践,学生将了解沉淀溶解平衡的基本概念,掌握沉淀溶解平衡的规律,了解影响沉淀溶解平衡的因素,并能够解释这些因素对沉淀溶解平衡的影响。
高考化学复习考点知识专题讲解专题二十七、沉淀溶解平衡考点知识沉淀溶解平衡就是难溶电解质的溶解平衡,其实质是指已经溶解的溶质与未溶解的溶质之间形成的沉淀于溶解的平衡状态。
同样遵循勒夏特列原理。
由于生产、生活、科研联系较为密切,在近几年高考中频繁出现,特别是广东卷、浙江卷、山东卷,考查的内容主要是沉淀的转化和溶度积的应用。
在高考中仪器了解难溶电解质的沉淀溶解平衡及沉淀转化的实质。
考试通常从图像题来考查溶解平衡原理、Ksp的简单计算、沉淀的生成、溶解和转化等,以生产、生活或产品的制备为背景解释某些现象。
重点、难点探源一.溶解平衡1、溶解平衡的建立⑴v溶解>v沉淀,固体溶解;⑵v溶解=v沉淀,溶解平衡;⑶v溶解<v沉淀,析出晶体。
2、电解质在水中的溶解度20℃,电解质在水中的溶解度与溶解性存在如下关系:一、溶度积常数及其应用1、表达式对于溶解平衡M m A n(s)mM m+(aq)+nA n+(aq),K sp=c m(M n+)•c n(A m-)。
K sp仅受温度的影响。
2、溶度积规则某难溶电解质的溶液中任一情况下有关离子浓度的乘积Q c(离子积)与K sp的关系。
二、沉淀溶解平衡的应用1、沉淀的生成⑴调节pH法如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+。
⑵加入沉淀剂法如用H2S沉淀Cu2+,离子方程式为:H2S+ Cu2+=CuS↓+2H+2、沉淀的溶解⑴酸溶解法如CaCO3溶于盐酸,离子方程式为:CaCO3+2H+=Ca2++CO2↑+ H2O。
⑵盐溶液溶解法如Mg(OH)2溶于NH4Cl溶液:Mg(OH)2+2 NH4+=Mg2++2 NH3•H2O。
3、沉淀的转化⑴实质:难溶电解质溶解平衡的移动。
(沉淀的溶解度差别越大,越容易转化) ⑵应用:锅炉除垢、矿物转化等。
三、四大平衡的比较平衡类型存在条件平衡常数平衡移动的判断表示形式影响因素化学平衡 一定条件下的可逆反应 K 温度 均符合平衡移动原理(勒夏特列原理),即:平衡始终是向减弱条件改变的方向移动电离平衡 一定条件下的弱电解质溶液 K a 或K b 温度 水解平衡含有弱酸根或弱碱阳离子的盐 K w温度沉淀溶解平衡一定条件下难溶或微溶盐的饱和溶液K sp温度追踪高考1.【2022新课标3卷】用0.100 mol·L -1 AgNO 3滴定50.0 mL 0.0500 mol·L -1 Cl -溶液的滴定曲线如图所示。
考点48 沉淀的溶解平衡及其应用一、沉淀溶解平衡及其影响因素1.沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀的速率相等的状态。
2.沉淀溶解平衡的建立3.沉淀溶解平衡的特征4.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质。
(2)外因①浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但K sp不变。
②温度:多数难溶电解质的溶解过程是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时K sp变大。
③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动,但K sp不变。
④其他:向沉淀溶解平衡体系中,加入可与体系中某些离子反应生成更难溶或气体的离子,使平衡向溶解的方向移动,K sp不变。
以AgCl(s)垐?噲?Ag+(aq)+Cl-(aq)ΔH>0为例:外界条件移动方向平衡后c(Ag+) 平衡后c(Cl-) K sp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl 逆向减小增大不变通入H2S 正向减小增大不变二、溶度积的相关计算及应用1.溶度积的相关计算(1)溶度积和离子积以A m B n(s)m A n+(aq)+n B m-(aq)为例:溶度积离子积概念沉淀溶解的平衡常数溶液中有关离子浓度幂的乘积符号K sp Q c表达式K sp(A m B n)=c m(A n+)·c n(B m-),式中的浓度都是平衡浓度Q c(A m B n)=c m(A n+)·c n(B m-),式中的浓度是任意浓度应用判断在一定条件下沉淀能否生成或溶解:①Q c>K sp:溶液过饱和,有沉淀析出;②Q c=K sp:溶液饱和,处于平衡状态;③Q c<K sp:溶液未饱和,无沉淀析出。
(2)已知溶度积求溶解度以AgCl(s)Ag+(aq)+Cl−(aq)为例,已知K sp,则饱和溶液中c(Ag+)=c(Cl−)=spK,结合溶液体积即可求出溶解的AgCl的质量,利用公式S100g=)((mm质)剂即可求出溶解度。
沉淀溶解平衡:1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:2、沉淀溶解平衡的特征:(1)逆:沉淀溶解平衡是可逆过程。
(2)等:(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素(1)内因:难溶电解质本身的性质。
(2)外因a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但不变。
b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时变大。
c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但不变。
d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,不变。
∙∙沉淀溶解平衡的应用:∙1.沉淀的生成(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH 至7~8,可使转变为沉淀而除去。
b.加沉淀剂法:如以等作沉淀剂,使某些金属离子如等生成极难溶的硫化物等沉淀,也是分离、除杂常用的方法。
说明:化学上通常认为残留在溶液中的离子浓度小于时即沉淀完全。
2.沉淀的溶解(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。
如向沉淀中加入溶液,结合生成使的溶解平衡向右移动。