沉淀溶解平衡
- 格式:doc
- 大小:93.00 KB
- 文档页数:6




沉淀溶解平衡:1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:2、沉淀溶解平衡的特征:(1)逆:沉淀溶解平衡是可逆过程。
(2)等:(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素(1)内因:难溶电解质本身的性质。
(2)外因a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但不变。
b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时变大。
c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但不变。
d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,不变。
沉淀溶解平衡的应用:1.沉淀的生成(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使转变为沉淀而除去。
b.加沉淀剂法:如以等作沉淀剂,使某些金属离子如等生成极难溶的硫化物等沉淀,也是分离、除杂常用的方法。
说明:化学上通常认为残留在溶液中的离子浓度小于时即沉淀完全。
2.沉淀的溶解(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。
如向沉淀中加入溶液,结合生成使的溶解平衡向右移动。

未知驱动探索,专注成就专业
沉淀溶解平衡
沉淀溶解平衡是指在溶液中存在着溶解物质与沉淀物质之间的平衡。
当溶解物质和沉淀物质之间的反应达到动态平衡时,称为沉淀溶解平衡。
在沉淀溶解平衡中,溶解物质会溶解为离子,在溶液中以溶解度的形式存在。
而沉淀物质则会以固态的形式存在,在溶液中无法溶解。
溶解物质和沉淀物质之间的平衡是受溶液中各种离子浓度和溶液温度等因素的影响的。
当溶液中的离子浓度超过了溶解度时,溶解物质就会发生沉淀,反之,当溶液中的离子浓度低于溶解度时,沉淀物质就会溶解。
沉淀溶解平衡在实际应用中有广泛的应用。
例如,在水处理过程中,我们常常需要控制水中的溶解物质(如钙、镁等)和沉淀物质(如碳酸钙、硫酸钙等)之间的平衡,以防止沉淀物质堆积在管道和设备上,造成堵塞和损坏。
1。
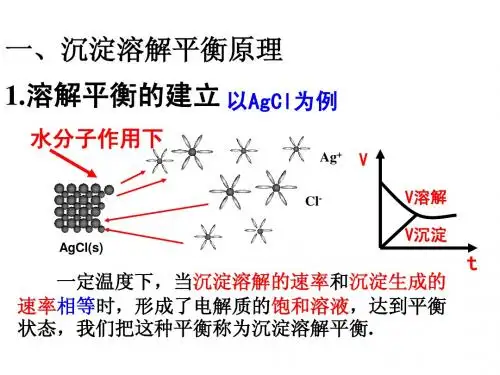



沉淀溶解平衡一.沉淀溶解平衡沉淀溶解过程—速率v1AgCl(s)Ag+(aq) + Cl—(aq)沉淀生成过程—速率v2v1 >v2——沉淀溶解——溶液不饱和v1 = v2——溶解的沉淀= 生成的沉淀——溶液饱和——处于平衡状态v1 ﹤v2 ——沉淀生成——溶液过饱和1.概念1)溶解度:在一定温度下,某物质在100g溶剂里达到饱和状态所溶解的克数,叫做这种物质在这种溶剂里的溶解度。
2)不饱和溶液:在一定温度下,溶液的浓度小于在该温度下的饱和溶液的浓度。
3)过饱和溶液:在一定温度和压强下,溶剂中所溶解的溶质超过最大量的溶液,叫做这种溶质的过饱和溶液。
有些物质的溶解度随温度的升高而增大。
在较高温度下配制成它的饱和溶液,并细心滤去过剩的未溶固体,然后使溶液慢慢降到室温,但尚未析出晶体,这时得到的溶液就是过饱和溶液。
硫酸钠、醋酸钠、硼砂、硫代硫酸钠、蔗糖等物质都容易形成过饱和溶液。
过饱和溶液存在的原因是,有些溶质在饱和溶液中不容易形成结晶中心(即晶核)。
每种晶体都有一定的排列顺序(即晶格),使原来无秩序运动的溶质质点按照这种晶体的晶格次序排列起来。
有些物质要经过相当长的时间才能自行产生结晶中心,因此这些物质的过饱和溶液还是比较稳定的。
从本质上看,过饱和溶液是处于不平衡状态或称介稳定状态。
在过饱和溶液中投入一小颗溶质的晶体(或投入晶形相同的其他物质),能使过量的溶质在短时间内结晶出来,得到饱和溶液。
用力振荡或充分搅动过饱和溶液,或者摩擦容器的器壁,也能使过量的溶质迅速结晶出来。
4)沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,人们将这种平衡称为沉淀溶解平衡。
2.特点:将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化逆:是一个可逆的过程等:v1 = v2动:v1 = v2≠0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。

沉淀溶解平衡知识点沉淀溶解平衡是化学平衡的一种,涉及到溶解度的概念和沉淀生成与转化等知识点。
下面将对沉淀溶解平衡知识点进行详细的介绍。
一、沉淀溶解平衡的定义沉淀溶解平衡是指在一定温度下,当溶液中的离子浓度达到平衡状态时,沉淀溶解反应停止,形成的固体和溶液中各离子的浓度保持不变的状态。
此时,溶液中的阴阳离子浓度满足溶度积常数,并且溶液中的沉淀和溶解反应速率相等。
二、沉淀溶解平衡的特点1、动态平衡:沉淀溶解平衡是一个动态平衡,即沉淀和溶解反应不断进行,但速率相等,因此溶液中的离子浓度保持不变。
2、溶解度与温度有关:物质的溶解度随温度变化而变化。
一般来说,温度越高,溶解度越大。
3、溶度积常数:在一定温度下,沉淀溶解平衡时,溶液中的阴阳离子浓度满足溶度积常数。
这个常数只与温度有关,与溶液的浓度无关。
4、沉淀的生成与转化:当溶液中某离子的浓度超过其溶度积常数时,会形成沉淀。
然而,形成的沉淀可以转化为更难溶的物质,或者转化为可溶性的化合物。
三、沉淀溶解平衡的应用1、判断沉淀的生成与转化:通过比较溶液中的离子浓度和溶度积常数,可以判断是否会形成沉淀以及沉淀的生成与转化。
2、计算溶解度:已知某物质的溶度积常数和溶液中的离子浓度,可以计算该物质的溶解度。
3、处理工业废水:在处理含有重金属离子的工业废水时,可以利用沉淀溶解平衡的原理,将重金属离子转化为难溶性的化合物,从而降低对环境的危害。
4、药物制备:在药物制备过程中,可以利用沉淀溶解平衡的原理,将药物中的有效成分转化为难溶性的化合物,以提高药物的疗效和稳定性。
总之,沉淀溶解平衡是化学平衡的一种重要类型,涉及到溶解度的概念和沉淀生成与转化等知识点。
理解并掌握沉淀溶解平衡的概念和特点对于解决相关问题具有重要意义。
“沉淀溶解平衡”的单元整体教学设计一、教学内容与目标本单元将带领学生探究沉淀溶解平衡的原理及其在日常生活中的应用。
通过实验和实践,学生将了解沉淀溶解平衡的基本概念,掌握沉淀溶解平衡的规律,了解影响沉淀溶解平衡的因素,并能够解释这些因素对沉淀溶解平衡的影响。
《沉淀溶解平衡》教学设计
扬州大学附属中学蒋艳旻
一、教材分析
案例章节
《普通高中标准实验教科书(苏教版)》选修《化学反应原理》专题3溶液中的离子反应第四单元沉淀溶解平衡。
内容分析
(1)沉淀溶解平衡内容既包括溶液中的离子反应——溶解过程和沉淀过程,又牵涉到平衡知识。
所以教材把这部分内容安排在化学平衡知识之后,溶液中的离子反应的最后一单元。
使得学生能够从强电解质在水溶液中完全溶解,离子生成沉淀,难溶强电解质溶解和生成沉淀速率相同而达到平衡状态三个层次上来学习研究这部分知识,即能用已学的离子反应和平衡的知识来帮助解决本节课中所遇到的化学问题。
(2)沉淀溶解平衡知识无论对于化学本身还是对化工生产及人们的生活实际都有重要的意义。
如何判断沉淀能否生成或是溶解;如何使沉淀的生成和溶解更加完全;如何创造条件,只使某一种或某几种离子从含多种离子的溶液中完全沉淀下来,而其余的离子却保留在溶液中,这些都是实际生产、生活和化学实验中经常遇到的问题。
(3)沉淀溶解平衡在新课程标准和新教材中的补充使得选修化学反应原理内容更加完整。
根据高中化学课程标准和教材内容,制订了教学目标:
教学目标分析
知识与技能:
1.认识沉淀溶解平衡的建立过程;
2.理解溶度积的概念,能用溶度积规则判断沉淀的产生、溶解;
3.知道沉淀溶解、生成和转化的本质;
4.了解沉淀溶解平衡在生产、生活中的应用。
过程与方法:分析比较归纳等思维能力的培养,通过实验培养观察能力。
情感态度与价值观:从实验现象分析得出宏观现象和微观本质的关系,领悟感性认识到理性认识的过程。
教学难点分析
1.沉淀溶解平衡的建立;
2.运用溶度积规则判断分析沉淀的溶解、生成和沉淀的转化;
3.沉淀溶解平衡在生产、生活中的应用。
教学重点分析
1.沉淀溶解平衡的建立过程;
2.知道沉淀溶解、生成和转化的本质。
二、学情分析
学生对于化学反应原理知识的学习从接触化学学习就开始了,特别是通过选修教材《化学反应原理》进行了系统的反应原理的学习,特别是学到整本书的最后一个专题的最后一个单元的内容后,学习能力较强的学生已经积累了一定学习方法,他们在学习沉淀溶解平衡知识块的时候,教师只要设计相应的问题情境,如生活和工业生产真实的情境和探究实验,进行适当的引导学生就能结合前面学习过的平衡的知识解决部分问题。
而对于学习能力较弱的学生,教师在他们学习的过程中应起主导作用,帮助他们设计该部分内容中必须要掌握的一些基本问题,指导他们解决问题方法,帮助、指导他们总结解决不同类型问题的方法,从而能从纯粹知识的学习上升到学习方法学习和提高化学问题解决能力上。
三、教法分析
情境法——用电脑展示图片真实的问题,通过真实的情景设计复习回顾已有知识,激发学生的学习兴趣去学习新的知识。
例如:设计“吃糖为何会出现龋齿?”问题。
实验探究法——设计学生探究实验,如“向MgCO3饱和溶液中滴加Na2CO3溶液”的实验,帮组学生理解难溶物在溶液中的沉淀溶解平衡过程。
类比法——引导学生学习溶度积Ksp时,启发学生联系已学的平衡知识和溶解度的概念,而不是单独来理解。
问题解决法——通过解决一系列生产和生活中的真实存在的化学问题,激发学生的学习兴趣,并有主动掌握知识的目的。
四、流程设计
1.真实情境问题设计
(1)吃糖为何会出现龋齿?
(2)你知道硬水(含Ca(HCO3)2、Mg(HCO3)2)加热后,得到的锅垢的成分是CaCO3、Mg(OH)2,醋酸为什么能将水垢去?
(3)工业生产原料NH4Cl中常含有FeCl3,如何将FeCl3除去?
(4)误食可溶性钡盐造成中毒,应用?来洗胃
(5) 工业上处理重晶石是制备含钡化合物的重要原料,但它不溶于酸,可以在溶液中加入过量的碳酸钠,难溶的BaSO4就可以转化为较易溶的BaCO3这一过程的原理是什么?
(6)溶洞的形成与碳酸钙的溶解平衡有关系。
你能解释吗?
(7) 由三聚氰胺引起的小儿肾结石,症状轻的时候可以通过多饮水排结石,你能解释其中的原因吗?
2.探究实验设计
(1) PbI2固体中加水后,再加入硝酸银溶液;
(2)向MgCO3饱和溶液中滴加Na2CO3溶液
(3)硝酸银溶液中依次加氯化钠溶液、碘化钾溶液、硫化钠溶液。
3.板书设计
沉淀溶解平衡
一、溶解—沉淀平衡
(1)AgCl(s)Ag++ Cl—
V溶>v沉沉淀溶解——溶液不饱和
v溶= v沉溶解的沉淀= 生成的沉淀平衡状态
v溶﹤v沉沉淀生成——溶液过饱和
(2)溶度积
K sp的大小反映了难溶物在水中的溶解能力。
K sp越大,其溶解能力越强。
Qc>K sp溶液过饱和,有沉淀析出
Qc=K sp溶液饱和,平衡
Qc﹤K sp溶液未饱和,无沉淀析出
二、沉淀溶解
三、沉淀生成
四、沉淀转化
5.具体过程
5.作业设计导学案(略)。