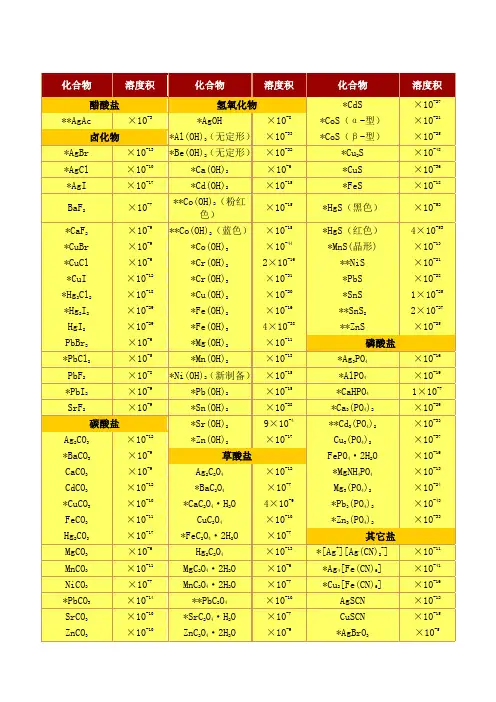
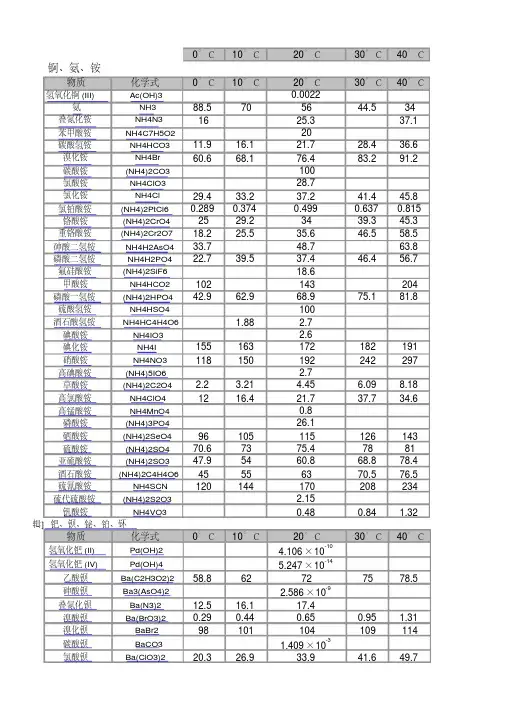
溶解度和溶度积表(全)
- 格式:xlsx
- 大小:129.02 KB
- 文档页数:32


溶度积和溶解度关系 -回复《溶度积和溶解度关系》溶度积和溶解度是研究溶液中物质溶解程度的重要概念。
溶解度可以理解为单位体积溶剂中能够溶解的溶质的最大量,通常用摩尔浓度表示。
而溶度积是指溶固与溶液中物质浓度之间的关系,通常用数学公式表示。
在化学领域,溶度积有着广泛的应用,对于研究溶液的饱和度、离子反应等具有重要意义。
溶度积可以用以下公式表示:AgCl(s) ⇌ Ag+(aq) + Cl-(aq)Ksp = [Ag+][Cl-]其中,AgCl表示溶解度相对较小的固体物质。
[Ag+]和[Cl-]分别表示溶解度相对较大的阳离子和阴离子的浓度,Ksp表示溶度积常数。
溶度积常数代表了固体在饱和条件下溶解生成离子的程度。
溶度积常数越大,表示溶质在溶液中溶解程度越大。
溶度积常数越小,表示溶质的溶解度越小。
溶度积和溶解度之间存在着密切的关系。
溶解度可以通过溶度积常数来计算,反之亦然。
实际上,溶度积常数是溶解度的量化指标。
当溶液中溶质浓度达到溶度积常数对应的浓度时,溶液被认为是饱和的。
如果溶液中溶质浓度小于溶度积常数对应的浓度,则溶液被认为是亚饱和的。
如果溶液中溶质浓度大于溶度积常数对应的浓度,则溶液被认为是过饱和的。
溶度积和溶解度之间的关系还可以通过溶解度曲线来描述。
溶解度曲线是指在一定温度下,溶液中溶质浓度(溶解度)与溶度积常数的变化关系图。
溶解度曲线的形状与溶液中物质的性质密切相关。
有些物质的溶解度曲线一直上升,即随溶液的浓度不断增加。
而有些物质的溶解度曲线在达到一定浓度后会开始下降。
这种差异主要取决于物质的晶体结构和离子间作用力。
总的来说,溶度积和溶解度是研究溶液中物质溶解程度的重要指标。
它们的关系告诉我们溶质在溶液中的溶解程度,从而对溶液的饱和度和离子反应进行定量分析。
因此,进一步研究溶度积和溶解度的关系对于深入理解溶液的物理化学性质具有重要意义。

溶度积和溶解度
溶度积和溶解度之间的转换关系可以用下式表示:
溶度积(m)=溶解度(S)×温度(T)
溶度积和溶解度是两个涉及溶解的概念。
溶度积是指溶解在固定体积中的最大质量,而溶解度是指在固定温度和压力条件下,1单位体积的溶解剂中可以溶解的最大质量。
如果想要转换溶度积和溶解度,需要使用质量守恒定律。
这个定律表明,在固定温度和压力下,溶解剂和溶解物的总质量是不变的。
所以,溶度积和溶解度之间的关系可以用下面的方程表示:
溶解度= 溶度积/ 体积
这个方程表明,溶解度是溶度积除以体积得到的。
例如,如果你知道某种物质的溶度积是100克,它在100毫升的体积中溶解,那么它的溶解度就是1克/毫升。
注意:溶解度是一个物质的溶解能力的度量,它是对一个物质的性质的描述。
而溶度积是一个物质的溶解性的度量,它是对一个溶解系统的性质的描述。

溶度积与溶解度的关系关键词:溶度积,溶解度难溶电解质的溶度积及溶解度的数值均可衡量物质的溶解能力。
因此,二者之间必然有着密切的联系,即在一定条件下,二者之间可以相互换算。
根据溶度积公式所表示的关系,假设难溶电解质为A m B n,在一定温度下其溶解度为S,根据沉淀-溶解平衡:B n(s)mA n+ + nB m−A[A n+]═ m S,[B m−]═ n S则K sp(A m B n)═ [A n+]m[B m−]n ═ (m S)m(n S)n ═ m m n n S m+n(8-2)溶解度习惯上常用100g溶剂中所能溶解溶质的质量[单位:g/(100g)]表示。
在利用上述公式进行计算时,需将溶解度的单位转化为物质的量浓度单位(即:mol/L)。
由于难溶电解质的溶解度很小,溶液很稀,可以认为饱和溶液的密度近似等于纯水的密度,由此可使计算简化。
【例题8-1】已知298K时,氯化银的溶度积为1.8×10−10,Ag2CrO4的溶度积为1.12×10−12,试通过计算比较两者溶解度的大小。
解(1)设氯化银的溶解度为S1根据沉淀-溶解平衡反应式:AgCl(s)Ag++Cl−平衡浓度(mol/L)S1S1K sp(AgCl)═ [Ag+][Cl−]═ S12S1 ═10⨯═ 1.34×10−5(mol/L)8.1-10(2)同理,设铬酸银的溶解度为S2AgCrO4(s)2Ag++ CrO42-平衡浓度(mol/L)2S2 S2K sp(Ag2CrO4)═[Ag+]2 [CrO42-]═(2S2)2S2═4S23S2 6.54×10−5(mol/L)>S1在上例中,铬酸银的溶度积比氯化银的小,但溶解度却比碳酸钙的大。
可见对于不同类型(例如氯化银为AB型,铬酸银为AB2型)的难溶电解质,溶度积小的,溶解度却不一定小。
因而不能由溶度积直接比较其溶解能力的大小,而必须计算出其溶解度才能够比较。

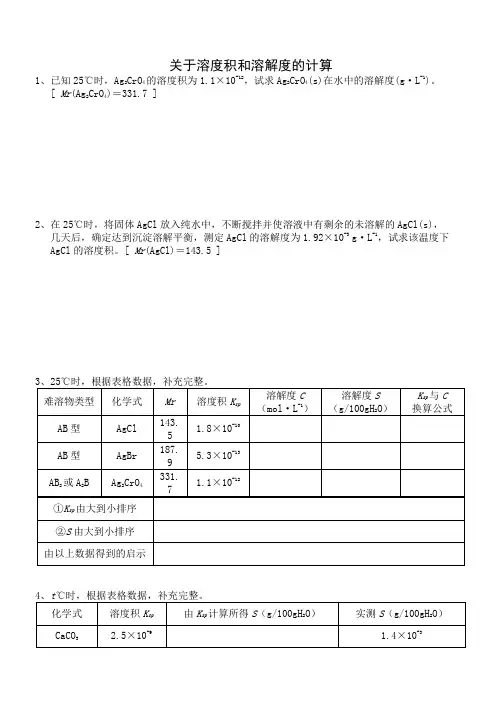
关于溶度积和溶解度的计算1、已知25℃时,Ag2CrO4的溶度积为1.1×10-12,试求Ag2CrO4(s)在水中的溶解度(g·L-1)。
[ Mr(Ag2CrO4)=331.7 ]2、在25℃时,将固体AgCl放入纯水中,不断搅拌并使溶液中有剩余的未溶解的AgCl(s),几天后,确定达到沉淀溶解平衡,测定AgCl的溶解度为1.92×10-3g·L-1,试求该温度下AgCl的溶度积。
[ Mr(AgCl)=143.5 ]34开始形成CaSO4沉淀?通过计算说明,当c(SO42-)为多少时,CaCO3可以完全转化为CaSO4沉淀?可能吗?(不考虑水解)[ K sp(CaCO3)=2.5×10-9,K sp(CaSO4)=9×10-6 ]6、已知t℃时,K sp (AgCl) =1.8×10-10,K sp (AgBr) =4.9×10-13。
在该温度下:(1)饱和AgBr溶液中,c(Br-)=。
向该饱和AgBr溶液中加入NaCl(s),当c(Cl-)达到多少时可以开始形成AgCl沉淀?。
(2)AgCl(s)若要在NaBr溶液中开始转化为AgBr沉淀,则c(Br-)不应低于。
(3)0.1 mol AgBr(s) 若要在1 L NaCl溶液中转化为AgCl(s),则c(Cl-)应大于;若要将此0.1 mol AgBr(s) 完全转化AgCl(s),则原NaCl溶液中c(Cl-)应大于,据此,你认为该0.1 mol AgBr(s) 能完全转化为AgCl(s) 吗?。
[饱和NaCl溶液中c(Cl-)约为5mol/L ](4)0.1 mol AgCl(s) 若要在1 L NaBr溶液中完全转化为AgBr(s),则原溶液中c(Br-)应大于。
7、25℃时,部分氢氧化物的溶度积如下表,按要求完成表格。
保留一位有效数字(pH数值到0.1)(请将计算过程写在对应空格内)参考答案:1、2.2×10-2g·L-12、1.80×10-103、4、5、c(SO42-)>0.14mol/L时开始形成沉淀;c(SO42-)>3600mol/L时转化完全,溶解度不可能达到。

溶度积与溶解度的相互换算
溶解度,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
物质的溶解度属于物理性质。
溶度积
物质AnBm(s)= n A(aq)+ mB(aq), 溶度积(Ksp)=C(A)^n×C(B)^m的应用十分广泛。
利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子做定性分析。
若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl浓度增大,C(Pb )C(Cl )大于氯化铅的溶度积,这时将有部分离子发生Pb+2Cl =PbCl2 的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度幂之积等于氯化铅的溶度积为止。
因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。
根据溶度积常数关系式,可以在难溶电解质的溶度积和溶解度之间做互相换算。
但在换算时,应注意浓度单位必须采用mol·L;另外,由于难溶电解质的溶解度很小,溶液浓度很小,难溶电解质饱和溶液的密度可近似认为等于水的密度。
溶度积常数
物质AnBm(s)= n A(aq)+ mB(aq), 溶度积(Ksp)=C(A)^n×C(B)^m的应用十分广泛。
根据溶度积常数关系式,可以在难溶电解质的溶度积和溶解度之间做互相换算。
但在换算时,应注意浓度单位必须采用mol·L;另外,由于难溶电解质的溶解度很小,溶液浓度很小,难溶电解质饱和溶液的密度可近似认为等于水的密度。

化学浓度溶解度详细解析一、溶度积、溶解度、浓度概念辨析及其关系一. 溶度积:【注】溶度积Ksp实际上就是沉淀的“解离常数”;溶度积Ksp与生成沉淀的常数K(生成沉淀)互为倒数。
二.溶解度的几种表示:1.固体溶解度:固体溶解度是指在一定的温度下,某固体物质在100克溶剂里(通常为水)达到饱和状态时所能溶解的质量(在一定温度下,100克溶剂里溶解某物质的最大量),用字母S表示,其单位是“G/100g 水(g)”。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
2.质量浓度:在无机及分析化学上,有时用沉淀的质量浓度(实际上是质量-体积浓度)来表示沉淀的溶解度。
其含义是:单位体积的沉淀的饱和溶液中所含溶质的质量。
【注】不要根据单位,将质量浓度与密度混为一谈。
3.物质的量浓度:化学定量分析常涉及溶液的配制和溶液浓度的计算,利用化学反应进行定量分析时,用物质的量浓度来表示溶液的组成更为方便。
溶质(用字母b表示)的物质的量浓度是指单位体积溶液中所含溶质b的物质的量,用符号Cb表示,常用单位为mol/L。
沉淀的“饱和溶液”的物质的量浓度,在无机及分析化学也可以表示沉淀的溶解度S。
二.沉淀的溶度积与沉淀的溶解度之间的换算:1.一定要将沉淀的溶解度S,换算为用“沉淀的饱和溶液的物质的量浓度”表示的形式。
2.写出沉淀-溶解平衡的可逆反应方程式。
3.根据沉淀完全解离的特点,用S表示出饱和溶液中沉淀解离出的阳离子和阴离子的浓度。
4.根据溶度积Ksp的定义式(实质是平衡常数原理),找到Ksp与S直接的关系式。
5.就可实现Ksp与S之间的相互转化。
二、溶解度知识详解1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
要点一、饱和溶液、不饱和溶液(高清课堂《溶解度》一)1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。

溶解度与溶度积的关系
溶解度是指单位溶剂中最多可溶解的溶质的物质的量。
溶度积是指在饱和溶液中,溶质与溶剂之间达到动态平衡时的浓度乘积。
溶解度与溶度积的关系如下:
1. 饱和溶液的溶度积等于溶质的溶解度的乘积。
即溶度积越大,溶质的溶解度越大。
2. 溶度积是描述溶质在溶液中的溶解程度的一个重要物理量。
溶度积越大,表示溶质在溶液中的溶解程度越高,溶解度越大。
3. 当溶质的溶解度超过溶度积时,溶液会发生过饱和现象,即有剩余的溶质无法在溶液中溶解,会形成沉淀。
4. 溶度积与溶质的溶解过程密切相关,溶度积越大,说明溶质的溶解过程越难,溶质与溶剂的吸附力越强。
总结起来,溶解度与溶度积有着紧密的关系,溶度积描述了溶质溶解的程度,溶度积越大,溶质的溶解度越大。
关于溶度积和溶解度的计算1、已知25C时,Ag2CrO4的溶度积为1.1 X10-12,试求Ag2CrO4(s)在水中的溶解度(g L-1)。
[Mr(Ag 2CrO4)= 331.7 ]2、在25C时,将固体 AgCl放入纯水中,不断搅拌并使溶液中有剩余的未溶解的AgCI(s),几天后,确定达到沉淀溶解平衡,测定AgCl的溶解度为1.92 X10-3g L-1,试求该温度下AgCl 的溶度积。
[Mr(AgCI) = 143.5 ]时,根据表格数据,补充完整。
3、254、t时,根据表格数据,补充完整。
5、t C时,将10 g CaCO 3投入100g水中,充分溶解,再加入硫酸钠固体,当c(SO 42-)为多少时,开始形成CaSO 4沉淀?通过计算说明,当c(SO 42-)为多少时,CaCO 3可以完全转化为 CaSO 4 沉淀?可能吗?(不考虑水解) [K sp(CaCO 3) = 2.5 X10-9 , K sp(CaSO 4)= 9 X10-6 ]6、已知t C 时,K sp (AgCI) = 1.8 X10-10, K sp (AgBr) = 4.9 X10-13。
在该温度下:(1) _________________________________________ 饱和AgBr溶液中,c(Br-)= 。
向该饱和 AgBr溶液中加入 NaCl(s),当c(CI-)达到多少时可以开始形成AgCI沉淀?____________________ 。
(2) _______________________________________________________________________________ AgCI(s)若要在NaBr溶液中开始转化为 AgBr沉淀,则c(Br-)不应低于______________________________ 。
(3) _______________________________________________________________________________ 0.1 mol AgBr(s) 若要在1 L NaCI溶液中转化为 AgCI(s),贝U c(CI-)应大于________________________若要将此0.1 moI AgBr(s) 完全转化 AgCI(s),则原NaCI溶液中c(CI-)应大于 _______________据此,你认为该 0.1 moI AgBr(s) 能完全转化为 AgCI(s)吗? _________________ 。
溶解度与溶度积的换算公式
溶解度与溶度积是指一种物质在给定的温度和压力条件下,可以在溶质和溶剂中有多少分子相互结合的新概念。
溶解度反映了溶质在特定温度和压力下溶解在给定溶剂中的能力,而溶度积代表了在特定温度和压力下,等物质的溶质和溶剂在混合物中相对的百分比。
通常情况下,溶解度的换算公式可以表示为:道林-托勒斯值(J/mol^K)=溶度积(g/L)*温度(K),其中,道林-托勒斯值也被称为溶解能或溶解剂热,一般符号用j (T)表示。
反过来,溶度积也可以用溶解度的换算公式来表示:溶度积(g/L)=道林-托勒斯值
(J/mol^K)/温度(K),以便计算溶质在特定温度和压力下的溶解能力以及混合物中等
物质的比例。
还可以使用一种简化的溶解度换算公式:溶度(g/L)=溶解度(g/L)/温度(K),其中,溶解度是在指定温度下溶质溶解在指定溶剂中所获得的溶解度。
总之,通过溶解度与溶度积换算公式可以计算出溶质在特定温度和压力下溶解能力以及混合物中相对容积的百分比。
同时,这一换算法则十分方便,使用者可以在一定的温度和压力条件下,简化计算溶度积的过程。
溶解度和溶度积
溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。
溶度积是一个标准平衡常数,只与温度有关。
而溶解度不仅与温度有关,还与系统的组成、pH值的改变及配合物的生成等因素有关。
溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。
溶度积是一个标准平衡常数,只与温度有关。
而溶解度不仅与温度有关,还与系统的组成、pH值的改变及配合物的生成等因素有关。
沉淀在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变(或一定),其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积。
在一定的的温度下,将难溶的强电解质放入水中,就会发生沉淀和溶解两个过程。
溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
物质的溶解度属于物理性质。
气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积溶剂里的体积数。
溶解度与溶度积的关系-资料类关键信息项1、溶解度的定义及相关概念溶解度的精确表述不同物质溶解度的表示方法影响溶解度的常见因素2、溶度积的定义及相关概念溶度积的数学表达式溶度积的物理意义溶度积常数的特点3、溶解度与溶度积的相互关系两者之间的数学推导特定条件下的转化公式实例分析说明关系4、应用场景及实际意义在化学分析中的应用对于工业生产的指导作用在环境保护中的重要性11 溶解度的定义及相关概念溶解度是指在一定温度下,某固态物质在 100g 溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
溶解度的表示方法有多种,常见的有以质量分数表示、以物质的量浓度表示等。
影响溶解度的因素包括温度、压力、溶剂的性质等。
温度的升高或降低可能导致物质溶解度的增大或减小;压力的变化对于气体在溶液中的溶解度影响较大;不同溶剂的极性、介电常数等性质也会显著影响溶质的溶解度。
111 不同物质溶解度的表示方法对于固体溶质,常用的表示方法是在一定温度下,每 100g 溶剂中所能溶解的溶质的最大质量(单位通常为 g)。
例如,在 20℃时,氯化钠在水中的溶解度约为 36g,表示在 20℃时,100g 水中最多能溶解36g 氯化钠达到饱和。
对于气体溶质,溶解度通常用在一定温度和压力下,单位体积溶剂中所能溶解气体的体积来表示。
112 影响溶解度的常见因素温度是影响溶解度最显著的因素之一。
大多数固体物质的溶解度随温度升高而增大,例如硝酸钾;但也有少数物质的溶解度随温度升高而减小,如氢氧化钙。
对于气体,温度升高时溶解度一般减小。
压力对气体溶解度的影响较大,压力增大,气体溶解度通常增大。
12 溶度积的定义及相关概念溶度积是指在一定温度下,难溶电解质的饱和溶液中,各离子浓度幂的乘积为一常数。
溶度积的数学表达式为:对于 AmBn 型的难溶电解质,其溶度积 Ksp = Am × Bn (A和 B分别表示离子 A 和 B 的浓度,m 和 n 为离子的化学计量数)。