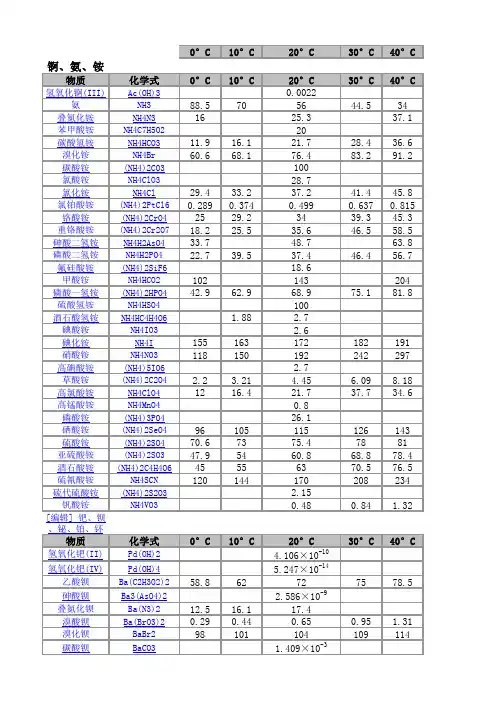
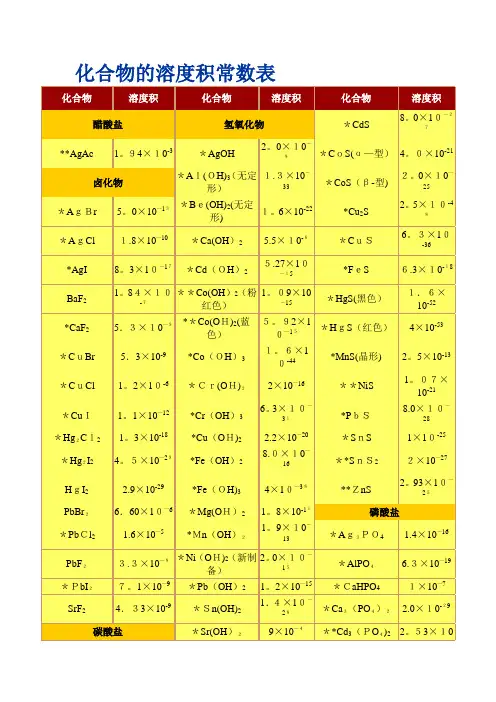
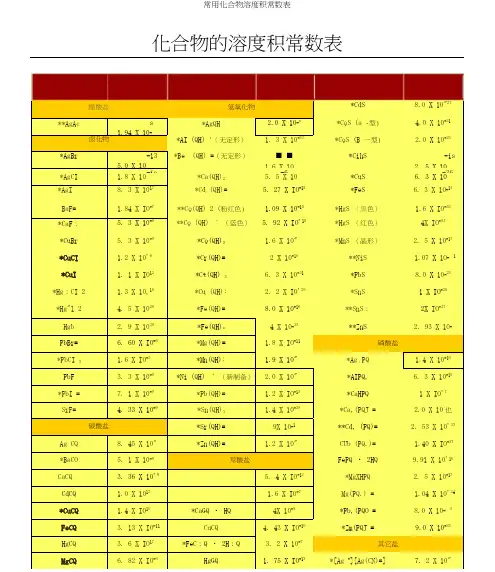
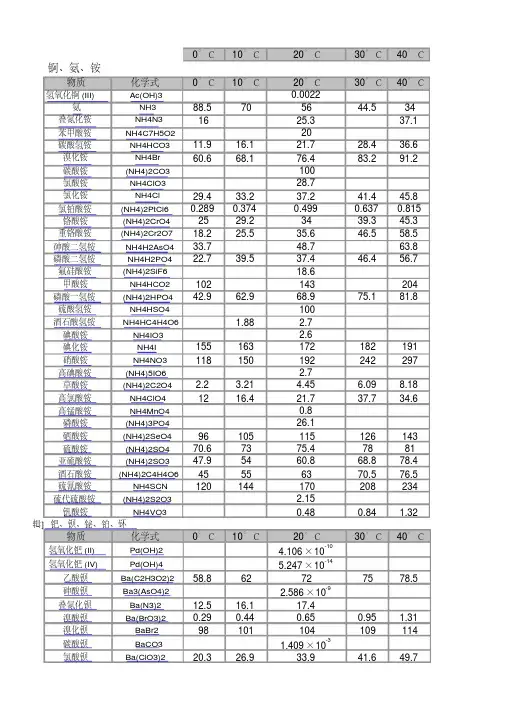
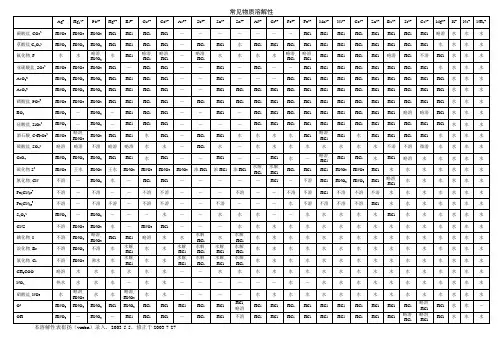
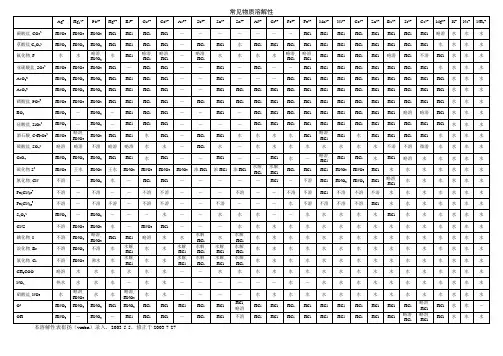
常见物质溶解性溶度积
- 格式:doc
- 大小:2.20 MB
- 文档页数:57


标准溶度积ksp的计算公式
标准溶度积ksp是一种计算溶解度的方法,它用来衡量一种物质在某种温度和压力下,在特定溶剂中可以溶解的最大量。
它的计算公式是Ksp = [A]^a[B]^b[C]^c...,其中A、B、C...是溶解在溶剂中的物质,a、b、c...是物质的溶解度系数。
使用标准溶度积ksp可以计算出溶解度,从而确定物质溶解的最大量。
比如,假设在某种温度和压力下,物质A、B、C的溶解度系数分别为2、3、4,那么溶解度ksp就可以通过Ksp = [A]^2[B]^3[C]^4来计算。
标准溶度积ksp计算出来的,可以用来判断溶解物在某种温度和压力下,是否容易溶解以及溶解的最大量。
它可以帮助我们了解溶解物的溶解性,从而提高溶解过程的效率,并有效控制溶解度。
此外,标准溶度积ksp还可以用来识别溶质之间的反应性,并根据反应性来调整溶解度。
例如,某种溶质在某种温度和压力下的溶解度系数可能会发生变化,如果使用标准溶度积ksp,就可以根据变化的溶解度系数来调整溶解度,从而提高溶解效率。
总之,标准溶度积ksp是一种有用的计算溶解度的工具,它可以帮助我们了解物质溶解的最大量,并根据反应性来调整溶解度,从而提高溶解效率。

溶解度积与溶解度的关系溶解度积是化学中一个重要的概念,它是指在一定温度下溶解度可测定的不易溶解物质在水溶液中浓度的乘积,通常用符号Ksp表示。
溶解度积的大小与溶解度直接相关,而溶解度则决定了溶液中物质的浓度。
本文将探讨溶解度积与溶解度的关系及其在化学反应和溶解度计算中的应用。
一、溶解度积的定义及计算公式溶解度积是指在一定温度下,一种物质在水中溶解时,形成的离子浓度的乘积。
对于一般的无机盐,它的溶解过程可以用一个一般的化学方程式表示:AaBb (s) → aA+ (aq) + bB- (aq)在这个化学方程式中,AaBb代表不溶解物质,aA+为不溶解物质的正离子,bB-为不溶解物质的负离子。
根据溶解度积的定义,它可表示为:Ksp = [A+]^a[B-]^b其中,[A+]表示正离子的浓度,[B-]表示负离子的浓度。
当溶解度积达到平衡时,离子的生成和析出速率相等,此时的溶解度积为平衡常数。
根据平衡常数的性质,我们可以预测溶液中溶质的溶解度。
二、溶解度积与溶解度之间存在着密切的关系。
溶解度指的是在一定温度和压力下,单位体积的溶液中能够溶解的溶质的量。
溶解度积大,说明溶解物质在水中溶解得越多,其饱和溶液的溶解度也相应增大;相反,溶解度积小,溶解物质在水中溶解得越少,其饱和溶液的溶解度也相应减小。
一般来说,溶解度积越大,溶解度越大,溶液中溶质的浓度越高。
这是因为高溶解度积意味着在溶质和溶剂之间形成的化学平衡偏向于产生更多离子。
例如,当溶解度积确定的不溶解物质溶解时,溶液中的离子浓度较高,溶质的溶解度也较高。
三、溶解度积与化学反应的应用溶解度积在化学反应中起到重要的作用。
通过溶解度积的计算和测定,我们可以判断一些物质之间是否发生反应,推测化学反应的方向,并计算出反应的平衡浓度。
例如,当给定两种盐溶液Ba(NO3)2和Na2SO4时,根据它们的溶解度积,我们可以判断出它们之间是否会发生双替代反应。
根据溶解度积计算和测定的结果,我们可以得出以下方程式:Ba(NO3)2 (aq) + Na2SO4 (aq) → BaSO4 (s) + 2NaNO3 (aq)利用溶解度积与溶解度之间的关系,我们可以推测出BaSO4盐的沉淀会形成,并判断反应方程式的方向。

溶度积的名词解释溶度积是化学中一个重要的概念,用来描述固体溶解于溶液中的程度。
在化学反应中,一般来说,溶解产物溶解度的大小会对反应平衡产生重要影响。
溶度积能够帮助我们理解溶解过程中物质的溶解特性,并在实际应用中提供参考。
溶度积的定义是指溶解度较小的物质在饱和溶液中所形成的离子浓度的乘积。
对于一个给定的物质,其溶度积可通过实验测定或计算推导得出。
一般情况下,溶度积被表示为一个化学反应的乘积形式。
考虑一个简单的例子,乙酸钙(CaCH3COO)在水中溶解时可以发生如下反应:CaCH3COO(s) ⇌ Ca2+(aq) + 2CH3COO-(aq)在饱和溶液中,化学反应向前和向后进行的速率相等,达到了动态平衡。
在此平衡条件下,乙酸钙的固体与水溶液中乙酸根离子(CH3COO-)和钙离子(Ca2+)的浓度都是稳定的。
我们可以用数学方式来表示溶度积。
根据上述反应式,我们可以得出溶度积的定义为:溶度积 = [Ca2+][CH3COO-]²其中[Ca2+]表示钙离子的浓度,[CH3COO-]表示乙酸根离子的浓度。
溶度积的值越大,表示物质在水中溶解的程度越大。
溶度积在化学实验和工业生产中有着广泛的应用。
首先,了解物质在溶液中的溶解程度可以帮助化学家确定化学反应的平衡产物和反应条件。
通过测定溶度积,我们可以了解到物质溶解的极限。
例如,在一些制药过程中,溶度积可以帮助研究人员确定药物的溶解性,进而指导合成过程的条件优化。
此外,溶度积还可以用来判断是否发生沉淀反应。
当两种溶液混合时,如果产生的离子浓度大于其溶度积的值,就会发生沉淀现象。
这对于一些实验室实践和环境监测中的离子分析非常重要。
此外,溶度积对于了解环境中某些重金属离子的毒性也非常有帮助。
一些金属离子的毒性和生物有效性与其溶度积有关。
了解并计算溶度积可以提供给环境科学家和生态学家在环境监测和生物监测中使用。
总之,溶度积是化学中一个重要的概念,用来描述溶液中固体物质所溶解的程度。

溶解度与溶度积的关系溶解度和溶度积的关系真的是个迷人的话题。
我们先聊聊溶解度。
溶解度就是物质在特定条件下能溶解的量。
这就像把糖放进水里,随着你不断搅拌,糖会逐渐消失,直到水再也装不下它。
这个过程特别有趣。
说到溶度积,简单来说,就是某些物质在饱和溶液中的浓度乘积。
比如,氯化钠的溶度积就跟它的钠离子和氯离子的浓度息息相关。
其实,溶度积是个好东西,它帮助我们预测在不同条件下,化学反应会如何进行。
现在,想象一下海洋。
它的咸味来自溶解在水中的盐。
这个现象不仅仅是自然的奇迹,还涉及到溶解度和溶度积的微妙平衡。
海水中的盐分变化,影响着生物的生存环境。
每当温度升高,溶解度增加,盐分也随之上升。
真是一个自然的循环。
再来谈谈温度对溶解度的影响。
很多物质在温度升高时,溶解度会增加,这就像热咖啡里糖更容易溶化一样。
但是,有些物质却正好相反,比如某些气体,温度越高,溶解度越低,像小气泡逃离饮料那样。
科学在这里玩起了捉迷藏。
除了温度,压力也是个重要角色。
对于气体来说,压力越大,溶解度越高。
想想你喝汽水的感觉,罐子打开的瞬间,气体一下子释放出来,这就是压力的魔力。
而且,这种现象在许多工业应用中都能看到,比如二氧化碳的注入与溶解。
聊到化学反应,溶解度和溶度积的关系就更显得重要。
比如说,某些盐在水中解离,产生离子。
若浓度过高,反应就会达到饱和状态。
此时,溶度积就决定了哪些离子能够继续溶解,哪些会沉淀下来。
这个过程就像一场优雅的舞蹈,每个参与者都有自己的角色。
在实际应用中,掌握溶解度和溶度积的关系可以帮助我们控制反应条件。
比如,制药行业里,药物的溶解性直接影响到它的效果。
好的药物需要在合适的条件下释放,才能发挥出最大的效能。
这就是科学的魅力,严谨又奇妙。
其实,溶解度和溶度积的关系并不是孤立的。
许多因素都在其中交织。
水的性质、离子的相互作用、甚至环境的变化都能影响到这个平衡。
科学家们通过不断的实验和观察,逐渐揭开了这些复杂关系的面纱。
溶解度和溶度积
溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。
溶度积是一个标准平衡常数,只与温度有关。
而溶解度不仅与温度有关,还与系统的组成、pH值的改变及配合物的生成等因素有关。
溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。
溶度积是一个标准平衡常数,只与温度有关。
而溶解度不仅与温度有关,还与系统的组成、pH值的改变及配合物的生成等因素有关。
沉淀在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变(或一定),其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积。
在一定的的温度下,将难溶的强电解质放入水中,就会发生沉淀和溶解两个过程。
溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
物质的溶解度属于物理性质。
气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积溶剂里的体积数。