第八章 可逆电池与不可逆电池
- 格式:ppt
- 大小:943.50 KB
- 文档页数:55

可逆电池必须具备的条件是:(1) 电池反应必须可逆(2) 可逆电池在放电或充电时,电池通过的电流必须为无限小可逆过程在热力学上本有严格的意义,即控制过程的各种因素均处在平衡态,正向的微小改变所产生的各种效应,在塑向改变时将全部消失,体系恢复原状。
有些电极反应能够满足这样的条件,如可逆氢电极、甘汞电极等。
这种可逆电极用于试验室测试,如电势滴定、参比电极和测定有机酸的电离常数、络合物的稳定常数等热力学数据,效果都很好。
但在电化学中,也常把电极反应由扩散过程主导的称作可逆电极和准可逆电极;在工业界则常把蓄电池的电极称为可逆的。
这些都是习惯用法,并非原来意义上的可逆。
可逆电极电势对解决许多电化学及热力学问题是十分有用的。
由前一章讨论可知,可逆电池的条件之一是外电路中没有电流通过。
但是,许多电化学过程并不是在电流为零的条件下完成的。
因此,在这种情况下,不论是原电池的放电还是电解池的充电,都是不可逆的过程。
因此,当有限电流通过电极而发生不可逆电极反应的电极过程与可逆电极过程有何区别?不可逆电极电势与可逆电极电势有何不同?这一类问题是电极过程的研究内容。
电化学反应的速率不仅与温度、活度和催化剂材料等因素有关,而且还与电极电位有关,因而电极极化作用构成了不可逆电极过程的动力学特征。
本章将从化学动力学的观点讨论电极反应的不可逆行为和规律。
准可逆电极指电荷迁越电极界面发生电子得失这一步骤较易进行的电极反应,即迁越步骤或称活化步骤【迁越系数或称传递系数。
反映电极电势对于电极反应的正、逆向反应速率(即电流)影响的一种参数。
与化学反应类似,电极反应的各个步骤的正、逆向过程都有势垒,即需要活化能。
但作为其核心步骤的电荷迁越相界过程(即活化步骤),其正、逆向过程的活化能将受电极电势的影响】速率与扩散步骤速率相差并不太大的情况,称准可逆电极反应。
准可逆,类似可逆之意。
电极反应为可逆的一类电极。
可逆有下述三方面的含义。
(1)热力学上,指电极界面通过正向微电流所产生的效应在逆向微.电流通过时能完全消除,电极各相达到平衡,故此种电极的电势又称平衡电势。


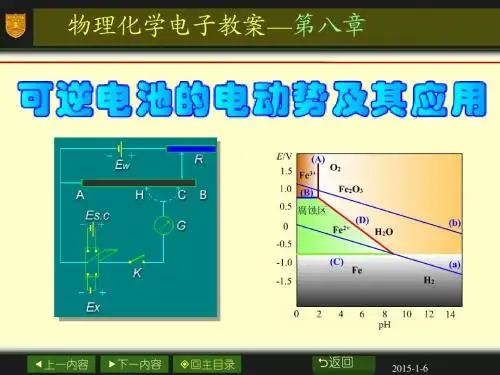


第八章可逆电池的电动势及其应用返回上一页1. 试将下述化学反应设计成电池:(1) AgCl(s)=Ag+(aAg+)+Cl-(aCl-)(2) AgCl(s)+I-(aI-)=AgI(s)+Cl-(aCl-)(3) H2(pH2)+HgO(s)=Hg(l)+H2O(l)(4) Fe2+(aFe2+)+Ag+(aAg+)=Fe3+(aFe3+)+Ag(s)(5) H2(pH2)+1/2 O2(pO2)=H2O(l)(6) Cl2(pCl2)+2I-(aI-)=I2(s)+2Cl-(aCl-)2. 298K时下述电池的E为1.228 VPt,H2()|H2SO4(0.01 mol/kg)|O2(),Pt已知H2O(l)的生成热为-286.1 kJ/mol.试求:(1) 该电池的温度系数.(2) 该电池在273 K时的电动势.该反应热在该温度区间内为常数.3. 电池Zn(s)|ZnCl2(0.05 mol/kg)|AgCl(s)+Ag(s) 的电动势E={1.015- 4.92×(T/K-298)}V.试计算在298 K当电池有2 mol 电子的电量输出时,电池反应的Δr G m, Δr H m, Δr S m和此过程的可逆热效应Q R.4. 一个可逆电动势为1.07 V的原电池,在恒温槽中恒温至293 K.当此电池短路时(即直接发生化学反应,不作电功),有1000 C的电量通过.假定电池中发生的反应与可逆放电时的反应相同,试求以此电池和恒温槽都看作体系时总的熵变化.如果要分别求算恒温槽和电池的熵变化,还需何种数据?5. 试为下述反应设计一电池Cd(s)+I2(s)=Cd2+(aCd2+=1.0)+2I-(aI-=1.0) 求电池在298K时的,反应的和平衡常数 .如将反应写成1/2 Cd(s)+1/2 I2(s)=1/2Cd2+(aCd2+=1)+I-(a I-=1) 再计算, 和,以此了解反应方程式的写法对这些数值的影响.6. 列式表示下列两组标准电极电势之间的关系.7. 试设计一个电池,使其中进行下述反应Fe2+(aFe2+)+ Ag+(aAg+) =Ag(s)+Fe3+(aFe3+)(1) 写出电池的表示式.(2) 计算上述电池反应在298K,反应进度ξ为1 mol 的平衡常数 .(3) 如将过量磨细的银粉加到浓度为0.05 mol/kg的Fe(NO3)3溶液中,求当反应达平衡后Ag+的浓度为多少?(设活度系数均等于1)8. 试设计合适的电池判断在298K时,将金属银插在碱溶液中,在通常的空气中银是否会被氧化?(空气中氧的分压为0.21×).如果在溶液中加入大量的CN-,情况又怎样? 已知[Ag(CN)2]- + e- ->Ag(s)+2CN- =-0.31V9. 在298K时,分别用金属Fe和Cd插入下述溶液中,组成电池,是判断何种金属首先被氧化?(1)溶液中含Fe2+和Cd2+离子的浓度都是0.1 mol/kg(2)溶液中含Fe2+为0.1 mol/kg,而Cd2+为0.0036 mol/kg.10. 在298K时,试从标准生成吉布斯自由能计算下述电池的电动势Ag(s)+AgCl(s)|NaCl(a=1)|Hg2Cl2(s)+Hg(l) 已知AgCl(s) 和Hg2Cl2(s)的标准生成吉布斯自由能分别为-109.57和-210.35 kJ/mol.11. 根据下列在298K和下的数据,计算HgO(s)在该温度时的离解压.(1) 下述电池的=0.9265 VPt,H2()|NaOH(a=1)|HgO(s)+Hg(l)(2) H2()+1/2O2()=H2O(l) =-285.85kJ*mol-1(3) 298K时下列物质的摩尔熵值化合物HgO(s) O2(g) H2O(l) Hg(l)H2(g)/J/(K·mol) 73.22 205.1 70.08 77.4 130.712. 298K时,10 mol/kg和6 mol/kg的HCl水溶液中HCl的分压为560和18.7Pa,试计算下述两电池的电动势的差值.(Pt)H2( )|HCl(10 mol/kg)|Cl2()(Pt)(Pt)H2()|HCl(6 mol/kg)|Cl2()(Pt)13. 在298K时,测得下述电池的E为0.695V,Zn(s)|Zn2+(aZn2+=0.01)|H+(aH+=0.02)|H2(pH2),Pt 通入H2(g)时,液面上总压为100.5 kPa,这时水的饱和蒸汽压为3.20kPa,并已知液接电势为-0.030V,求Zn电极的(Zn2+,Zn). 设氢气为理想气体.14. 已知298K时2H2O(g) = 2H2(g)+O2(g) 反应的平衡常数为9.7×,这时H2O的饱和蒸汽压为3200Pa,试求298K时下述电池的电动势E.Pt,H2()|H2SO4(0.01 mol/kg)|O2(),Pt(298K时的平衡常数是根据高温下的数据间接求出的.由于氧电极上的电极反应不易达到平衡,不能测出E的精确值,所以可通过上法来计算E值)15. 计算298K时下述电池的电动势E, Pb(s)+PbCl2(s)|HCl(0.1mol/kg)|H2(0.1×),Pt 已知(Pb2+,Pb)=-0.126V,298K时,PbCl2(s)在水中饱和溶液的浓度为0.039 mol/kg.设活度系数均等于1.16. 已知298K时下述电池的电动势E=0.372V, Cu(s)|Cu(Ac)2(0.1 mol/kg)|AgAc(s)+Ag(s) 温度升至308K时,E=0.374V,又知298K时, (Ag+,Ag)=0.799V, (Cu2+,Cu)=0.337V,(1) 写出电极反应和电池反应.(2) 298K时,当电池可逆地输出2 mol 电子的电量时,求电池反应的ΔrGm, ΔrHm和ΔrSm,设电动势E 随T的变化率有定值.(3) 求醋酸银AgAc(s)的溶度积Ksp.(设活度系均为1)17. 已知298K时浓度为7.0 mol/kg的HCl水溶液里,离子的平均活度系数γ±=4.66,该溶液上方HCl(g)的平衡分压为46.40Pa,电极Cl-(aCl-)|Cl2(pCl2),Pt的标准电极电势为1.3595V,求该温度下,下述反应的平衡常数 .2HCl(g,)= Cl2(g,)+H2(g,) 设气体为理想气体.18. 对下列电池Pt,H2(p1) |HCl(m)|H2(p2),Pt设氢气遵从的状态方程为p Vm =RT+a p,式中a=1.48×m3/mol,且与温度,压力无关.当氢气的压力p1=20×, p2= 时,(1) 写出电极反应和电池反应(2) 计算电池在293 K时的电动势(3) 当电池放电时是吸热还是放热?为什么?(4) 若a是温度的函数a=b-a/RT(a,b是常数),当电池输出2 mol电子的电量时,试列出下列函数的计算公式: Δr S m , Δr H m 和最大功W max.19. 一个原电池是由固态铝电极和固态的Al-Zn合金电极以及熔融的AlCl3-NaCl混合物作电解质形成,当铝在合金电极中的摩尔分数是0.38,电池电动势在653 K时为7.43 mV, 试计算Al(s)在Al-Zn(s)合金中的活度.20. 298K时测定下述电池的电动势玻璃电极| 缓冲溶液| 饱和甘汞电极当所用缓冲溶液的pH=4.00时,测得电池的电动势为0.1120 V.若换用另一缓冲溶液重测电动势,得E=0.3865 V.试求该缓冲溶液的pH值.当电池中换用pH=2.50的缓冲溶液时,则电池的E将为若干?。

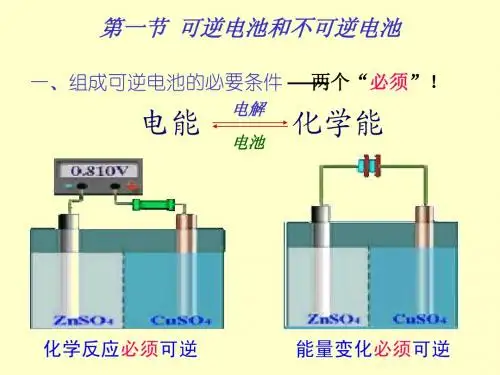
可逆电池的两个必要条件可逆电池是指具有可逆性能的电池,即在充放电过程中能够反复循环使用并保持稳定性能的电池。
然而,要实现可逆电池,有两个必要条件必须满足。
首先,电化学反应过程必须是可逆的。
电池内部的电化学反应会导致电荷在电极之间的转移,而这个过程应该能够在充放电过程中反向进行,以保持电池的可逆性。
具体来说,正极和负极的反应都必须是可逆的。
正极的反应通常是氧化反应,而负极的反应则是还原反应。
这些反应需要以一种平衡的方式发生,以确保在充放电过程中不会发生严重的极化现象。
其次,电池的电极反应与电解质之间的相互作用应该是可逆的。
电池中的电解质起着电荷传递的重要角色,它可通过导电的方式连接正负极并维持电荷平衡。
然而,电解质必须具有足够的可逆性以支持充放电过程。
具体来说,当电池处于充电状态时,电解质应当能够将正电荷与负电荷分离,使正负电荷能够流动;而在放电状态下,电解质应当能够重新结合正负电荷,以维持电荷平衡。
要实现可逆电池,我们需要采取一些措施。
首先,优化电极材料的选择和设计。
合适的电极材料能够提供更好的氧化和还原反应效果,从而确保电极反应的可逆性。
其次,我们需要选择合适的电解质。
一种好的电解质应该具有良好的导电性能,同时也应该能够与电极材料相互作用,促进电荷传递的可逆性。
可逆电池的研究对于推动电池技术的发展具有重要意义。
可逆电池不仅可以在能源存储领域应用广泛,还可以在可再生能源的利用以及电动汽车等领域发挥重要作用。
因此,探索满足可逆电池所需的条件,并加强相关研究对于实现可持续发展具有重要意义。
总而言之,要实现可逆电池,必须满足两个必要条件:电化学反应过程可逆以及电解质与电极反应之间的相互作用可逆。
通过优化电极材料的选择和设计,并选择合适的电解质,我们可以提高电池的可逆性能。
这将有助于推动电池技术的发展,促进清洁能源的利用,以及实现更可持续的能源未来。
可逆电池的三个条件
可逆电池是指在特定条件下,可以在正向和反向方向上进行电化学反应,从而实现电能的转化和储存。
要实现可逆电池,必须满足以下三个条件:
1. 反应物和产物的化学势相等
可逆电池中正反两个方向上的电化学反应都要达到平衡状态,即反应物和产物的化学势相等。
这意味着在正反两个方向上,化学反应都是完全可逆的。
只有当系统达到平衡状态时,才能保证电池在正反两个方向上都能够工作。
2. 无内阻
内阻是指电池内部存在的阻力。
如果存在内阻,则会导致能量损失和热量产生,并且会降低电池的效率。
因此,在可逆电池中,必须尽可能地减小内阻,以提高电池效率。
3. 无过渡态
过渡态是指在反应中出现的不稳定中间体或离子。
如果存在过渡态,
则会导致能量损失和热量产生,并且会降低电池效率。
因此,在可逆电池中,必须尽可能地避免过渡态的产生,以提高电池效率。
总之,可逆电池是一种高效的电化学能量转化和储存方式。
要实现可逆电池,必须满足反应物和产物的化学势相等、无内阻和无过渡态三个条件。
未来,随着科技的不断发展和创新,可逆电池将成为一种重要的能源储存方式,为人类创造更加美好的未来。
第八章 电化学 章末习题一、内容提要1. 电化学的基本概念原电池和电解池都是实现化学能和电能转化的电化学装置,都具备两个电极、电解质溶液和组成回路等必需设备。
(1)原电池:将化学能转变为电能的装置称为原电池。
(2)电解池:将电能转变为化学能的装置称为电解池。
(3)正极、负极,阴极、阳极电势高的极称为正极,电势低的极称为负极。
在电极界面上发生还原反应的极称为阴极,发生氧化反应的极称为阳极。
电解池中正极是阳极,负极是阴极;原电池中正极是阴极,负极是阳极。
(4)法拉第(Faraday )定律当电流通过电解质溶液时,在电极界面上发生化学反应的物质的量与通入的电量成正比,即Q zF ξ=。
(5)离子的电迁移率和迁移数离子在电场中迁移的速率正比于电场的电位梯度,其比例系数称为离子的电迁移率。
它相当于单位电场梯度时离子的迁移速率,单位是211m s V --。
溶液中电流的传导由正、负离子作定向迁移来完成。
离子B 迁移电流的分数就称为离子B 的迁移数。
迁移数是一个小于1的分数,溶液中所有离子迁移数的加和等于1。
迁移数可由实验测得。
2. 电导及其应用(1)电导、电导率、摩尔电导率(2)电导率、摩尔电导率与浓度的关系强电解质的电导率在一定浓度下随着浓度的增加而增加,在浓度太大时由于离子相互作用增强,电导率反而有所下降。
弱电解质的电导率随浓度的增加变化不大,一直都很小。
(强电解质的电导率随着浓度的增加先增大后减小)强电解质的摩尔电导率随着浓度的下降而升高,稀释到一定程度,摩尔电导率与浓度之间存在一种线性关系。
弱电解质的摩尔电导率随着浓度的不断下降,开始时变化不大,后来增加越来越迅速,但不存在线性关系。
(3)电导测定的应用① 测定水的纯度; ② 计算弱电解质的节粒度和解离常数;③ 测定难溶盐的溶解度; ④ 进行电导滴定3. 强电解质溶液理论(1)强电解质的例子平均活度和活度因子定义式:1()a a a ννν+-±+-= 1()νννγγλ+-±+-= 1()m m m ννν+-±+-= m a mθγ±±±= (2)离子强度 212B B BI m Z =∑(3)Debye-Hückel 极限定律 lg ||A Z Z γ±+-=-4. 可逆电池和可逆电极 (1)组成可逆电池的必要条件 化学反应可逆和能量变化可逆(2)可逆电极的类型① 第一类电极为金属电极(由金属浸在含有该金属离子的溶液中构成),还包括氢电极、氧电极、卤素电极和汞齐电极。
可逆电池的三个条件
可逆电池,也称为可充电电池,是一种能够反复充电和放电的电池类型。
它具有循环使用性、安全性、经济性和环保性等优点。
要想构建可逆电池,需要满足一定的条件:
1. 必须使用可逆容量的电极材料。
可逆电池必须使用同时具有充电和放电功能的电极材料。
这种材料需要在充电和放电过程中,其内禀能量能够反复传递,而不会出现永久性的性质变化或结构破坏。
2. 必须符合可逆电池的电解质要求。
电解质是可逆电池的重要组成部分,对于一个可逆电池,它的电解质必须足够稳定,在充放电过程中不会出现化学变化,
3. 必须有有效的电池保护系统。
可逆电池由于多次充电放电,容易出现过放和过充等情况。
为了有效的保护电池,可逆电池需要有一个有效的电池保护系统,可以在过充过放发生时自动断开电池负载,以保护电池的安全使用。
- 1 -。