物理化学第9章可逆电池
- 格式:doc
- 大小:1.12 MB
- 文档页数:45


第九章可逆电池本章用化学热力学得观点讨论电极反应得可逆行为.原电池就是将化学能转变为电能得装置,两个电极与电解质溶液就是电池最重要得组成部分。
电极电势就是本章主要概念之一,它就是相对于标准氢电极而言得电势,就是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势得原电池,其电动势就就是给定电极得标准电极电势.对于一个可逆化学电池,电极两极间得电势差称电池得电动势,可用电池反应得能斯特方程计算.因为电池电动势与热力学量之间密切相关,所以本章内容就是围绕电动势而展开。
一、基本内容(一) =-zFE式中为电池反应得摩尔吉布斯自由能变;z就是电池反应得电子得物质得量;E 为电池得电动势。
此式运用于等温等压得可逆过程,所以E为可逆电池得电动势。
此式表明,在可逆电池中,化学反应得化学能()全部转变成了电能zFE。
该式将化学反应得性质与电池得性质联系起来,就是电化学得基本公式之一。
若参与电池反应得所有物质均处于各自得标准态,则上式成为=-zFE$其中E$称为电池得标准电动势,对于指定得电池,E$只就是温度得函数.(二)电池反应得能斯特公式若电池反应为aA+bB=gG+hHE=E$—㏑此式表明,电池得电动势取决于参加反应得各物质得状态,它对如何改变电池电动势具有指导得意义,计算时首先要正确写出电池反应式。
(三)电极反应得能斯特公式若电极反应为aA+bB+ze-=gG+hHE=E —㏑式中E与E 分别为该电极得电极电势与标准电极电势。
此式表明,一个电极得电势取决于参与电极还原得各物质得状态。
计算得关键就是要正确写出电极上得还原反应.(四)E=,E =式中E与E$分别为可逆电池得电动势与标准电动势;()与()分别为正极与负极得电极电势(标准电极电势).(五)标准电动势E$与标准平衡常数K$得关系(六)电池反应得熵变就是与电池电动势得温度系数关系(七)电池反应得焓变与电池电动势E与电池电动势得温度系数得关系(八)可逆电池得反应热效应QR与电池电动势得温度系数得关系(九) 液接电势E1得计算公式E1=㏑[(a±)负/(a±)正]式中z+,z-代表正、负离子得价数,t+与t—分别代表在液-液界面处正、负离子得迁移数,一般认为就是两溶液中迁移数得平均值,即t+=1/2(t+,负+ t+,正)t-=1/2(t-,负+t-,正)(十)膜电势E m计算公式式中E m就是离子B得膜电势;zB就是离子B得价数;aB,左与a B,右分别为膜左右两侧离子B得活度。






2、 试将下列化学反应设计成电池 (1) AgCl(s)==Ag +(a Ag +) + Cl -(a Cl -)电池:Ag(s)︱Ag +(a Ag +)ǁCl -(a Cl -)︱AgCl(s)︱Ag(s) 正极:AgCl(s) + e -→Ag(s) + Cl -(a Cl -) 负极:Ag(s)–e -→Ag +(a Ag +)电池反应:AgCl(s)==Ag +(a Ag +) + Cl -(a Cl -)(3) HgO(s) + H 2(p H 2)==Hg(l)+H 2O(l)电池:Pt(s)︱H 2(p H 2)︱NaOH(a )︱HgO(s)︱Hg(l) 正极:HgO(s) + H 2O(l) + 2e -→Hg(l) + 2OH -(a ) 负极:H 2(g) + 2OH -(a ) –2e -→2H 2O(l) 电池反应:HgO(s) + H 2(p H 2)→Hg(l) + H 2O(l)5、电池Zn(s) | ZnCl 2(0.05 mol·kg ﹣1 ) | AgCl(s) | Ag(s)的电动势与温度的关系为:E/V =1.015﹣4.92×10-4 (T/K-298)试计算在298K 时,当电池有2mol 电子的电荷量输出时电池反应的Δr G m 、Δr S m 、Δr H m 以及此过程的可逆热效应Q r 。
试题解析:先利用已知关系求得298K 时的E 和(∂E/∂T )P ,再代入公式求解。
解:将T=298K 代入题目给的关系式,得题给电池的z=2,故9、试为下述反应设计一电池V V E 015.1)]298298(1092.4015.1[4=-´´-=-141092.4)/(--×´-=¶¶K V T E p 119.195)015.1965002(--×-=×´´-=-=D mol kJ mol J zFE G m r 1111496.94)]1092.4(965002[)/(-----××-=××´-´´=¶¶=D Kmol J K mol J T E zF S p m r 11112.224)]96.94(298195900[----××-=××-´+-=D ´+D =D Kmol kJ K mol J S T G H m r m r 1130.28)]96.94(298[--×-=×-´=D =molkJ mol J S T Q m r R+=+2求电池在298K 时的标准电动势、反应的和平衡常数。
第九章 可逆电池的电动势及其应用1. 原电池是使化学能能为电能的装置,其主要组成是两个电极和电解液,在等温等压条件下,体系发生变化时,系统吉氏自由能的减少等于对外所做的最大膨胀功.此时转变过程以热力学可逆方式进行,电池为可逆电池.()f ,max r T,pG W =V若非膨胀功只有电功,则(),r T p G nEF =-V如果可逆电动势为E 的电池按电池反应进行进度ξ=1mol 时吉氏自由能的变化值可以写成: ()r T,p G zEF =-V2. 该式是联系热力学和电化学扩要桥梁.可逆电池必须满足的两个条件:1. 电极上的化学反应可向正、反两个方向进行。
可逆电池工作时,电池是在接近平衡养状态下工作的。
可逆电极有以下三种类型:第一类电极:由金属浸在含有该金属离子的溶液构成。
第二类电极:由金属表面覆盖一该金属难溶盐薄层,然后浸入含有该难溶盐负离子的溶液构成。
第三类电极:由惰性金属插入含有某种离子的不同氧化态的溶液中构成电极。
电池的电动势不能直接用伏特计测量。
一般使用对消法。
需要一个电动势已知并且稳定的辅助电池,即标准电池。
常用的标准电池是韦斯顿标准电池。
电极中还包括标准氢电极。
人为规定其电极电势为0电池的书面表示采用的规则是,负极写在在方,进行氧化反应,正极写在右方,进行还原反应用单垂线表示不同物相的界面,用双垂线表示盐桥。
不觉 应注意气体应注明压力,电解质溶液应注明活度。
在书面电极和电池反应时应遵守物量和电荷量守衡。
电动势产生机理:(1)电极与电解质溶液界面间形成的电势差。
(2)接触电势。
(3)液体接界电势。
液接电势可以通过盐桥来减小。
3.可逆电池的热力学及电动势测定的应用。
Nerst 方程 g hGHc dC DIn a a RT E E zF a a =- In RTE K zF=r m T p E S zF ∂⎛⎫= ⎪∂⎝⎭V ,m T r pE H zEF zFT ∂⎛⎫=-+ ⎪∂⎝⎭Vr m R pE Q T S zFT T ∂⎛⎫=⋅= ⎪∂⎝⎭V还原电极电势:Ina RT zF a ϕϕ=--还原态氧化态应用:求电解质溶液的平均活度因子; 求难溶盐的溶度积; pH 值的测定:()s r x s pH pH In10E EF RT -==典型例题讲解例1 以M 代表某金属,MCl 2是其氧化物,是强电解质,设下列电池:()12M|MCl 1mol kg |AgCl|Ag -⋅在0~60℃间的电动势E 与温度之间的关系为: 57 =1.200V+4.0010V+9.0010V E --⨯⨯,25℃时,()()2M |M 0.9636,Ag |Ag |Cl 0.2223V E E ++-==-==(1)写出电极反应及电池反应。
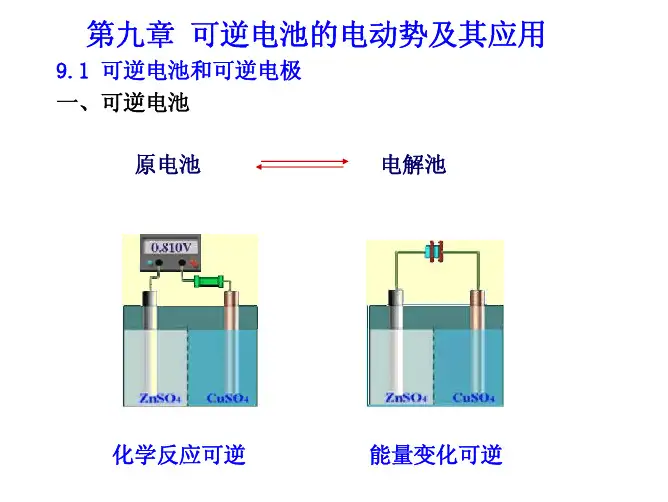
第九章 可逆电池本章用化学热力学的观点讨论电极反应的可逆行为。
原电池是将化学能转变为电能的装置,两个电极和电解质溶液是电池最重要的组成部分。
电极电势是本章主要概念之一,它是相对于标准氢电极而言的电势,是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势的原电池,其电动势就是给定电极的标准电极电势。
对于一个可逆化学电池,电极两极间的电势差称电池的电动势,可用电池反应的能斯特方程计算。
因为电池电动势与热力学量之间密切相关,所以本章内容是围绕电动势而展开。
一、基本内容(一) m r G ∆=-zFE式中m r G ∆为电池反应的摩尔吉布斯自由能变;z 是电池反应的电子的物质的量;E 为电池的电动势。
此式运用于等温等压的可逆过程,所以E 为可逆电池的电动势。
此式表明,在可逆电池中,化学反应的化学能(m r G ∆)全部转变成了电能z FE 。
该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。
若参与电池反应的所有物质均处于各自的标准态,则上式成为θm r G ∆=-zFE $其中E $称为电池的标准电动势,对于指定的电池,E $只是温度的函数。
(二) 电池反应的能斯特公式若电池反应为 aA+bB =gG+hHE=E $-zF RT ㏑b Ba A h Hg G a a a a ⋅⋅ 此式表明,电池的电动势取决于参加反应的各物质的状态,它对如何改变电池电动势具有指导的意义,计算时首先要正确写出电池反应式。
(三) 电极反应的能斯特公式若电极反应为 aA+bB+ze -=gG+hHE=E $-zF RT ㏑b Ba A h Hg G a a a a ⋅⋅p m r TzFT zFE H )E(∂∂+-=∆式中E 和E $分别为该电极的电极电势和标准电极电势。
此式表明,一个电极的电势取决于参与电极还原的各物质的状态。
计算的关键是要正确写出电极上的还原反应。
(四) E =负正E E -,E $=θθ负正E E -式中E 和E $分别为可逆电池的电动势和标准电动势;正E (θ正E )和负E (θ负E )分别为正极和负极的电极电势(标准电极电势)。
(五) 标准电动势E $与标准平衡常数K $的关系θθK zFRTE ln =(六) 电池反应的熵变θm r S ∆是与电池电动势的温度系数关系p m r TEzF S )(∂∂=∆θ(七) 电池反应的焓变θm r H ∆与电池电动势E 和电池电动势的温度系数的关系(八) 可逆电池的反应热效应Q R 与电池电动势的温度系数的关系p m r R )TEzFT(S T Q ∂∂=∆= (九) 液接电势E 1的计算公式E 1=FRTz t z t )(--++-㏑[(a ±)负/(a ±)正] 式中z +,z -代表正、负离子的价数,t +和t -分别代表在液-液界面处正、负离子的迁移数,一般认为是两溶液中迁移数的平均值,即t +=1/2(t +,负+ t +,正) t -=1/2(t -,负+ t -,正) (十)膜电势E m 计算公式B,右B,左B m a a F z RT E ln =式中E m是离子B的膜电势;z B是离子B的价数;a B,左和a B,右分别为膜左右两侧离子B的活度。
此式表明,E m取决于透过性离子在两侧溶液中的活度差异,活度差异越大,︱E m︱越大。
二、重点与难点1.电化学主要研究电能和化学能之间的相互转化及转化过程中的有关规律。
必须将电池表示式与电池反应“互译”,即将化学反应与电池反应相关联,尤其是将已知化学反应,设计成电池表示式,读者往往难以入手,这里除了熟悉几类典型的电极反应外,还需善于分析反应中有关元素在反应前后氧化态有无变化。
2.可逆电池热力学。
可逆电池必须满足两个条件:一是电极反应可逆,另一是充电放电能量可逆。
电池电动势是组成电池的各相界面上能产生电势差的代数和,用热力学可推导出电池电动势的能斯特方程,它表明电动势与物质的本性有关外,还与温度与离子的活度有关。
电池电动势与热力学函数的关系是必须掌握的重点内容之一。
3.电极电势的定义,参比电极,指示电极(玻璃电极、离子选择电极、化学修饰电极)的构造与作用,电极电势与温度和活度的关系等,尤其是对标准氢电极更要深入了解。
4.电动势测定的主要应用。
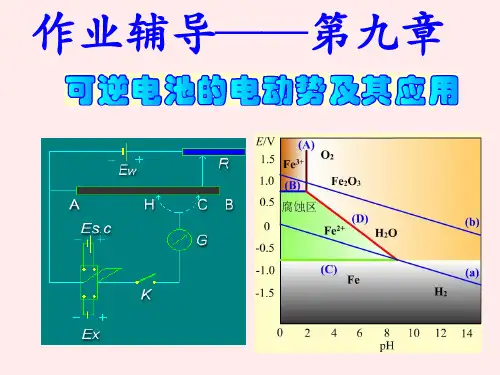
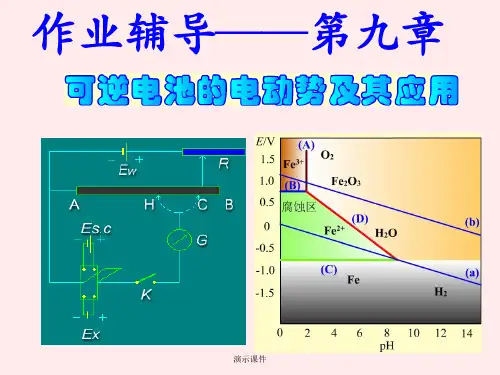
判断电池反应方向、测定溶液的pH值,求难溶盐的活度积,测定电解质离子的平均活度系数,电势-pH图及生物电化学等。
这里涉及的计算较多,需熟练运用有关概念和基础知识。
5.各类电池,尤其是新型高能电池应有所了解。
三、习题的主要类型1、书写各类电极反应及由其组成的电池反应,由化学反应书写出其对应的电池电池反应的书写应注意(1)负极写在左边,起氧化作用;正极写在右边,起还原作用;(2)“|”表示相界面,有电势差存在;(3)“||”表示盐桥,使液接电势降到可以忽略不计;(4)要注明温度,不注明就是298.15 K;要注明物态,气体要注明压力;溶液要注明浓度;(5)气体电极和氧化还原电极要写出导电的惰性电极,通常是铂电极。
在由化学反应书写出其对应的电池时,要注意:左侧的负极发生氧化反应,右侧的正极发生还原反应,(例9-1、例9-2、例9-3、例9-4)2、应用Nernst 方程计算电池的电动势和电极电势,应用电动势和温度系数计算电化学反应的热力学函数(△r G m 、△r H m 、△r S m 、Q R )(例9-5、例9-6、例9-9、例9-19)3、应用Nernst 方程计算电池反应的平衡常数(1)根据公式:)/ex p(ln RT G K K RT G m r a m r θθθθ∆-=-=∆,,其中θm r G ∆的计算是这类问题的关键,根据公式 (例9-7、例9-15、例9-18)(2)根据Nernst 方程E=E $-zF RT ㏑b Ba A h H g G a a a a ⋅⋅,求得E $,由zFE $=RT ㏑K $,得到平衡常数K $(例9-8、例9-9、例9-18、例9-20,例9-28)4、应用Nernst 方程计算电池反应的pH 值(例9-8、例9-9、例9-18、例9-20,例9-28)5、正负离子迁移数的计算:正负离子迁移数是正负离子迁移电量的与通过溶液的总电量之比,所以迁移数的计算就是电量的衡算。
可以根据液接电势E 1=FRT)(--++-z t z t ㏑[(a ±)负/(a ±)正]来计算正负离子迁移数(例9-23、例9-24、例9-25)四. 精选题及解答例9-1 写出下列中各电极上的反应和电池反应(1)Pt ,H 2(p H2)︱HCl (a )︱Cl 2(p Cl2),Pt(2)Ag(s)+AgI(s)︱I -(a I-)‖Cl -(a Cl-)︱AgCl(s)+Ag(s)(3)Pb(s)+PbSO 4(s)︱-24SO (-24SO a )‖Cu 2+(a Cu2+)︱Cu(s)∑∆=∆Bf B r B)(θθνm m G G(4)Na(Hg)(a )︱Na +(a Na+)‖OH -(a OH-)︱HgO(s)+Hg(l) 解 (1)负极 H 2→2H +﹢2e -正极 Cl 2﹢2e -→2Cl -电池反应 H 2(p H2)﹢Cl 2(p Cl2)→2HCl (a )(2)负极 Ag ﹢I -→AgI﹢e - 正极 AgCl ﹢e -→Ag﹢Cl -电池反应 AgCl(s)﹢I -(a I-)→AgI(s)﹢Cl -(a Cl-)(3)负极 Pb ﹢-24SO →PbSO 4﹢2e -正极 Cu 2+﹢2e -→Cu电池反应 Pb(s)﹢Cu 2+(a Cu2+)﹢-24SO (-24SO a )→PbSO 4(s)﹢Cu(s)(4)负极 2Na(Hg)→2Na +﹢2e - 正极 HgO ﹢H 2O ﹢2e -→Hg﹢2OH -电池反应 2Na(Hg)(a)﹢HgO(s)﹢H 2O(l)→2Na +(a Na+)﹢Hg(l)﹢2OH -(a OH -)例9-2 将下列化学反应设计成电池,并求出电池的标准电动势:(1) H 2(g)+1/2O 2(g)=== H 2O(l)(2) Zn(s)+Ag 2O(s)+H 2O(l) ===2Ag(s)+Zn(OH)2(s) (3)Mg(s)+1/2O 2(g)+H 2O(l) ===Mg(OH)2(s)解: (1) (Pt)H 2(p $)∣OH -(a OH -=1)∣O 2(p $)(Pt)复核 负极 H 2(p $)+2OH --2e -→2H 2O 正极 1/2O 2(p $)+H 2O+2e -→2OH -电池反应 H 2(p $)+1/2O 2(p $) ===H 2O(l)E $=θθ--E E +={0.401-(-0.828)}V=1.229V(2)Zn(s)︱Zn(OH)2(s)︱OH -(a OH-=1)∣Ag 2O(s),Ag(s) 复核 负极 Zn+2OH --2e -→Zn(OH)2正极 Ag 2O+H 2O+2e -→2OH -+Ag电池反应 Zn(s)+Ag 2O(s)+H 2O(l) ===2Ag(s)+ Zn(OH)2(s)E $=θθ--E E +={0.344-(-1.245)}V=1.589V(3)Mg(s),Mg(OH)2(s)︱OH -(a OH-=1)∣O 2(p $)(Pt)复核 负极 Mg+2OH --2e -→Mg(OH)2 正极 H 2O+1/2O 2(p $)+2e -→2OH -电池反应 Mg(s)+1/2O 2(p $)+H 2O(l) === Mg(OH)2(s)E $=θθ--E E +={0.401-(-2.690)}V=3.091V 例9-3 根据标准电极电势及能斯特方程,计算下列电极的电极电势,以及将第(1)组和第(2)组电极分别组成电池后的电动势,并写出电池反应。
(1)Pt(s)︱Fe 2+(a =1),Fe 3+(a =0.1) Ag(s)︱AgCl(s)︱Cl -(a =0.001) (2)Zn(s)︱Zn(OH)2(s)︱OH -(a =2)Hg(l)︱HgO(s)︱OH -(a =2) 解(1)++++++-=322323ln /Fe Fe /Fe Fe Fe Fe a a zF RT E E θ={0.771-0.0592lg 1.00.1}V =0.712V--=Cl Ag AgCl a zFRTE E AgAgCl ln //θ={0.222-0.0592lg0.001}V=0.400V 组成的电池为Ag(s)︱AgCl(s)︱Cl -(a =0.001)‖Fe 2+(a =1),Fe 3+(a =0.1)︱Pt(s) 电池反应:Ag+Fe 3+(a =0.1)+Cl -(a =0.001)==Fe 2+(a =1.0)+AgCl(s);E=-+-E E ={0.712-0.400}V=0.312V(2)V V a FRT E E OH Zn OH Zn Zn OH Zn 263.1}2lg 0592.0245.1{ln 22/)(/)(22-=--=-=-θ;V V a FRT E E OH Hg HgO Hg HgO 0806.0}2lg 0592.00984.0{ln 22//=-=-=-θ组成的电池为Zn(s)︱Zn(OH)2(s)︱OH -(a =2)︱HgO(s)︱Hg(l)电池反应为 :Zn(s)+HgO(s)+H 2O(l)=Zn(OH)2(s)+Hg(l)E=-+-E E ={0.0806-(-1.263)}V=1.3436V例9-4 试根据下列电极反应的θE (电极)值Fe 2+(a =1)+2e -→Fe(s),Ø1E =-0.440VFe 3+(a =1)+ e -→Fe 2+(a =1),Ø2E =0.771V计算电极反应Fe 3+(a =1)+3e -→Fe(s)的ØE 的值。