第九章 可逆电池电动势及其应用
- 格式:doc
- 大小:96.00 KB
- 文档页数:5

第九章 可逆电池的电动势及其应用【复习题】【1】可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应,对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?【答】可逆电极主要有三类:A.第一类电极:由金属浸在含有该金属离子的溶液中组成。
如锌电极 22()|()Zn Zn a Zn s ++ 22()2()Zn Zn a e Zn s ++-+→ 222,,1ln2Zn Zn Zn ZnZn RT F a θϕϕ+++=- 属于第一类电极的除了金属电极外,还有气体电极(比如氢电极、氧电极和卤素电极)和汞齐电极等。
B. 第二类电极:包括难溶盐电极和难溶氧化物电极难溶盐电极:由金属表面覆盖一薄层该金属的难溶盐,然后浸在含有该难溶盐的负离子的溶液中组成。
例如甘汞电极 ()|()|(Cl Cl a AgCl s Ag s -- ()()()Cl AgCl s e Ag s Cl a ---+=+ ln Cl RTa Fθϕϕ-=-难溶氧化物电极:由金属表面覆盖一薄层该金属的难溶氧化物,然后浸在含有H +或OH -离子的溶液中组成。
例如汞-氧化汞电极()()|Hg s HgO s H OH +--或(a )2()2()2()HgO s H O e Hg s OH a --++=+ ln RTa Fθϕϕ=-C.第三类电极:叫氧化还原电极。
由惰性金属(如铂片)插入含有某种离子的不同氧化态溶液中构成的电极。
例如3232(),()|()Fe Fe Fe a Fe a Pt s ++++3212()()Fe a e Fe a +-++→ 32321,,2ln Fe Fe Fe Fe a RT F a θϕϕ++++=- 对于气体电极和氧化还原电极在书写电极表示式时应注意:要有惰性金属作为导体,惰性金属只传导电子,不发生化学变化。
【2】什么叫电池的电动势?用伏特表测得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?【答】(1)电池的电动势是原电池组成相间的各界面上所产生的电势差的代数和。




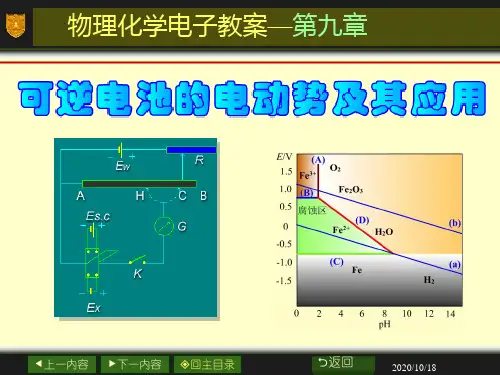




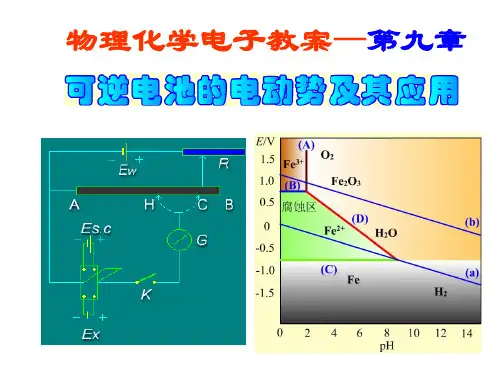
第九章 可逆电池的电动势及其应用1. 原电池是使化学能能为电能的装置,其主要组成是两个电极和电解液,在等温等压条件下,体系发生变化时,系统吉氏自由能的减少等于对外所做的最大膨胀功.此时转变过程以热力学可逆方式进行,电池为可逆电池.()f ,max r T,pG W =V若非膨胀功只有电功,则(),r T p G nEF =-V如果可逆电动势为E 的电池按电池反应进行进度ξ=1mol 时吉氏自由能的变化值可以写成: ()r T,p G zEF =-V2. 该式是联系热力学和电化学扩要桥梁.可逆电池必须满足的两个条件:1. 电极上的化学反应可向正、反两个方向进行。
可逆电池工作时,电池是在接近平衡养状态下工作的。
可逆电极有以下三种类型:第一类电极:由金属浸在含有该金属离子的溶液构成。
第二类电极:由金属表面覆盖一该金属难溶盐薄层,然后浸入含有该难溶盐负离子的溶液构成。
第三类电极:由惰性金属插入含有某种离子的不同氧化态的溶液中构成电极。
电池的电动势不能直接用伏特计测量。
一般使用对消法。
需要一个电动势已知并且稳定的辅助电池,即标准电池。
常用的标准电池是韦斯顿标准电池。
电极中还包括标准氢电极。
人为规定其电极电势为0电池的书面表示采用的规则是,负极写在在方,进行氧化反应,正极写在右方,进行还原反应用单垂线表示不同物相的界面,用双垂线表示盐桥。
不觉 应注意气体应注明压力,电解质溶液应注明活度。
在书面电极和电池反应时应遵守物量和电荷量守衡。
电动势产生机理:(1)电极与电解质溶液界面间形成的电势差。
(2)接触电势。
(3)液体接界电势。
液接电势可以通过盐桥来减小。
3.可逆电池的热力学及电动势测定的应用。
Nerst 方程 g hGHc dC DIn a a RT E E zF a a =- In RTE K zF=r m T p E S zF ∂⎛⎫= ⎪∂⎝⎭V ,m T r pE H zEF zFT ∂⎛⎫=-+ ⎪∂⎝⎭Vr m R pE Q T S zFT T ∂⎛⎫=⋅= ⎪∂⎝⎭V还原电极电势:Ina RT zF a ϕϕ=--还原态氧化态应用:求电解质溶液的平均活度因子; 求难溶盐的溶度积; pH 值的测定:()s r x s pH pH In10E EF RT -==典型例题讲解例1 以M 代表某金属,MCl 2是其氧化物,是强电解质,设下列电池:()12M|MCl 1mol kg |AgCl|Ag -⋅在0~60℃间的电动势E 与温度之间的关系为: 57 =1.200V+4.0010V+9.0010V E --⨯⨯,25℃时,()()2M |M 0.9636,Ag |Ag |Cl 0.2223V E E ++-==-==(1)写出电极反应及电池反应。
第九章 可逆电池的电动势及应用本章要求:1.掌握构成可逆电池的必要条件,可逆电极的类型和电池的书写方法,能熟练正确地写出电极反应和电池反应。
2.了解消去测电动势的基本原理和标准电池的作用。
3.能正确写出电极和电池反应,熟练应用Nernst 方程计算电极电势和电池电动势。
4.了解电动势产生的机理和氢标准电极的作用。
5.掌握热力学和电化学之间的联系、会利用电化学所测定的数据计算热力学函数的变化值。
6.熟悉电动势测定的主要应用,并能从可逆电池测定数据计算平均活度因子,解离平衡常数和溶液PH 等。
电池:化学能转变为电能的装置可逆电池:化学能转变为电能并按热力学可逆方程进行的装置在等温等压条件下,分流吉布斯自由能的减少等于系统对外所做的最大非膨胀功,若非膨胀功只是电功(本章只讨论此种情况)则:nEF G P T r -==∆M ax .f .w )(式中n 为电池输出电荷的物质的量,E 为可逆电池的电动势,单位 V 若电池反应的反应进度ε = 1 mol 时, 则:ZEF nEFG P T r -=-=∆ε.)(Z 为电极反应中电子的计量系数当电池为不可逆电池时,两电极间的不可逆电势差一定小于可逆电池电动势E§9.1可逆电池和可逆电极①该反应为氧化还原反应或反应过程经历了氧化还原反应结合P61图9.1分析电池的构成电极②适当的装置 单液 电解质溶液 分类双液 一.可逆电池必须具备的条件1.充放电的电极反应必须互为可逆,即充放电时整个电池反应必须互为可逆→物质的转变可逆。
2.充放电时即可逆电池工作时,所有通过的电流必须无限小,只有所通过的电流无限小,才不会有电功不可逆地转化为热,才符合热力学可逆过程的条件。
由此可见,可逆电池在充放电时,不仅物质的转化可逆,而且能量的转变也必须可逆。
判断某电池是否为可逆电池主要看电极反应和电池反应是否可逆,若可逆,只要满足充放电时所通过的电流很小,则可构成可逆电池。
第九章 可逆电池的电动势及其应用教学目的与要求:使学生了解和掌握电池过程的热力学函数改变m m m S H G ∆∆∆,,与电功、电动势的关系,了解电动势产生的原因和熟悉电化学的惯用符号;熟练地从所给电池、电极写出有关的电化学反应方程式以及根据所给化学反应设计原电池;掌握电池电动势、电极电势的能斯特方程与电动势测定的应用。
石化学能转变为电能的装置称为原电池或电池。
如果这个转变过程是在热力学上的可逆的条件下进行的,则这个电池称为可逆电池。
在等温等压及可逆的条件下,系统Gibbs 自由能的减少等于系统所作的最大非体积功.()max,,f pT W G =∆如果非膨胀功只是电功,则上式可以写成()nEF W G f p T -==max ,,∆式中为电池输电荷的物质的量,单位为mol ,E 为可逆电池的电动势,单位为V ,F 是Faraday 常数。
如果电池在放电的过程中,按反应式发生了1=ξmol 的化学反应,系统的Gibbs 自由能的变化为()zEFnEFG pT m-=-=ξ∆,或中为按所写的电极反应,当反应进度1=ξmol 时,反应式中电子的计量系数,其单位为1。
上式是一个重要的关系式,是联系热力学和电化学的一个桥梁,可以使人们通过对可逆电池的电动势的测定等电化学方法求得电池反应的各种热力学函数的改变量。
同时上式也揭示了化学能转变为电能的最高限度,为改善电池性能或研制新的化学电源提供了理论依据。
重点与难点:电池过程和热力学的关系,即电池过程的热力学函数改变m m m S H G ∆∆∆,,与电功、电动势的关系以及可逆电池的条件, 电动势的测定;电池电动势产生的机理;电池电动势(包括浓差电池)的计算以及可逆电池电动势的测定的应用等。
§9.1 可逆电池与可逆电极要使化学能可逆的转化为电能,首先必要的条件是在电极上发生一个或几个氧化还原应(只有这样,才可能由电子的转移),并且是有适当的装置—电池,其次,这个电能与化学能之间的转换必须是可逆的。
可逆电池电动势及其应用一、简答题1.标准电极电势等于电极与周围活度为1的电解质之间的电势差,这种说法对吗?为什么?2.为什么要提出标准氢电极?标准氢电极θϕ实际上是否为零?当H +的活度不等于1时,2,H H ϕ+是否仍为零?3.在公式m r H ∆=-zEF +zFT (E T ∂∂)p 中,当(ET ∂∂)p <0时,测定m r H ∆<-zEF ,则m r H ∆一部分转变为电功,一部分以热的形式放出。
所以在相同的始终态下,化学反应的m r H ∆比安排成电池的m r H ∆大,这种说法对不对?为什么?4.将下列化学反应设计成电池:(1)AgBr(s)→Ag ++Br -;(2) Fe 3++Ag→Fe 2++Ag +;(3) 2Br -+Cl 2(g)→Br 2(l)+2Cl -。
5.将下列反应物设计成电池:(1) Ti ++Sn 4+→Ti 3++Sn 2+;(2) 2Br -+Cl 2→Br 2+2Cl -;(3) AgCl+I -→AgI+Cl -。
6.为什么不能用普通电压表直接测量可逆电池的电动势?7.Zn 和Ag 插在HCl 溶液中所构成的原电池是否是可逆电池?为什么?8.下列两个反应设计成电池,此两个电池的E θ、电池反应的ΔG θ及K θ是否相同?为什么?(1)H 2(g)+1/2O 2(g)→H 2O(l)(2)2H 2(g)+ O 2(g)→2H 2O(l)9.已知电池Ag-AgCl(s)|HCl (m=0.01 mol·kg -1)| Cl 2 (g, p )| Pt 在25℃时,E=1.135V ,如果以m=0.10 mol·kg -1代替m=0.01 mol·kg -1的HCl ,电池电动势将改变多少?10.同一反应,如Cu 2+ + Zn = Cu + Zn 2+,化学反应的热效应和电池反应的热效应是否相同?为什么?二、计算题1. 已知丹聂尔电池在298.2K时,Eø=1.1000V,在313K时Eø=1.01961V。
若在298.2K~313K之间电池温度系数为常数,计算该电池在298.2K时放电2mol 电子的电量时电池反应的Δr S m及Q r。
[答案:ΔrS m= -50.86 J·K-1·mol-1 ;Q r= -15.17 kJ·mol-1 ]2.已知电极:φθ[H2(g)|OH-1(aq)]=-0.8277V,求水在292K时的离子积K s p。
[答案:K w=1.0×10-14 ]3.已知:φθ(AgBr/Ag)=0.0711 V;φθ(Ag/Ag+)=0.799V,计算298K时AgBr的溶度积。
[答案:K sp=4.866×10-13 ]4. 有一原电池Ag | AgCl(s) | Cl-(a=1)||Cu2+(a=0.01)| Cu。
(1)写出上述原电池的反应式;(2)计算该原电池在25℃时的电动势E;(3)25℃时,原电池反应的吉布斯函数变(∆r G m)和平衡常数K各为多少?已知:Eθ (Cu2+|Cu) = 0.3402V,Eθ (Cl-|AgCl|Ag) =0.2223 V。
[答案:(1)2Ag+2Cl-(a=1) + Cu2+(a=0.01) ==== 2AgCl(s) + Cu(2)E= 0.05875 V(3)∆r G m=-11.337 kJ·mol-1;Kθ=9.68×103 ]5. 25℃时,对电池Pt |Cl2(pθ) ⎢Cl-(a=1) || Fe3+(a=1) ,Fe2+(a=1) ⎢Pt:(1)写出电池反应;(2)计算电池反应的∆r G及Kθ值;(3)当Cl-的活度改变为a(Cl-) = 0.1时,E值为多少?(已知Eθ (Cl-|Cl2|Pt) =1.3583 V,Eθ (Fe3+,Fe2+ | Pt) = 0.771V。
)[答案:(1)2 Cl-(a=1) +2 Fe3+(a=1)=== Cl2(p)+2 Fe2+(a=1)(2)∆r G=113331 J·mol-1;Kθ=1.387×10-20(3)E=-0.6465 V]6. 下列电池:Pt,H2(pø)|H2SO4(aq)|O2(pø),Pt298K时E=1.228V,已知液体水的生成热Δf H mθ(298K,H2O,l) = -2.851×105J·mol-1。
(1)写出电极反应和电池反应;(2)计算此电池电动势的温度系数;(3)假定273K~298K之间此反应的Δr H m为一常数,计算电池在273K时的电动势。
[答案:(1) (-) H 2→2H ++2e (+)1/2O 2+2H ++2e→H 2O(l)电池反应:H 2(g)+1/2O 2(g)→H 2O(l)(2) (∂E/∂T)p =-8.537×10-4 (V·K -1) ;(3) E=1.25(V) ]7. 291K 时下述电池:Ag ,AgCl|KCl(0.05mol·kg -1,γ±=0.84)‖AgNO 3|(0.10mol·kg -1,γ±=0.72)|Ag 电动势E=0.4312 V ,试求AgCl 的溶度积K sp 。
[答案:K sp =1/K ø=1.03×10-10 ]8. 电池Hg|Hg 2Br 2(s)| Br -(aq)|AgBr(s)|Ag ,在标准压力下,电池电动势与温度的关系是:E=68.04/mV+0.312×(T/K-298.15)/ mV , 写出通过1F 电量时的电极反应与电池反应,计算25℃时该电池反应的Δr G m θ,Δr H m θ,Δr S m θ。
[答案:电极反应: (-)Hg(l) + Br -(aq)→1/2Hg 2Br 2(s) + e -(+)AgBr(s) + e -→Ag(s) + Br -(aq)电池反应: Hg(l)+ AgBr(s)→1/2 Hg 2Br 2(s)+ Ag(s)1565.6-⋅-∆mol kJ G m r θ;11103.30--⋅⋅=∆K mol J S mr θ;121.2410-⋅=∆mol J H m r θ] 9. 将AgCl 的溶解反应:AgCl(s) → Ag +(a Ag +) + Cl -(a Cl -)设计成电池,并写出阳极、阴极反应。
若已知V Ag AgCl Cl E 2222.0),/(=-θ, V Ag Ag E 7994.0)/(=+θ,计算该反应的溶度积SP K 。
[答案:阳极(-)氧化 )(s Ag ————→-+++e a Ag Ag )( 阴极(+)还原 )(s A g C l + e - ————→)()(--+Cl a Cl s Ag 电池为:-)+-+-+(),(|)(||)(|Ag s AgCl a Cl a Ag Ag Cl Ag RT FE Cl Ag SP e a a K /θ=⋅=-=298314.8)7994.02222.0(96500⨯-⨯e 101075.1-⨯=]10.有电池Ag s AgBr a Br a Ag Ag ),(|)(||)(|21-+,已知:AgBr(s)的活度积在25℃时为5×10-13,V E Ag Ag 799.0/=+θ,V E Pt Br Br 065.1,2/=-θ(1).写出此电池的电极反应与电池反应;(2).计算Br - | AgBr(s) | Ag 的标准电极电势;(3).计算AgBr(s)的标准生成Gibbs 函数))((s AgBr G m f θ∆。
[答案:(1) 阳极(-):Ag(s) ————→ Ag +(a 1)+e -阴极(+):AgBr(s)+e - ————→ Ag(s)+Br -(a 2)电池反应:AgBr(s) ————→ Ag +(a 1)+Br -(a 2)(2).电池的标准电动势θθθAg Ag Ag AgBr Br E E E /1,/+-+=V V 799.0727.0+-=V 072.0= (3).)(AgBr G rG m f m θθ∆=∆ 18.95-⋅-=mol kJ ] 11.有电池:Pt p g O kg mol SO H p g H Pt ),,(|)01.0(|),(,21422θθ-⋅已知298K 时H 2O(l )的标准摩尔生成焓18.285-⋅-=∆mol kJ H m f θ,H 2O(l )的标准摩尔生成Gibbs 函数114.237-⋅-=∆mol kJ G m f θ,①写出电池的电极反应与电池反应;②计算298K 时,电池电动势和电池的温度系数;③若电动势温度系数可视为与温度无关的常数,计算上述电池在0℃时的电动势。
[答案:① 阳极(-):),(2θp g H ————→--++⋅e kg mol H 2)01.0(21 阴极(+):-+++e H p g O 22),(212θ————→O H 2(l ) 电池反应:),(21),(22θθp g O p g H +————→O H 2(l )② V zF G E m r ]964852/10147.237([/3⨯⨯--=∆-=V 229.1= T E z F T H z F T G z F T H T E m r m r m r +∆=∆-∆=∂∂)(131085.0--⋅⨯-=K V ③ )298273(1085.03298273-⨯-=-E E V 250.1=]12. 电池Hg s Cl Hg KCl s AgCl Ag |)(|)(|)(|22溶液的电池反应为:Hg s AgCl s Cl Hg Ag +=+)()(2122已知25℃时,此反应的焓变15435-⋅=∆mol J H m r ,各物质的规定熵11/--⋅⋅molK J S m 分别为: Ag(s) 42.55AgCl(s) 96.2Hg(l ) 77.4Hg 2Cl 2(s) 195.8试计算25℃时电池的电场E 及电池的温度系数p T E )(∂∂。
[答案:1410436.396485115.33/)(--⋅⨯=⨯=∆=∂∂K V zF S T E m r P ] 13. 计算下列电池在25℃时电池反应的电势。
Ag kg mol b AgNO kg mol b AgNO Ag ⎪⎪⎭⎫ ⎝⎛=⋅=⎪⎪⎭⎫ ⎝⎛=⋅=±-±-720.01.0900.001.0|1313γγ[答案:1,12,21,2,ln ln ±±±±==γγb b F RT a a F RT E V 0534.0=] 14.298K 时,电池Cd|CdCl 2 (0.01 mol•dm -3)|AgCl(s)|Ag 的电动势为0.7588V ,标准电动势为0.5732V 。