分子晶体
- 格式:ppt
- 大小:1.75 MB
- 文档页数:46

分子晶体温故1.晶体中的粒子可以是分子、原子或离子;粒子间的相互作用可以是共价键、离子键、金属键或分子间作用力。
2.根据晶体中粒子间的相互作用及排列方式,可把晶体分为分子晶体、共价晶体、离子晶体和金属晶体。
1 分子晶体的定义只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
如I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
名师提醒(1)定义中的“分子”指真实存在的小分子、分子的聚集体、缔合分子、大分子(高分子),因此,H2SO4、H2O2、C4H10等既是化学式也是分子式。
(2)离子化合物、金属单质、原子间相互结合形成空间网状结构(如金刚石、SiO2)的物质中没有分子,因此,Na2O2、Fe、SiO2等是化学式而不是分子式。
(3)稀有气体的分子是单原子分子,因此,由稀有气体单质形成的晶体也是分子晶体。
2 分子晶体中的粒子及粒子间的相互作用3 常见的典型分子晶体(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX(卤化氢)等。
(2)部分非金属单质:X2(卤素单质)、O2、H2、S8、N2、P4、C60、稀有气体等。
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等。
(4)几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物:苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
4 分子晶体的物理性质(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。





常见分子晶体分子晶体是由大量的有机分子(或者有机分子和无机分子的混合)组成的三维晶体。
它们是化学物质的纯净结晶形态,具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等。
芳烃晶体是指碳原子四面有同种或不同种芳基的晶体结构。
芳烃的晶体常由四面环结构所组成,这些环可以是环状的(例如苯和芘),也可以是网状的(例如吡啶)。
芳烃晶体的晶体结构的分子间的互相接触是由共价键形成的,因此它们具有非常高的熔点,比其它晶体都要高。
烷烃晶体是指由碳原子四面均附有烷基(由一个羟基和一个不饱和羟基连接而成)的晶体结构。
它们具有非常高的熔点,晶体结构的分子间由共价键构成的范式,如甲烷的「空气状(cellular)」晶体结构。
烯烃晶体也是四面均有烷基附有的晶体,但是具有一个不饱和三环(即烯烃),而不是共价键构成的范式。
烯烃晶体有大量的晶体结构类型,其中包括有萘烷(naphthalene)、芘(phenanthrene)和芪(acenaphthene)等。
萘烷晶体是指一种晶体结构,由两个连在一起的萘环(含有八个碳原子)所组成。
由于其具有古老的烯烃结构,萘烷晶体通常具有较高的熔点和灭火点,而且还具有很强的光学特性,如上转换性、荧光光谱和悬浮特性等。
苯烷晶体是指碳原子四面都附有苯基的晶体结构。
它们的分子间的相互作用是由共价键构成的,而不是烯烃晶体的烯环,因此它们的晶体结构就像甲烷一样,并且具有较高的熔点。
苯烷晶体有一种变体,称为叶绿素晶体,它由二环芳烃和两个饱和羟基所组成,具有丰富的荧光特性和传输性。
总之,常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等,它们均具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
其中,芳烃晶体是由碳原子四面有同种或不同种芳基的晶体结构组成,而烷烃晶体和烯烃晶体则是由碳原子四面均附有烷基的晶体结构,萘烷晶体是由两个连在一起的萘环构成,而苯烷晶体则是由碳原子四面都附有苯基的晶体结构。

分子晶体分子晶体,指分子间以范德华力相互结合形成的晶体。
大多数非金属单质及其形成的化合物如干冰(CO2)、I2、大多数有机物,其固态均为分子晶体。
分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
分子间的作用力很弱,分子晶体具有较低的熔、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态,例如O2、CO2是气体,乙醇、冰醋酸是液体。
同类型分子的晶体,其熔、沸点随分子量的增加而升高,例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。
但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
分子组成的物质,其溶解性遵守“相似相溶”原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性的有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。
根据此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
物质类别及举例所有非金属氢化物:如水、硫化氢部分非金属单质:如卤素单质部分非金属氧化物:如CO2、SO2绝大多数有机物(有机盐除外)几乎所有的酸(除外:一水合高氯酸的是离子晶体)离子晶体物理学概念,指离子间通过离子键结合形成的晶体。
离子间通过离子键结合形成的晶体。
在离子晶体中,阴、阳离子按照一定的格式交替排列,具有一定的几何外形,例如NaCl是正立方体晶体,Na+离子与Cl-离子相间排列,每个Na+离子同时吸引6个Cl离子,每个Cl-离子同时吸引6个Na+。
不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。
离子晶体中不存在分子,通常根据阴、阳离子的数目比,用化学式表示该物质的组成,如NaCl表示氯化钠晶体中Na+离子与Cl-离子个数比为1∶1,CaCl2表示氯化钙晶体中Ca2+离子与Cl-离子个数比为1∶2。


分子晶体的物质类别
分子晶体是一种晶体结构,由分子组成。
根据分子间的相互
作用和排列方式,可以将分子晶体分为以下几种物质类别:
1.共价分子晶体:共价分子晶体由共价键连接的分子组成。
在这种晶体中,每个分子都保持其完整的结构和完整的共价键。
例如,石墨是由碳原子构成的共价分子晶体,在石墨中,碳原
子形成了层状结构,并以弱的范德华力相互吸引。
2.极性分子晶体:极性分子晶体由带有正负电荷的极性分子
组成。
这些极性分子通过静电相互作用形成结晶。
例如,氯化
钠是典型的极性分子晶体,由带有正电荷的钠离子和带有负电
荷的氯离子组成。
3.范德华分子晶体:范德华分子晶体由非极性分子组成,分
子间相互作用主要是范德华力。
这种晶体的分子间力较弱,因
此通常具有较低的熔点和挥发性。
例如,固体二氧化碳(干冰)就是一个范德华分子晶体。
4.氢键分子晶体:氢键分子晶体是通过氢键相互连接的分子
构成的晶体。
氢键是一种静电吸引力,通常是在一个氢原子与
一个电负性较强的原子之间形成的。
许多生物分子和有机化合
物可以形成氢键分子晶体,例如冰和尿素晶体。
5.配位分子晶体:配位分子晶体由金属离子和有机配体分子
组成。
在这种晶体中,金属离子作为中心原子与多个配体分子
形成化学键。
这种晶体具有较高的熔点和硬度,通常具有特殊的化学和物理性质。
这些是分子晶体的一些基本物质类别,每种类别都有其特定的结构和性质。
分子晶体在化学、材料科学和生物学等领域具有重要的应用价值。

第三章晶体结构与性质第二节分子晶体与共价晶体【学习目标】1.能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。
2.能利用分子晶体的通性推断常见的分子晶体,理解分子晶体中微粒的堆积模型,并能用均摊法对晶胞进行分析。
3.能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间的作用对共价晶体物理性质的影响。
4.能利用共价晶体的通性推断常见的共价晶体,并能利用均摊法对晶胞进行分析。
【基础知识】一、分子晶体(一)分子晶体的概念与性质1、分子晶体的概念只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
2、分子晶体中的粒子及粒子间的相互作用3、常见的典型分子晶体(1)所有非金属氢化物:如H2O、H2S、NH3、CH4、HX(卤化氢)等。
(2)部分非金属单质:如X2(卤素单质)、O2、H2、S8、P4、C60、稀有气体等。
(3)部分非金属氧化物:如CO2、SO2、NO2、P4O6、P4O10等。
(4)几乎所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物:如苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
4、分子晶体的物理性质(1)分子晶体熔、沸点较低,硬度很小。
(2)分子晶体不导电。
(3)分子晶体的溶解性一般符合“相似相溶”规律。
5、分子晶体的判断方法(1)依据物质的类别判断部分非金属单质、所有 非金属氢化物 、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
(2)依据组成晶体的粒子及粒子间作用判断组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
(3)依据物质的性质判断分子晶体的 硬度 小, 熔、沸点 低,在熔融状态或固体时均不导电。
6、分子晶体熔、沸点高低的判断(1)组成和结构相似,不含氢键的分子晶体,相对分子质量越 大 ,范德华力越 强 ,熔、沸点越 高 ,如I 2>Br 2>Cl 2>F 2,HI >HBr >HCl 。
HXC60P106, P1010都形成分子晶体,只有很少的一部分和______SiO2,碳化硅,第二节分子晶体和原子晶体一、分子晶体(一)、概念:分子间以______________________ (_____________ , ________________ )相结合的晶体叫分子晶体。
注意:(1)构成分子晶体的粒子是 ______________________ 。
(2 )在分子晶体中,分子内的原子间以结合,而相邻分子靠或相互吸引。
(3 )范德华力化学键的作用:(4 )分子晶体熔化破坏的是O(二)•分子晶体的物理特性:(1)___ 的熔点和沸点,(2) ______________ 的硬度,________ 挥发, _________ 升华(3)—般都是________ 体,固体和熔融状态都__________________ 导电。
(4)分子晶体的溶解性与溶质和溶剂的分子的___________________ 相关一一____________________思考:1、为什么分子晶体熔沸点低、易挥发、易升华、硬度小?原因:分子晶体发生这些变化时_只破坏 __________________________ , ________________ 很弱,克服它时需要的能量小。
所以分子晶体熔沸点低、易挥发、易升华、硬度小。
2、为什么分子晶体在晶体和熔融状态均不导电?它们在晶体和熔融状态均不存在_______________________ 。
部分分子晶体溶于水在水分子作用下发生_____________ 导电,如HCI, H2S04 ;有些溶于水与水反应生成_______________________________ 而导电,晶体硼等。
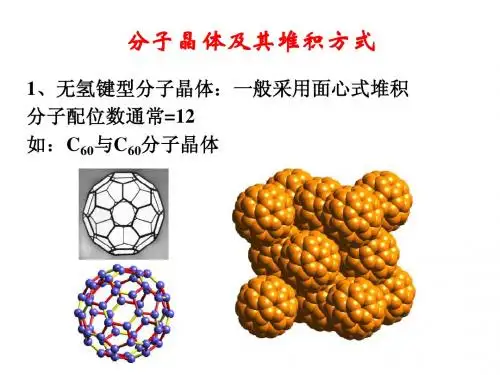
)(四)分子晶体结构特征1. ______________________________ __ 分子密堆积每个分子周围有______________ 个紧邻的分子,如:C60、干冰、12、02——不具有分子密堆积特征P1,CH4,2,冰中1个水分lmol冰周I韦]有mol氢键。
第二节分子晶体和共价晶体一、分子晶体1.概念:只含分子的晶体。
2.粒子间的作用分子晶体中相邻的分子间以分子间作用力相互吸引。
3.常见分子晶体及物质类别【注】稀有气体为的分子为单原子分子,因此,有稀有气体单质形成的晶体也是分子晶体。
4.物理特性(1)分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发,部分分子晶体易升华,(如干冰、碘、红磷等)。
(2)一般是绝缘体。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)溶解性符合“相似相溶规律”。
【注】分子晶体熔、沸点高低的比较规律①分子晶体中分子间作用力越大,物质熔、沸点越高,反之越低。
②具有氢键的分子晶体,熔、沸点反常高。
5.分子晶体的常见堆积方式6.常见分子晶体的结构分析(1)冰①水分子之间的主要作用力是氢键,当然也存在范德华力。
②氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子互相吸引。
(2)干冰①干冰中的CO 2分子间只存在范德华力,不存在氢键。
②每个晶胞中有4个CO 2分子,12个原子。
每个CO 2分子周围等距离紧邻的CO 2分子数为12个。
【注】冰晶体中,每个水分子与其他4个水分子形成氢键,每个水分子平均形成2个氢键(每个氢键由2个水分子均摊,故4×21=2)二、共价晶体1.定义:所有原子都以共价键相互结合形成共价键三维骨架结构的晶体叫共价晶体。
2.构成微粒及微粒间的作用力共价晶体⎩⎨⎧ 构成粒子:原子粒子间作用力:共价键【注】①共价晶体中不存在单个分子,因此,共价晶体的化学式不代表其实际组成,只表示其组成的原子个数比。
①共价晶体融化时被破坏的作用力是共价键。
①共价晶体中只有共价键,但含有共价键的晶体不一定是共价晶体。
如CO2、H2O等分子晶体中也含有共价键。
3.常见的共价晶体4.共价晶体的物理性质(1)熔点很高。