分子晶体与原子晶体
- 格式:pptx
- 大小:1.76 MB
- 文档页数:46


晶体的常识分子晶体与原子晶体【学习目标】1、初步了解晶体的知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图;2、知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成;3、了解分子晶体和原子晶体的特征,能以典型的物质为例描述分子晶体和原子晶体的结构与性质的关系;4、知道分子晶体与原子晶体的结构粒子、粒子间作用力的区别。
【要点梳理】要点一、晶体与非晶体【分子晶体与原子晶体#晶体与非晶体】1、概念:①晶体:质点(分子、离子、原子)在空间有规则地排列成的、具有整齐外型、以多面体出现的固体物质。
晶体具有的规则的几何外形源于组成晶体的微粒按一定规律周期性的重复排列。
②非晶体:非晶态物质内部结构没有周期性特点,而是杂乱无章地排列,如:玻璃、松香、明胶等。
非晶体不具有晶体物质的共性,某些非晶态物质具有优良的性质要点诠释:晶体与非晶体的区分:晶体是由原子或分子在空间按一定规律周期性地重复排列构成的固体物质。
周期性是晶体结构最基本的特征。
许多固体的粉末用肉眼是看不见晶体的,但我们可以借助于显微镜观察,这也证明固体粉末仍是晶体,只不过晶粒太小了。
晶体的熔点较固定,而非晶体则没有固定的熔点。
区分晶体和非晶体最可靠的科学方法是对固体,进行X—射线衍射实验,X射线透过晶体时发生衍射现象。
特别注意:一种物质是否晶体,是由其内部结构决定的,而非由外观判断。
2、分类:说明:①自范性:晶体能自发性地呈现多面体外形的性质。
所谓自范性即“自发”进行,但这里要注意,“自发”过程的实现仍需一定的条件。
例如:水能自发地从高处流向低处,但若不打开拦截水流的闸门,水库里的水不能下泻;②晶体自范性的条件之一:生长速率适当;③晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象。
4、晶体形成的途径:①熔融态物质凝固,例:熔融态的二氧化硅,快速冷却得到玛瑙,而缓慢冷却得到水晶。
②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。

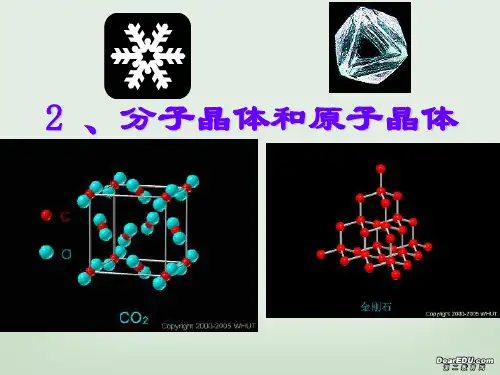
分子晶体和原子晶体
1、分子晶体和原子晶体区别:
(1)单体结构不同。
分子晶体一般是有物质分子构成,而原子晶体一般有单个原子构成;
(2)晶体内作用力不同。
分子晶体一般是通过分子间范德华力作用形成,而原子晶体一般通过原子共价键作用形成;
(3)物理性质不同。
分子晶体一般硬度、熔点较低,而原子晶体一般硬度、熔点很高。
比如白糖属于分子晶体,而钻石属于原子晶体,二者硬度、熔点差别很大;
(4)存在形式有差异。
分子晶体一般有固、液、气三种存在形式,而原子晶体一般只有固体存在形式。
分子晶体典型代表:
1、所有非金属氢化物;
2、大部分非金属单质(稀有气体形成的晶体也属于分子晶体),如:卤素(X2)、氧气、硫(S8)、氮(N2)、白磷(P4)、C60等(金刚石,和单晶硅等是原子晶体);
3、部分非金属氧化物,如:CO2、SO2、SO3、P4O6、P4O10等(如SiO2是原子晶体) ;
4、几乎所有的酸;
5、绝大多数有机化合物,如:苯、乙酸、乙醇、葡萄糖等 ;
6、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、
易挥发的固态物质。
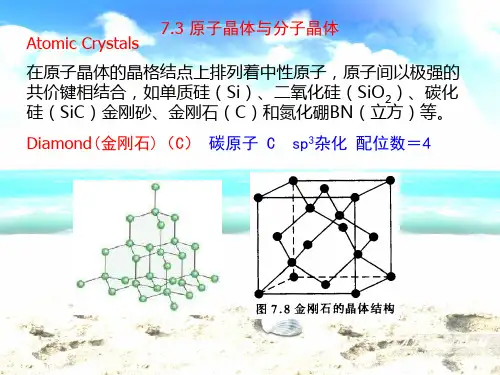
原子晶体类型:
1、某些金属单质:晶体锗(Ge)等;
2、某些非金属化合物:氮化硼(BN)晶体、碳化硅、二氧化硅等;
3、非金属单质:金刚石、晶体硅、晶体硼等。

原子晶体分子晶体
原子晶体和分子晶体都是固体的一种形式,它们之间的主要区别在于它们的基本构建单位。
1. 原子晶体:
•构建单位:在原子晶体中,基本的构建单位是原子。
这些原子通过离子键、共价键或金属键等方式相互结合,形成均匀的晶体结构。
•例子:金属晶体(如铁、铜)、离子晶体(如氯化钠NaCl)是原子晶体的例子。
在金属晶体中,金属原子通过金属键结合,形成具有电子云的电子海。
在离子晶体中,正负离子通过离子键相互吸引形成晶体结构。
2. 分子晶体:
•构建单位:在分子晶体中,基本的构建单位是分子。
分子通过分子间的力(如范德华力、氢键、共价键等)相互结合,形成晶体结构。
•例子:葡萄糖、水合铜硫酸是分子晶体的例子。
在葡萄糖中,分子是由碳、氢、氧原子组成的葡萄糖分子,它们通过共价键结合在一起。
在水合铜硫酸中,分子是由铜、氧、硫、氢和水分子组成,它们通过范德华力等相互结合。
总的来说,原子晶体和分子晶体的区别在于它们构建晶体结构的基本单位:是原子还是分子。
在实际应用中,这两种类型的晶体具有不同的性质和特征。

第三章第二节分子晶体与原子晶体第一课时分子晶体教学目标1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
教学重点、难点重点掌握分子晶体的结构特点和性质特点难点是氢键的方向性和氢键对物体物理性质的影响从三维空间结构认识晶胞的组成、结构教学方法建议:运用模型和类比方法诱导、分析、归纳教学过程:[引入]我们已经知道,固体有晶体和非晶体之分,绝大多数常见的固体是晶体。
现在给出下列晶体的熔点:甲烷(-182.5℃)氮(-210.1℃)金刚石(3900℃)氧化铝(2030℃),氯化钠(801℃)同为晶体,为什么它们的熔点及其性质有如此大的差异呢?物质结构决定物质性质,我们需要探讨晶体的内部结构来回答这个问题。
分类研究是科学研究的基本方法之一,根据晶体结构的不同,我们把年个吨毫2分为若干类型,其中,只含分子的晶体称为分子晶体。
一、分子晶体1、定义:含分子的晶体称为分子晶体也就是说:分子间以分子间作用力相结合的晶体叫做分子晶体分子,就属于分子晶体问:还有哪些属于分子晶看图,如:碘晶体中只含有I2体?2、较典型的分子晶体有非金属氢化物,部分非金属单质,部分非金属氧化物,几乎所有的酸,绝大多数有机物的晶体。
3、分子间作用力和氢键过度:首先让我们回忆一下分子间作用力的有关知识阅读必修2 科学视野教师诱导:分子间存在着一种把分子聚集在一起的作用力叫做分子间作用力,也叫范徳华力。
分子间作用力对物质的性质有怎么样的影响?学生回答:一般来说,对于组成和结构相似的物质,相对分子量量越大分子间作用力越大,物质的熔、沸点也越高。
教师诱导:但是有些氢化物的熔点和沸点的递变却与此不完全符合,如:NH3、H2 O和HF的沸点就出现反常。



HXC60P106, P1010都形成分子晶体,只有很少的一部分和______SiO2,碳化硅,第二节分子晶体和原子晶体一、分子晶体(一)、概念:分子间以______________________ (_____________ , ________________ )相结合的晶体叫分子晶体。
注意:(1)构成分子晶体的粒子是 ______________________ 。
(2 )在分子晶体中,分子内的原子间以结合,而相邻分子靠或相互吸引。
(3 )范德华力化学键的作用:(4 )分子晶体熔化破坏的是O(二)•分子晶体的物理特性:(1)___ 的熔点和沸点,(2) ______________ 的硬度,________ 挥发, _________ 升华(3)—般都是________ 体,固体和熔融状态都__________________ 导电。
(4)分子晶体的溶解性与溶质和溶剂的分子的___________________ 相关一一____________________思考:1、为什么分子晶体熔沸点低、易挥发、易升华、硬度小?原因:分子晶体发生这些变化时_只破坏 __________________________ , ________________ 很弱,克服它时需要的能量小。
所以分子晶体熔沸点低、易挥发、易升华、硬度小。
2、为什么分子晶体在晶体和熔融状态均不导电?它们在晶体和熔融状态均不存在_______________________ 。
部分分子晶体溶于水在水分子作用下发生_____________ 导电,如HCI, H2S04 ;有些溶于水与水反应生成_______________________________ 而导电,晶体硼等。
)(四)分子晶体结构特征1. ______________________________ __ 分子密堆积每个分子周围有______________ 个紧邻的分子,如:C60、干冰、12、02——不具有分子密堆积特征P1,CH4,2,冰中1个水分lmol冰周I韦]有mol氢键。
原子晶体分子晶体
摘要:
一、原子晶体和分子晶体的概念
二、原子晶体和分子晶体的区别
三、原子晶体和分子晶体的性质和应用
正文:
原子晶体和分子晶体是两种常见的晶体类型,它们在结构、性质和应用上都有所不同。
原子晶体是由原子通过共价键以空间网状结构形成的晶体。
例如,金刚石、晶体硅和二氧化硅等物质都是原子晶体。
在原子晶体中,原子之间通过共价键结合在一起,形成一个三维的、有序的结构。
这种结构具有较高的熔点、沸点和硬度,因此在工业上具有广泛的应用。
分子晶体是由分子通过分子间作用力结合而成的晶体。
例如,冰、干冰和氧气等物质都是分子晶体。
在分子晶体中,分子之间通过范德华力或氢键结合在一起,形成一个二维的、无序的结构。
这种结构具有较低的熔点、沸点和硬度,因此在制冷、保鲜和运输等领域具有广泛的应用。
原子晶体和分子晶体的区别在于它们的结构和结合方式。
原子晶体是由原子通过共价键结合而成的,具有较高的熔点、沸点和硬度;分子晶体是由分子通过分子间作用力结合而成的,具有较低的熔点、沸点和硬度。
原子晶体和分子晶体的性质和应用也不同。
原子晶体具有较高的熔点、沸点和硬度,因此在工业上广泛应用于制造高强度、高硬度的材料,如切削刀
具、钻头和模具等。
分子晶体具有较低的熔点、沸点和硬度,因此在制冷、保鲜和运输等领域具有广泛的应用。
综上所述,原子晶体和分子晶体在结构、性质和应用上都有所不同。
第二节分子晶体与原子晶体① C60②干冰:CO2的晶体。
分子间存在范德华力,熔点低,易升华,制冷剂。
〔2〕冰的晶体:氢键型晶体、每个水分子周围只有4个紧邻的水分子、正四面体形。
特点:4℃密度最大。
教学过程教学步骤、内容教学方法、手段、师生活动[引入]咱们在第二章中已学过分子间作用力,在必修中也学过离子键和共价键,有谁总结一下微粒间的作用力有哪些?〔讨论〕[师生共同总结]微粒间作用:微粒为分子:分子间作用力〔或范德华力〕或氢键;微粒为原子:极性共价键或非极性共价键;微粒为离子:离子键。
[过渡]今天我们开始研究晶体中微粒间的作用力。
[板书]第二节分子晶体与原子晶体一、分子晶体[讲]只含分子的晶体称为分子晶体。
如碘晶体只含I2分子,属于分子晶体。
在分子晶体中,分子内的原子间以共价键结合,而相邻分子靠分子间作用力相互吸引。
[板书]1、分子晶体:(1) 定义:由分子构成。
相邻分子靠分子间作用力相互吸引。
(2) 构成微粒:分子[讲]稀有气体为单原子分子。
也是分子晶体[板书](3) 微粒间的作用[讲]分子间作用力,部分晶体中存在氢键。
分子晶体采纳密堆积。
[设咨询]依照分子间作用力较弱的特点判定分子晶体的特性有哪些?参照表3-2。
[投影][讲]分子间作用力的大小决定了晶体的物理性质。
分子晶体要熔化、要汽化都要克服分子间的作用力。
分子的相对分子质量越大,分子间作用力越大,物质的熔沸点越高,硬度越大。
比如氧气分子间作用力比氮气分子间作用力大,氧气沸点比氮气沸点高。
工业上制氧气,确实是先把空气液化,然后使液态空气蒸发,氮气第一从液态空气中蒸发出来,剩下的要紧是液态氧气。
由于分子间作用用专门弱,克服分子间作用力使物质熔化、汽化所需要的能量较小,因此,分子晶体具有较低的熔沸点和较小的硬度。
分子晶体熔化时,一样只破坏分子间作用力,不破坏分子内的化学键,但也有例外。
如硫晶体熔化时,既破坏了分子间的作用力,同时部分S-S键断裂,形成更小的分子。